Методика вскрытия и извлечения органов лабораторных животных. Сообщение 3: хомячок
Коптяева К.Е., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Методика вскрытия и извлечения органов лабораторных животных. Сообщение 3: хомячок. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-02
Резюме
Представлено 3-е сообщение из цикла статей по методологии вскрытия и извлечения органов лабораторных животных, в котором подробно описана и проиллюстрирована методика последовательного и полного вскрытия и извлечения органов лабораторных хомячков. Среди лабораторных животных хомячки занимают особое место из-за наличия в их пищеварительном аппарате крупных защечных мешков. Большая площадь слизистой оболочки, выстилающей защечные мешки изнутри, позволяет наглядно продемонстрировать и исследовать местнораздражающее действие орально диспергируемых лекарственных форм (таблетки для рассасывания), которые с легкостью помещаются в полости защечных мешков. В данной статье продемонстрирована процедура некропсии лабораторных хомячков. Описаны процессы подготовки животного к вскрытию, проведения первичного осмотра трупа после эвтаназии на наличие внешних изменений и повреждений, фиксации трупа на препаровальном столе, вскрытия и изучения внутренних полостей организма, а также исследования поверхностных лимфатических узлов. Описаны и проиллюстрированы возможные методы извлечения органов ротовой полости (в том числе извлечение языка, глотки, а также защечных мешков вместе с прилежащими слюнными железами), всех органов грудной, брюшной и тазовой полостей. Проиллюстрировано топографическое расположение некоторых органов грудной, брюшной и тазовой полостей. Рассмотрены 2 способа извлечения головного мозга вместе с обонятельными луковицами, метод отделения препаратов грудной кости для гистологического исследования костного мозга и верхней челюсти для гистологического исследования носовых ходов. Статья содержит описания процедуры подготовки спинного мозга к фиксации в формалине без извлечения его из позвоночного канала, извлечения глаз вместе со слезной железой и веками, извлечения мышц и прилежащих к ним периферических нервов. Способы извлечения и последовательность выполняемых действий, рассмотренные в данной статье, обеспечивают минимизацию повреждений извлекаемых органов, предотвращение их загрязнения для недопущения возникновения некоторых артефактов, выявляемых при последующем гистологическом исследовании.
Введение
Хомячки, наряду с другими лабораторными грызунами, достаточно часто используются в доклинических исследованиях лекарственных препаратов (ЛП). Наиболее распространено их применение при анализе безопасности лекарственных средств (ЛС), выпускающихся в форме таблеток, диспергируемых в полости рта (орально диспергируемые таблетки) из-за особенности строения пищеварительного аппарата, а именно – наличия крупных защечных мешков и большой протяженности слизистой оболочки, выстилающей их изнутри.
При этом в подобных исследованиях для оценки местно-раздражающего действия изучается ротовая полость, язык и защечные мешки хомячков, из-за удобства введения в полости мешков упомянутых лекарственных форм (ЛФ).
Как указывалось в предыдущих статьях данного цикла [1, 2], некропсия и последующее гистопатологическое исследование органов и тканей являются основными методами изучения токсичности, без которых невозможна адекватная оценка результатов эксперимента.
Цель данной работы – разработка методики вскрытия и извлечения органов лабораторных хомячков.
Разработка методики в «НПО «Дом Фармации» проводилась на самцах и самках сирийских хомячков (n=100). Масса животных составляла 120–150 г. Для исследования использовали животных, подлежащих эвтаназии в ходе текущих экспериментов. Животные были подвергнуты эвтаназии с помощью СО2-камеры [4]. После установления факта смерти проводили некропсию с извлечением органов.
Методика вскрытия и извлечения органов хомячков
1. В зависимости от метода эвтаназии и наличия/отсутствия необходимости забора крови, вскрытие грудной полости проводится в начале или по ходу некропсии (при обескровливании открытым способом вскрытие грудной полости проводят непосредственно после наркотизации животного).
2. Провести внешний осмотр животного на наличие внешних изменений кожного покрова, слизистых оболочек, обнаружения любого рода повреждений.
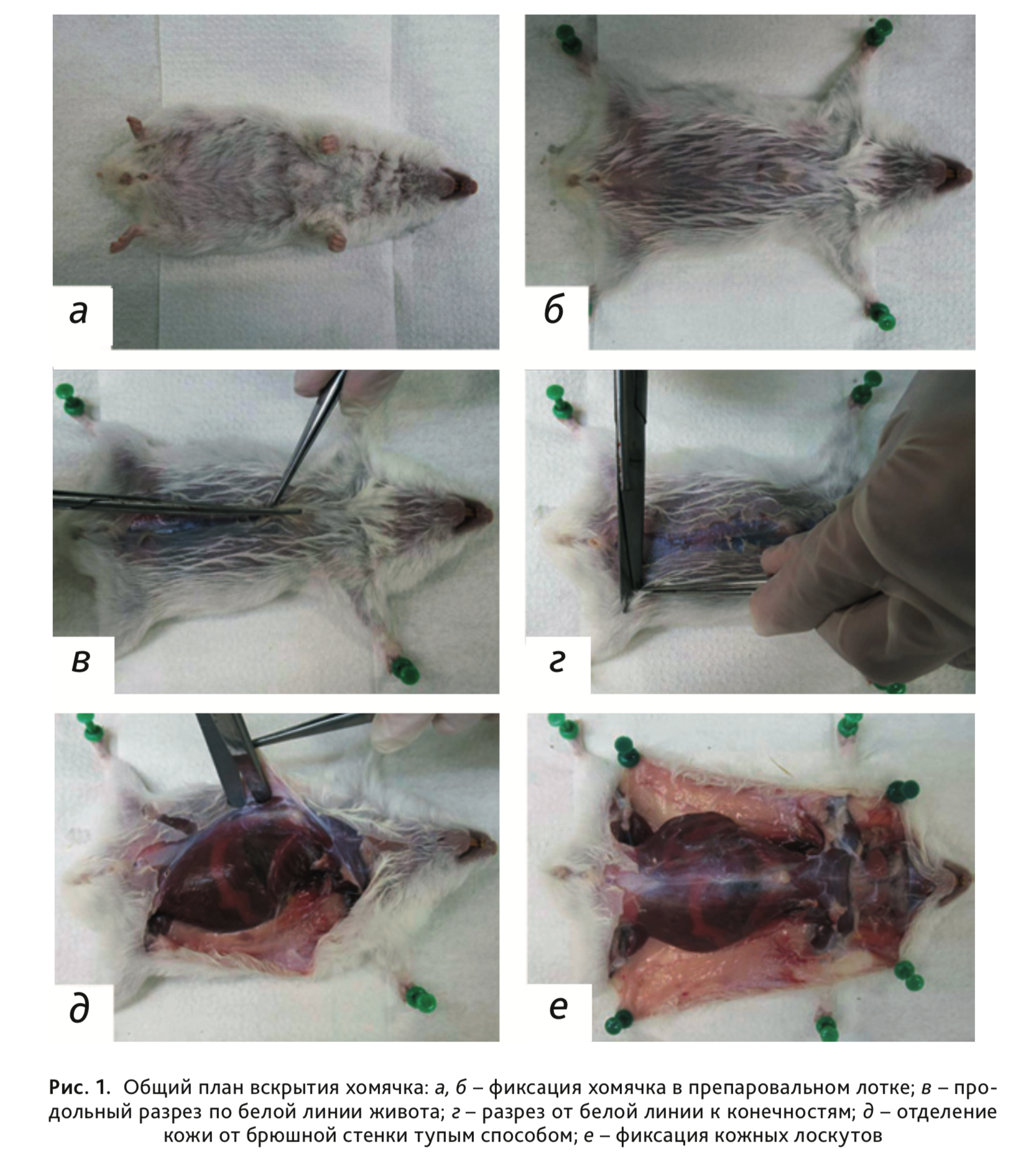
3. Положить труп животного на спину и зафиксировать конечности при помощи иголок в препаровальном лотке (рис. 1, а).
4. Смочить шерстный покров шеи, грудной и брюшной стенки антисептическим раствором, например, «Аживика-спрей».
5. Пинцетом захватить и приподнять кожу с подлежащей подкожной клетчаткой в нижней части живота, надрезать ее и сделать продольный разрез по белой линии живота от паха до основания нижней челюсти таким образом, чтобы брюшная стенка осталась неповрежденной (рис. 1, б, в).
6. Сделать по два разреза кожи в области паха от средней линии к конечностям (рис. 1, г).
7. Отсепарировать кожу в области брюшной стенки тупым концом ножниц или аккуратно, стараясь не сдавливать брюшную стенку, отделить кожу пальцами (рис. 1, д), далее оттянуть и зафиксировать иголками на препаровальном лотке таким образом, чтобы не повредить защечные мешки (рис. 1, е).
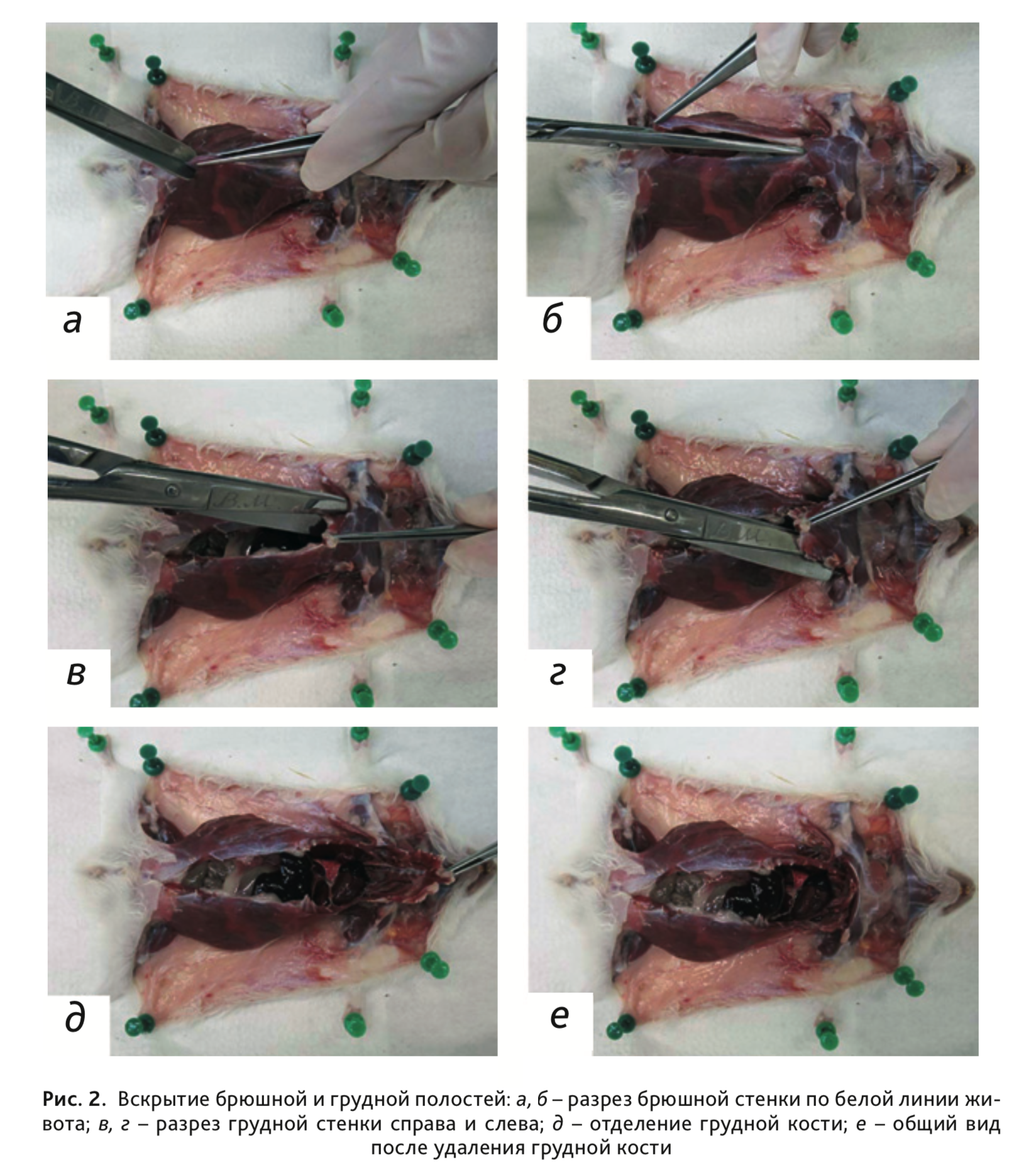
8. Для вскрытия брюшной полости необходимо сделать разрез мышечной стенки от паха вдоль средней линии, приподняв пинцетом участок брюшной стенки (рис. 2, а, б).
9. При обескровливании открытым способом грудная полость уже будет вскрыта. При ином способе эвтаназии грудную полость необходимо вскрыть двумя разрезами (слева и справа) по бокам от грудины (по средне-подмышечной линии) косо вверх, перерезая ребра и мягкие ткани (рис. 2, в–г).
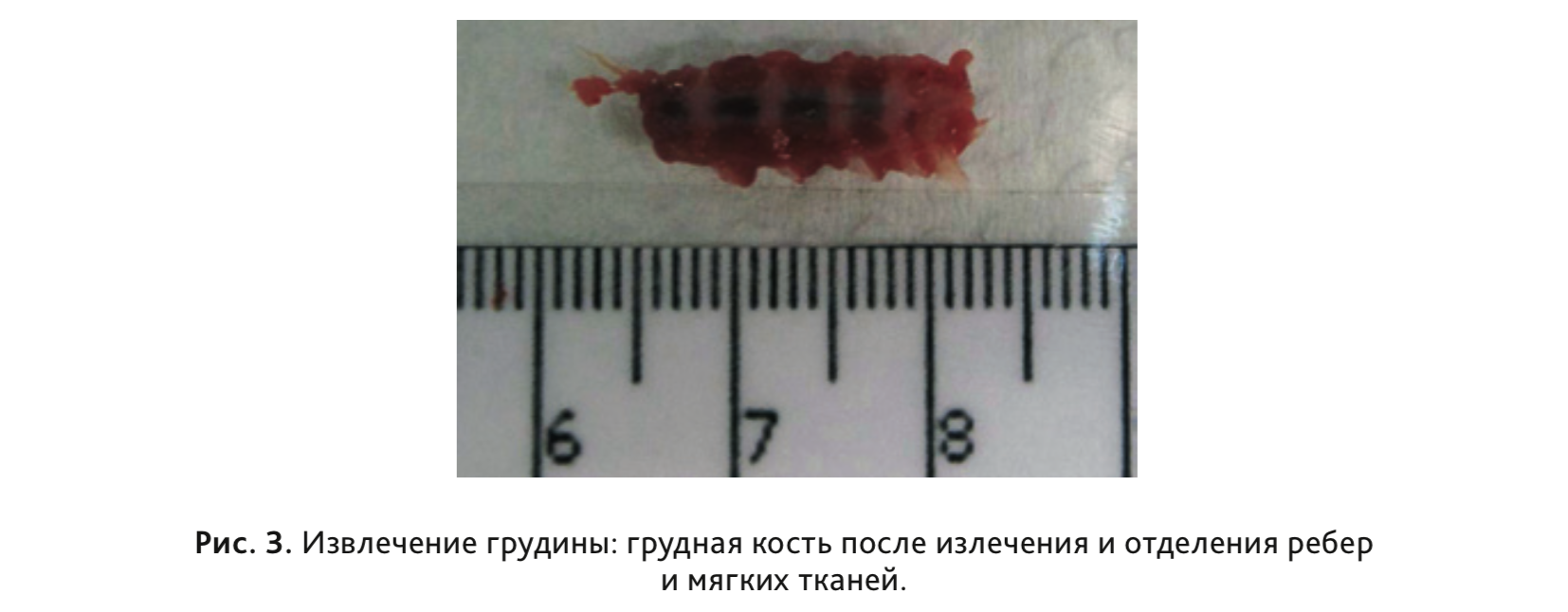
10. Для исследования костного мозга отобрать грудную кость целиком, отделив от нее мечевидный отросток, ребра и мягкие ткани (рис. 3).
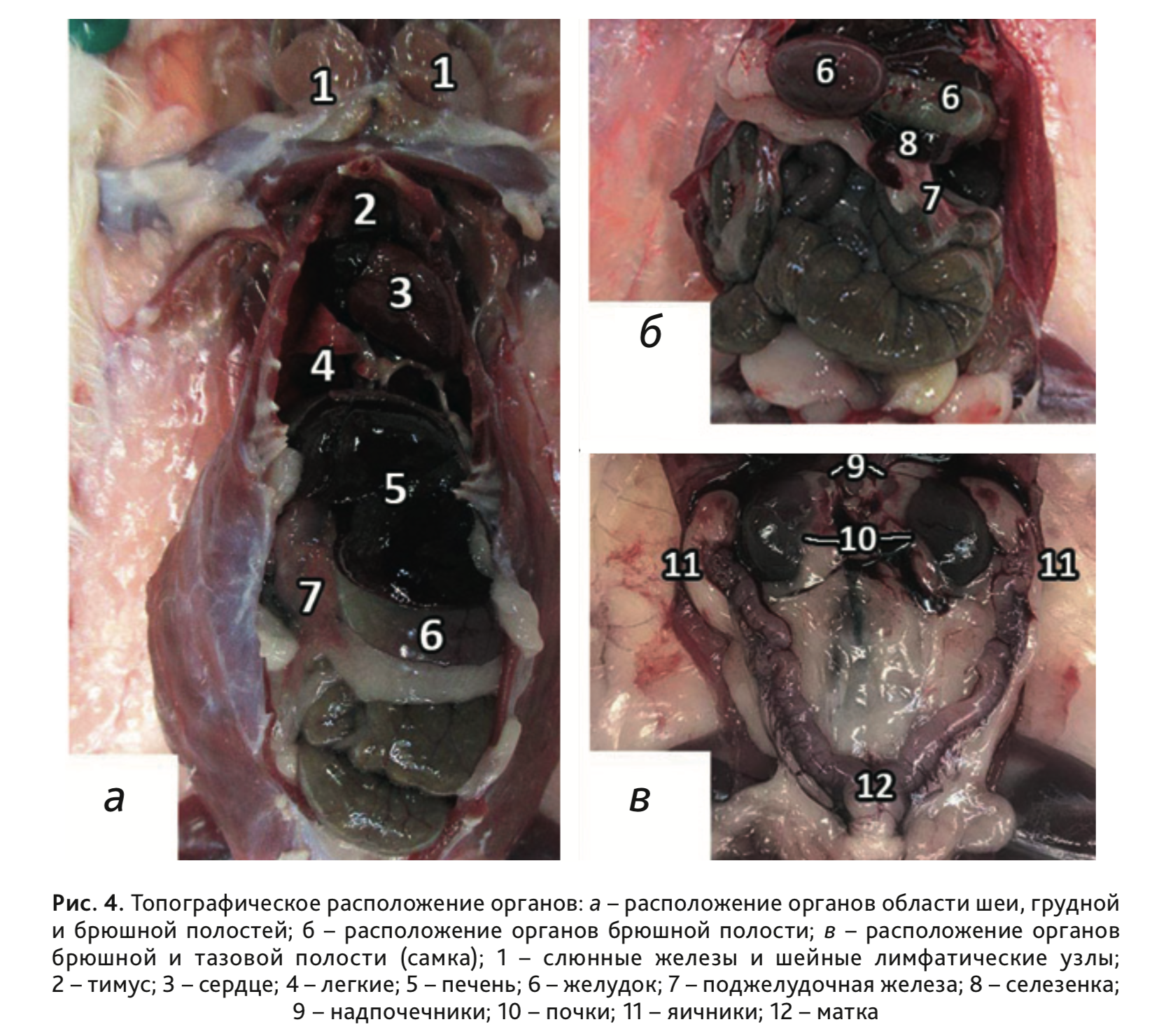
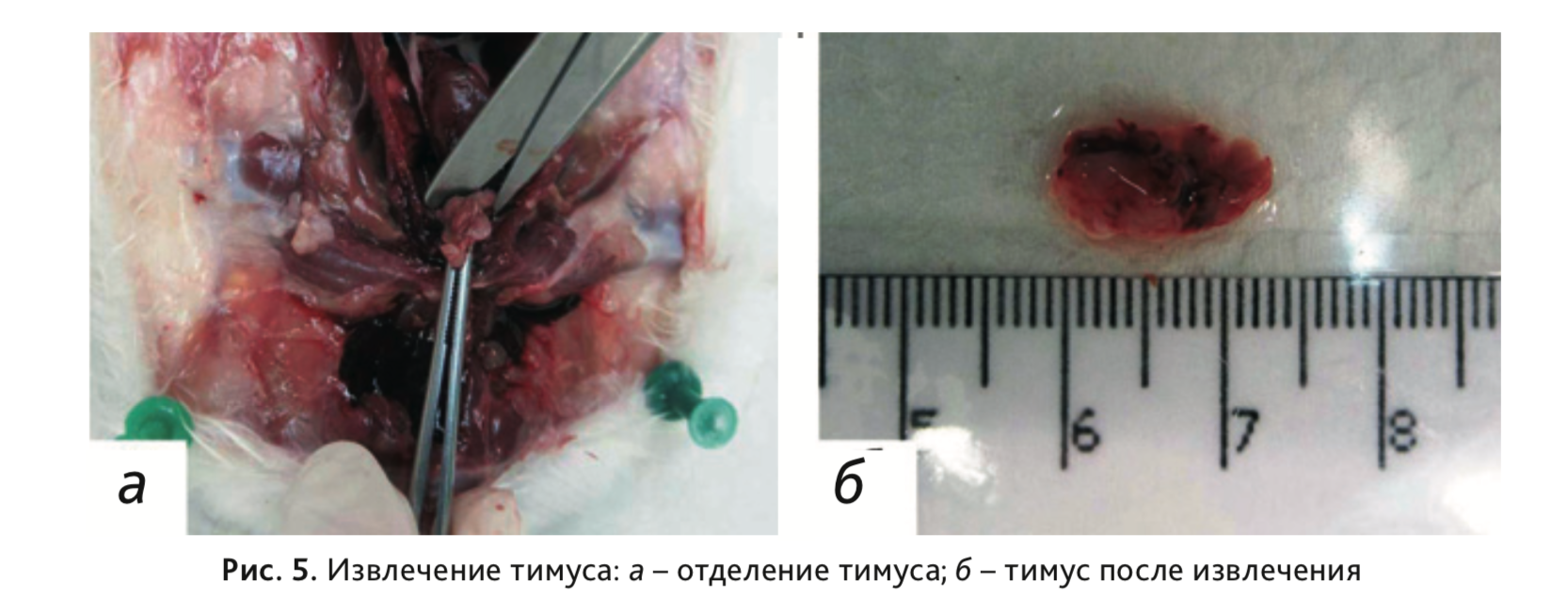
11. Извлечь тимус, расположенный у основания шеи над сердцем (рис. 5).
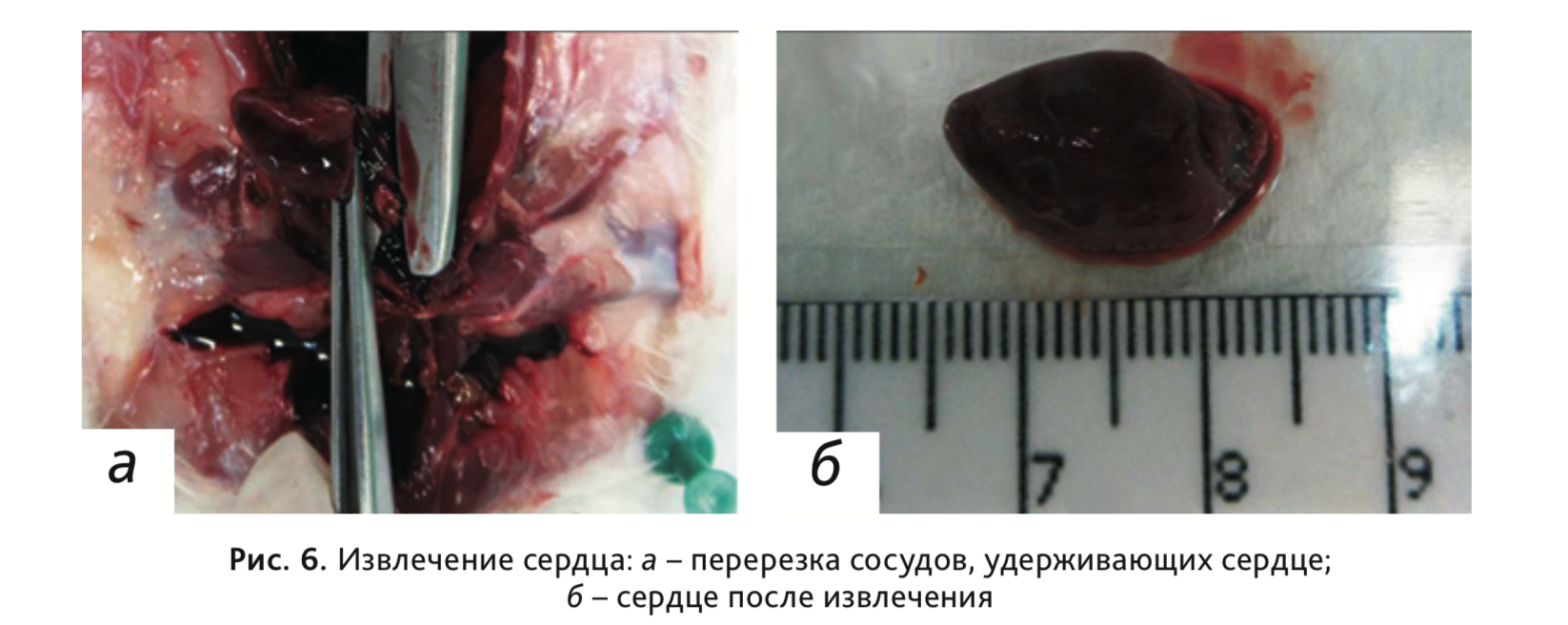
12. Извлечь сердце, перерезав удерживающие его сосуды (рис. 6).
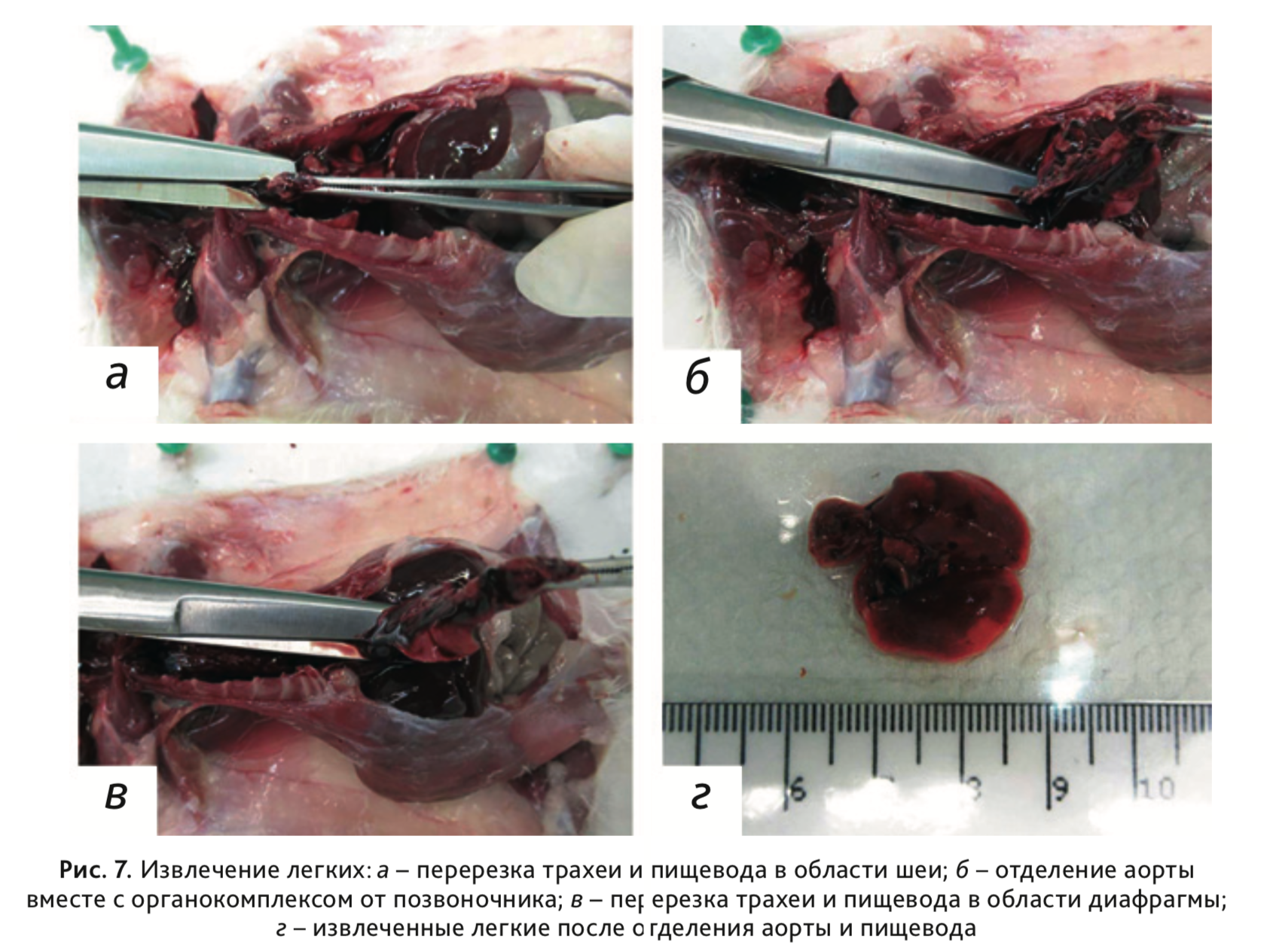
13. Для извлечения легких, трахеи, пищевода и аорты перерезать зафиксированные пинцетом трахею, пищевод и аорту в
области шеи (рис. 7, а). Затем, аккуратно подтягивая органокомплекс вверх, отделить аорту от позвоночника
(рис. 7, б), после чего перерезать трахею и пищевод в области диафрагмы
(рис. 7, в) и
извлечь органокомплекс (рис. 7, г).
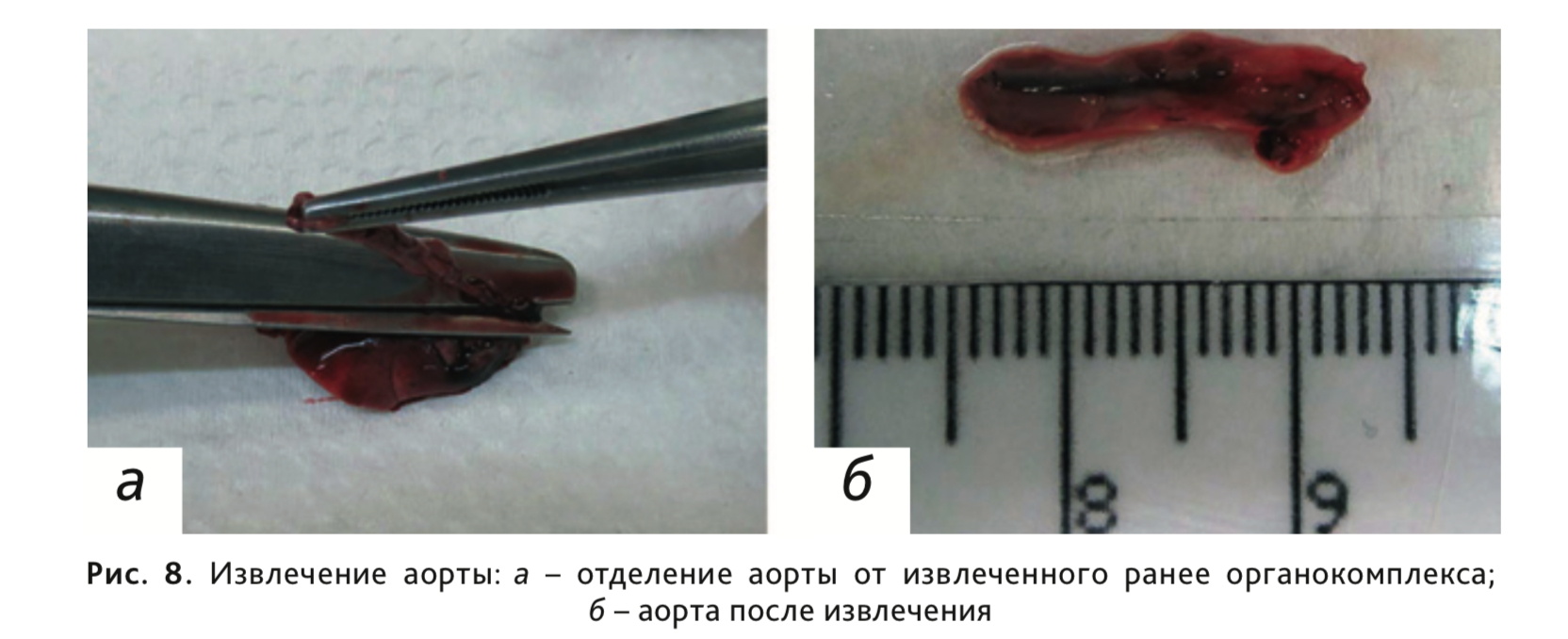
14. Отделить аорту от извлеченного ранее органокомплекса (рис. 8).
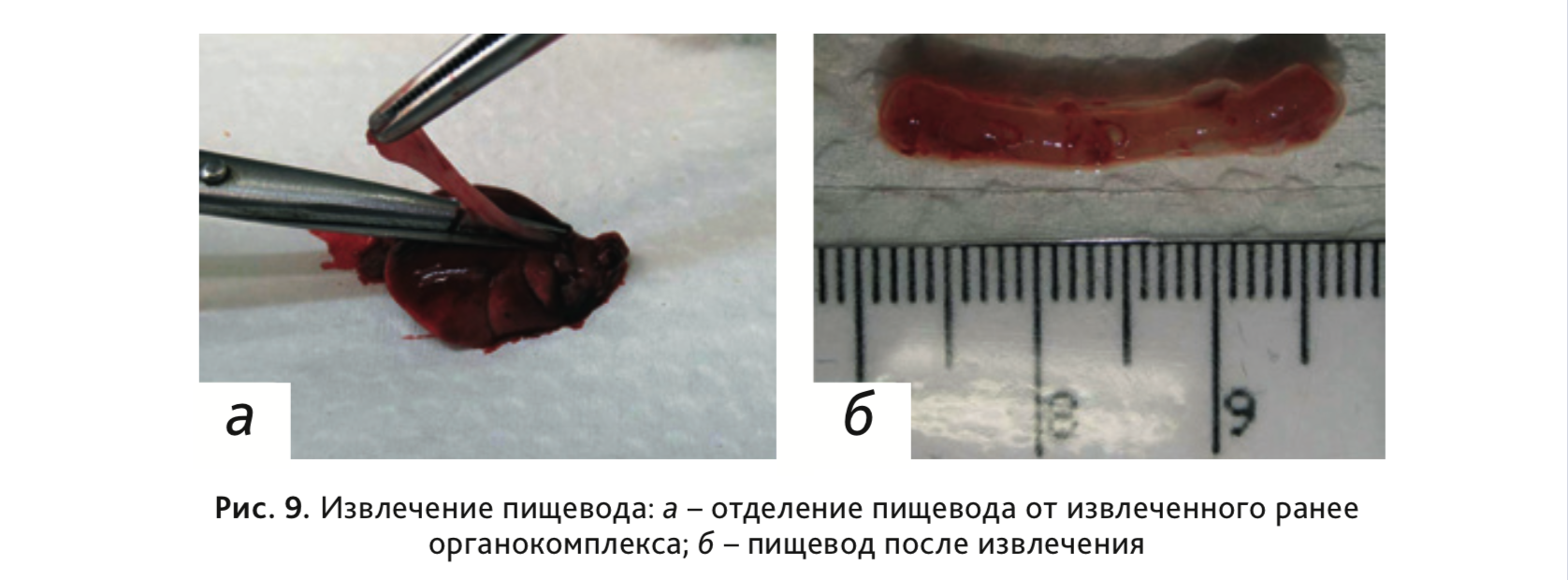
15. Отделить пищевод от извлеченного ранее органокомплекса (рис. 9).
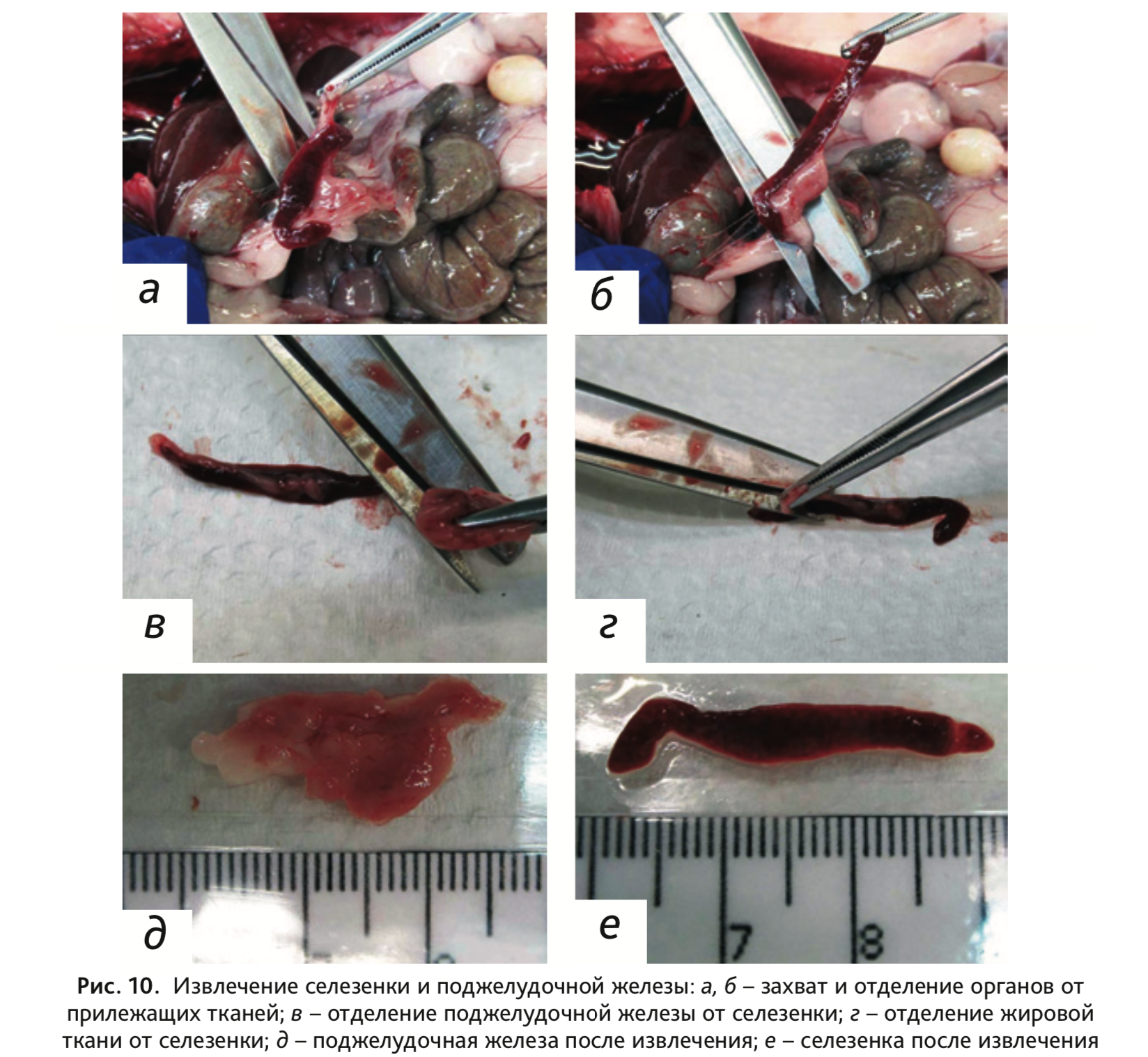
16. Извлечь селезенку, расположенную в области левого подреберья брюшной полости, слева от желудка (рис. 10, а, б), вместе с поджелудочной железой. Далее отделить селезенку от прилежащей поджелудочной железы и жировой ткани (рис. 10, в, г).
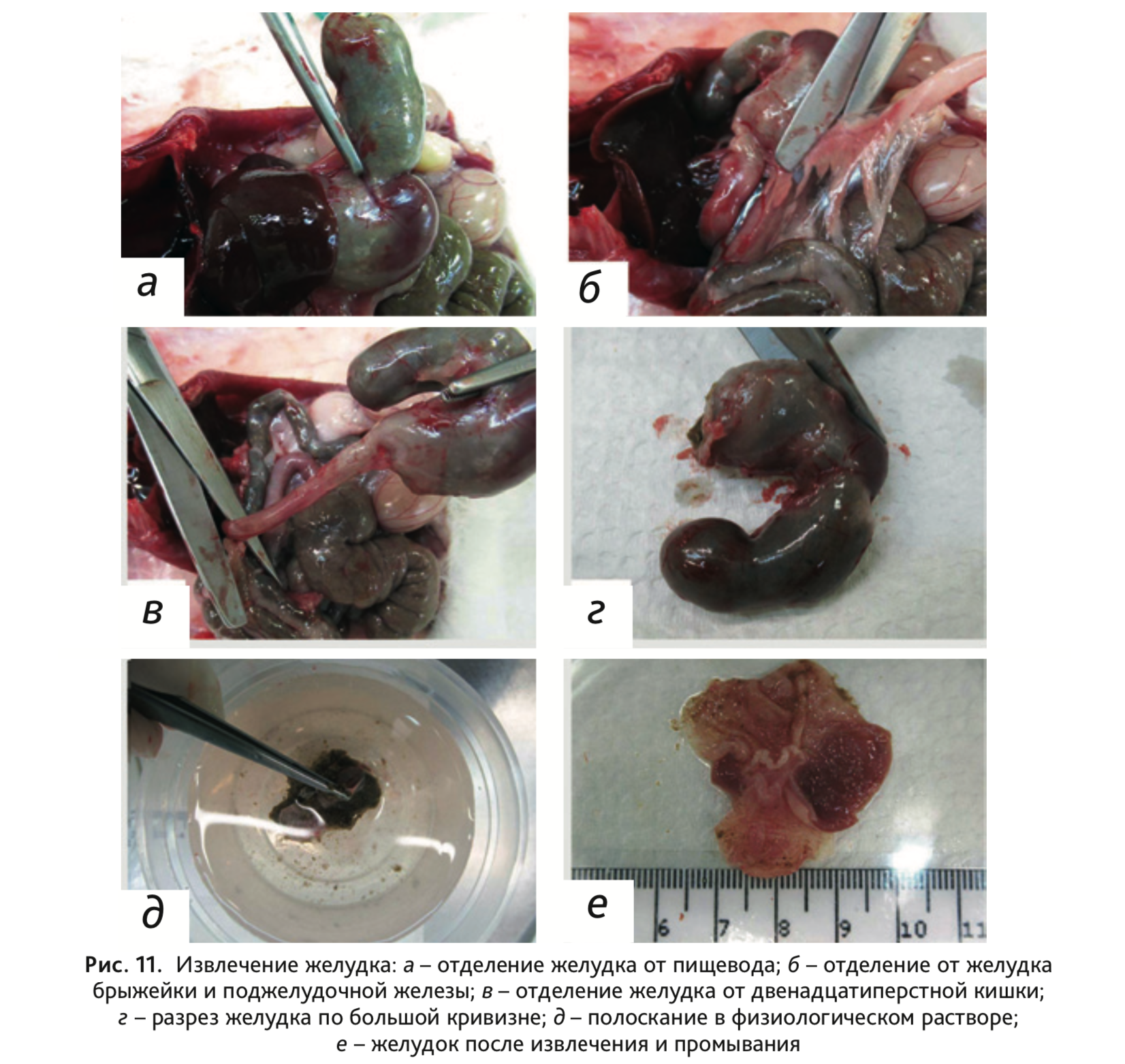
17. Извлечь желудок, отделив его в верхней части от пищевода (рис. 11, а),
а в нижней – от
двенадцатиперстной кишки (рис. 11, б). Сделать разрез желудка по большой кривизне (рис. 11, в) и
прополоскать в физиологическом растворе
(рис. 11, г), освободив его от содержимого.
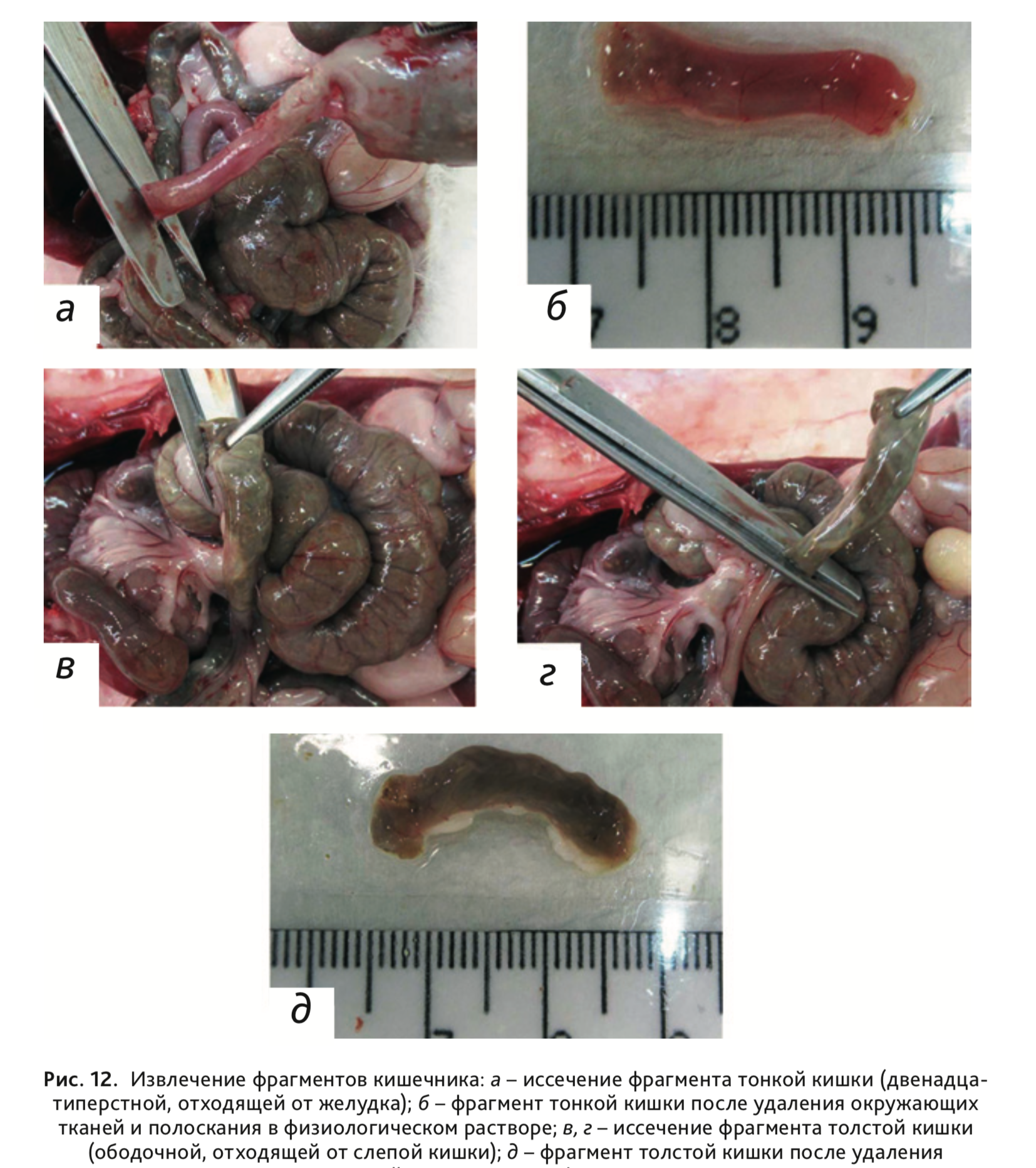
18. Извлечь фрагменты тонкой и толстой кишки длиной 0,5 –1,5 см: тонкую –
отступив от желудка 0,5
см (рис. 12, а, б), толстую – отступив от слепой кишки
0,5 см (рис. 12, в–д).
После извлечения отделить от окружающих тканей и освободить от содержимого, прополоскав в физиологическом растворе
натрия хлорида.
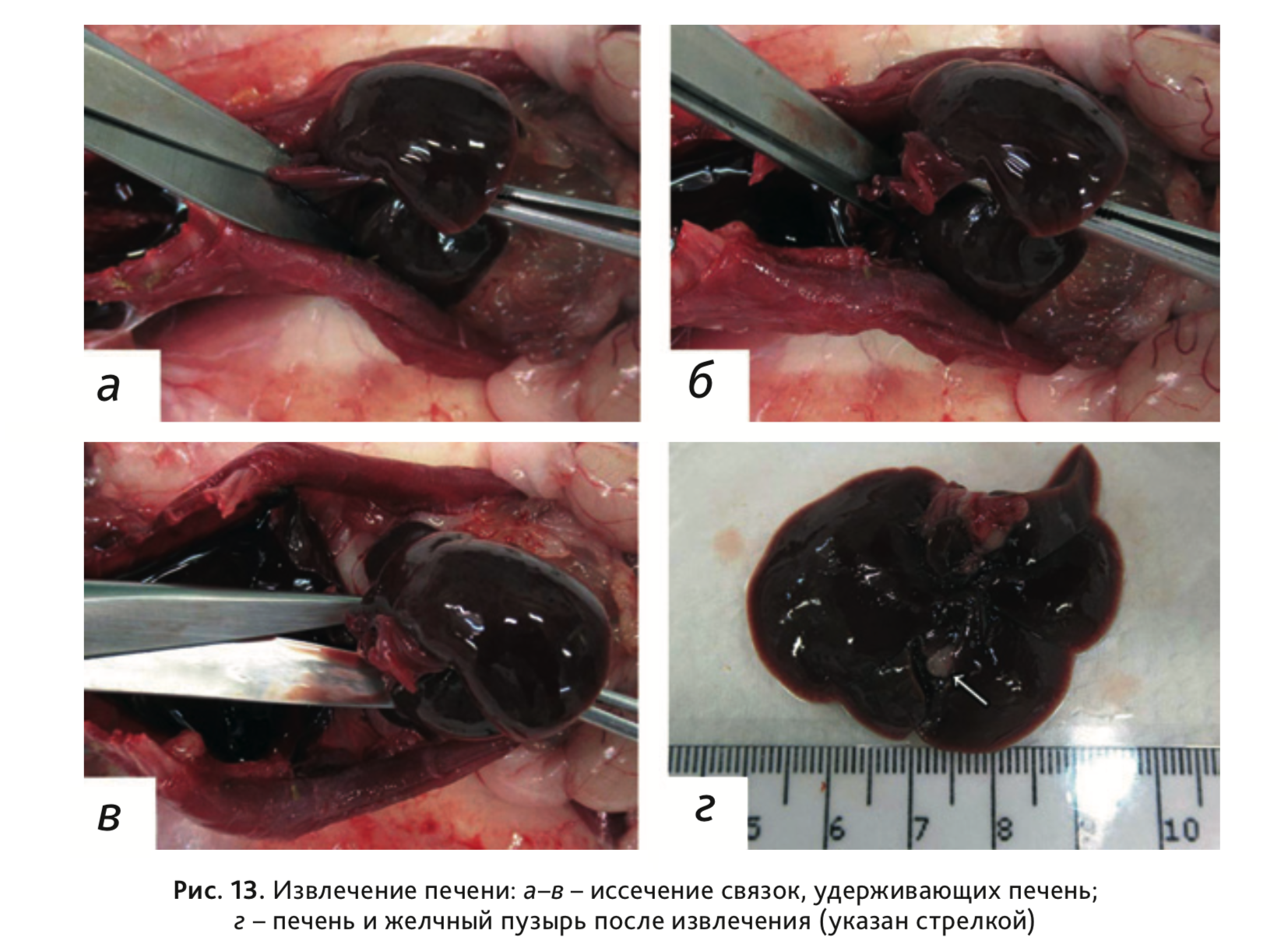
19. Извлечь печень вместе с желчным пузырем. Для этого перерезать удерживающие орган серозные связки: венечную,
прикрепляющуюся к диафрагме, почечно-печеночную, желудочно-печеночную и печеночно-двенадцатиперстную
(рис. 13,
а–в). Печень помещается в фиксирующий раствор целиком, вместе
с желчным пузырем.
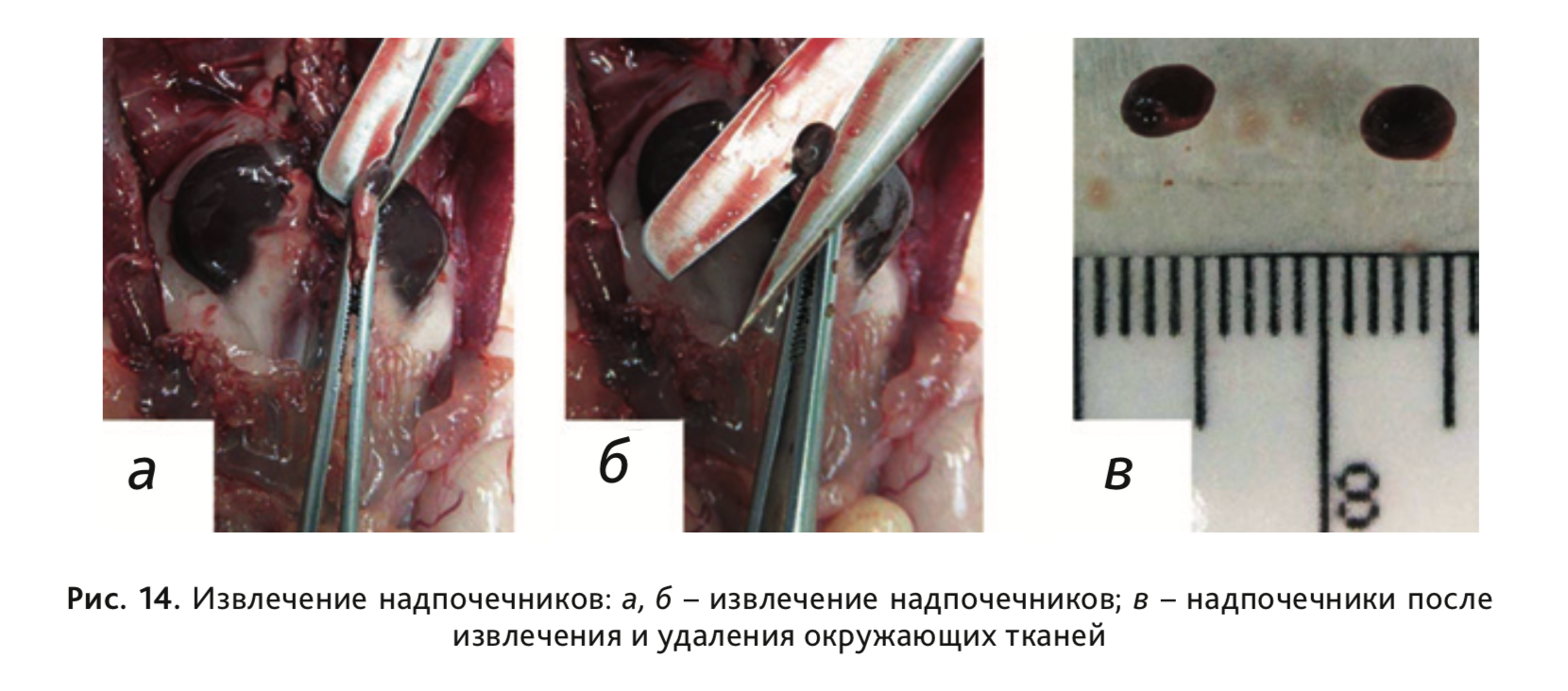
20. Извлечь надпочечники (рис. 14 а, б) и отделить от окружающей жировой ткани (рис. 14, в).
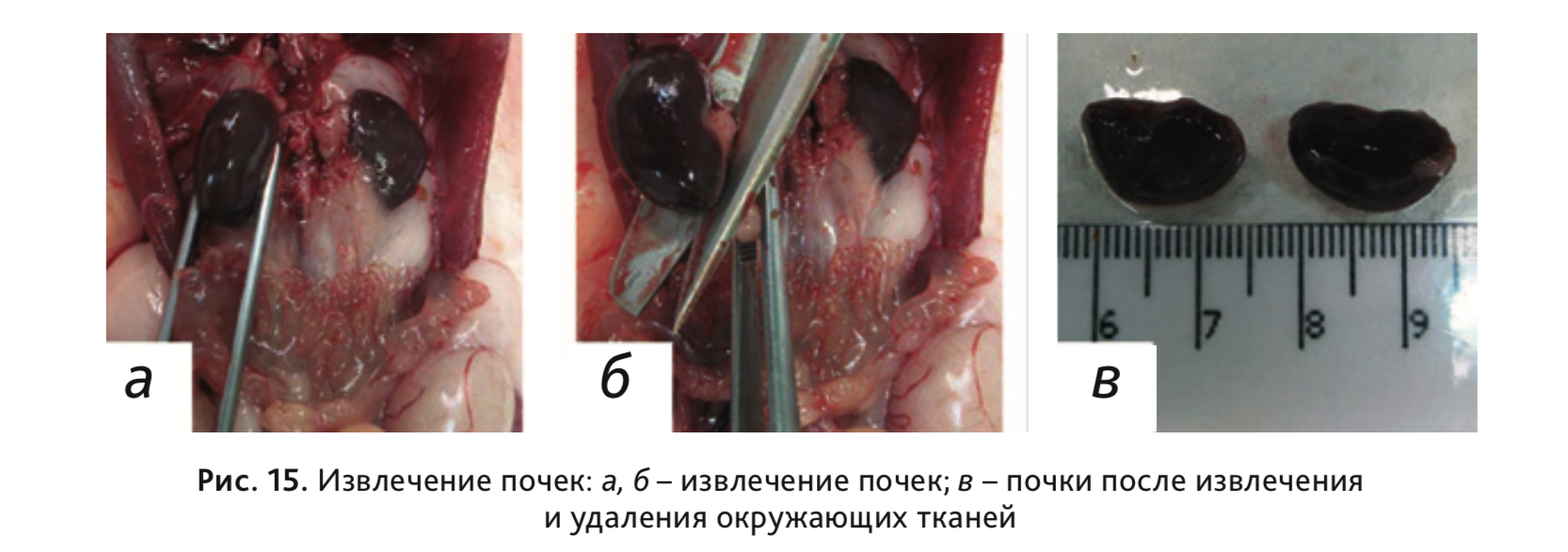
21. Извлечь почки (рис. 15, а, б) и отделить от окружающей жировой ткани
(рис. 15, в).
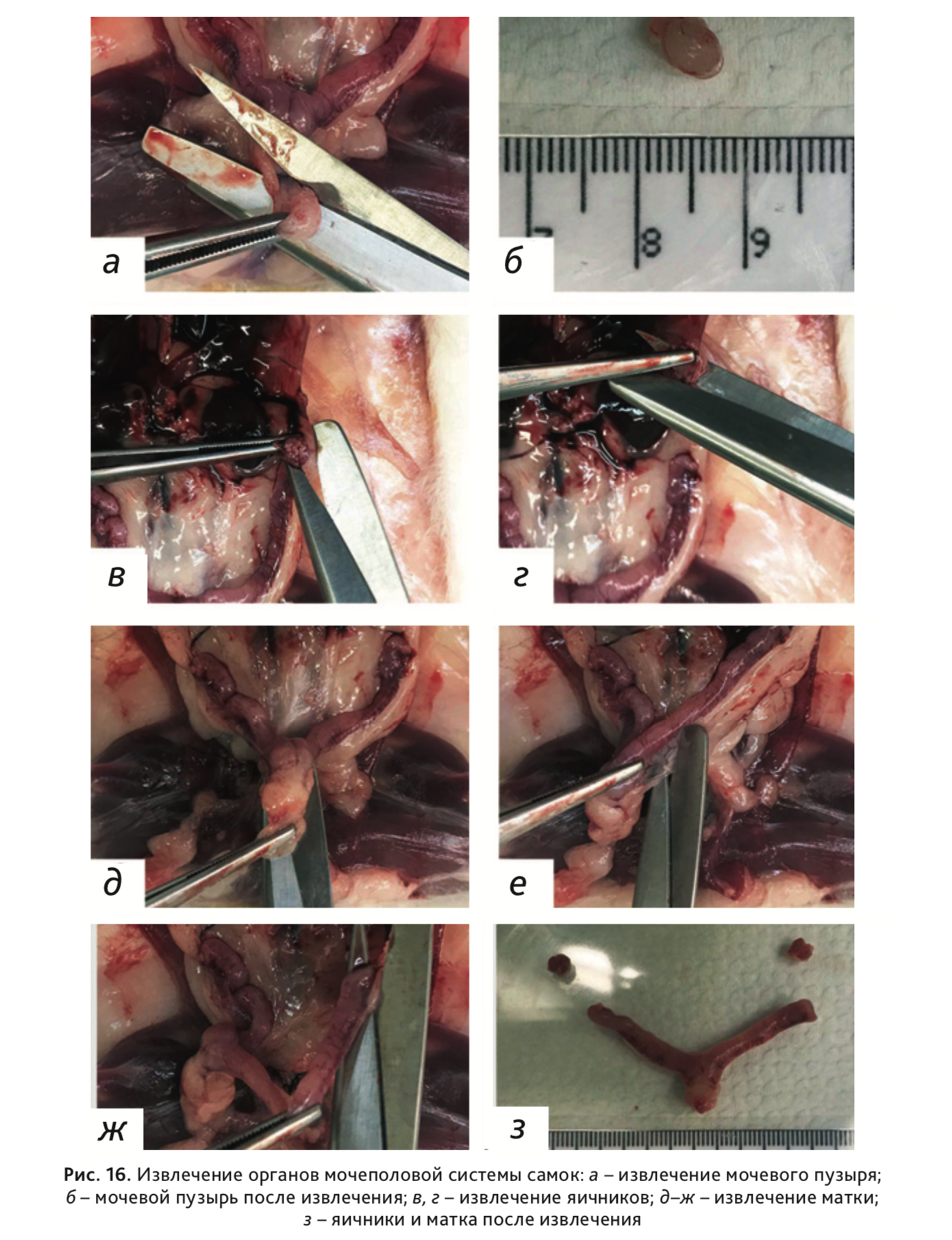
22. У самок:
- Извлечь мочевой пузырь (рис. 16, а, б);
- Извлечь правый и левый яичники (рис. 16, в, г);
- Извлечь матку – шейку, тело и рога (рис. 16, д–з).
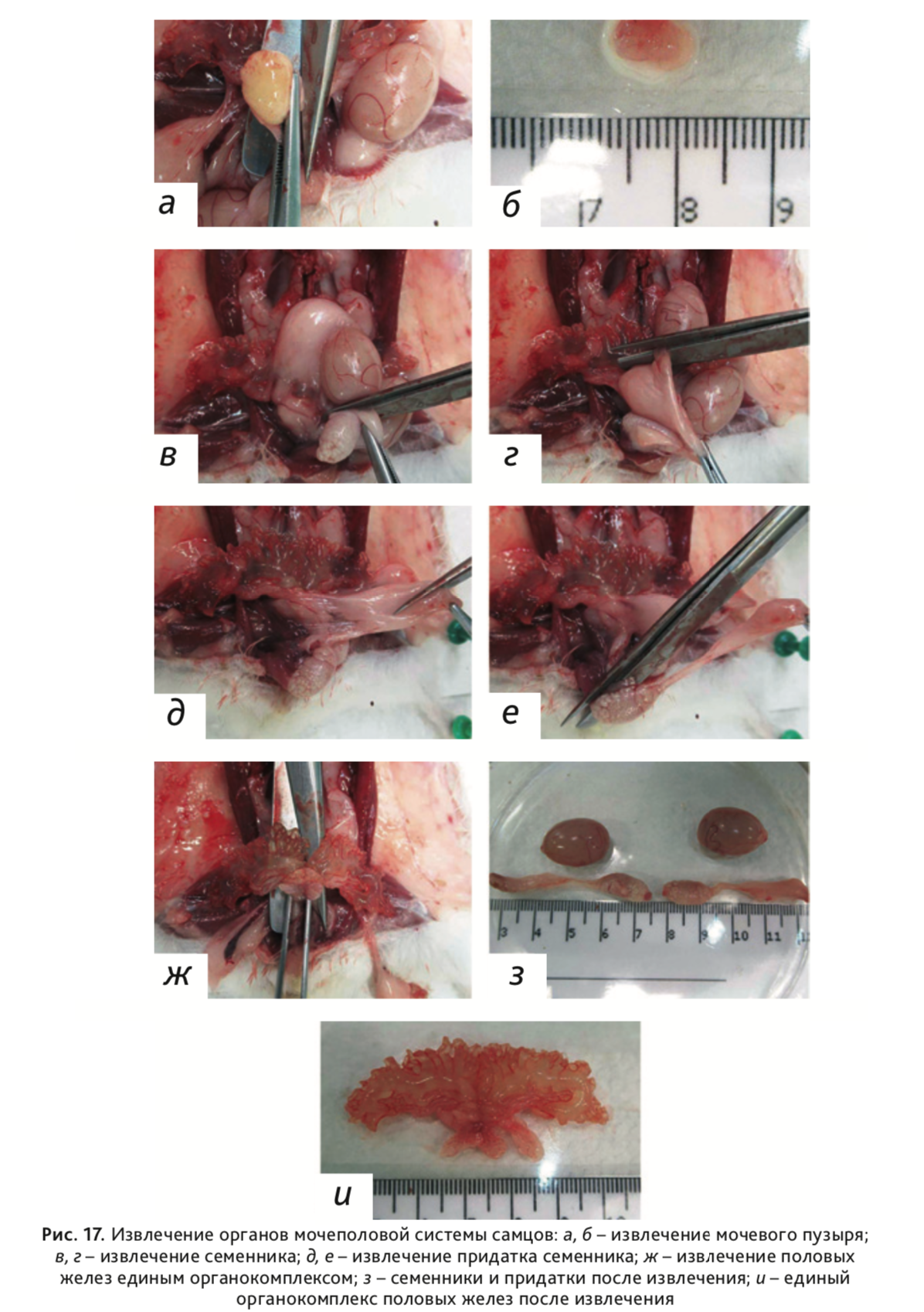
23. У самцов:
- Извлечь мочевой пузырь (рис. 17 а, б).
- Извлечь семенники и придатки (эпидидимисы). Отделить семенники от придатков (рис. 17, в, г), а после освободить придатки от окружающей их жировой ткани (рис. 17, д, е).
- Половые железы (простата, свертывающая железа, семенные пузырьки) извлечь единым органокомплексом (рис. 17, ж).
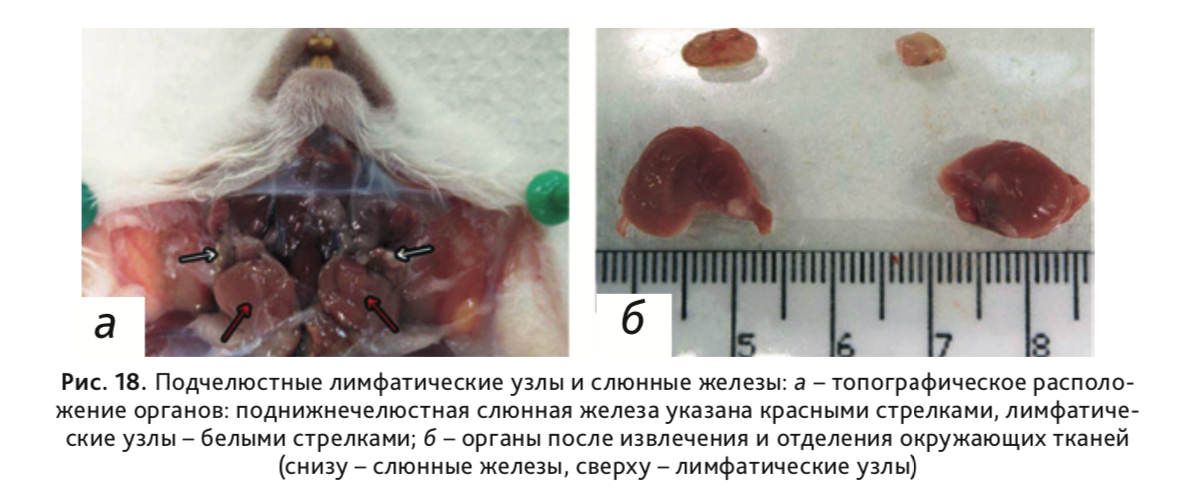
24. Извлечь поднижнечелюстную слюнную железу с поверхностными шейными лимфатическими узлами (рис. 18).
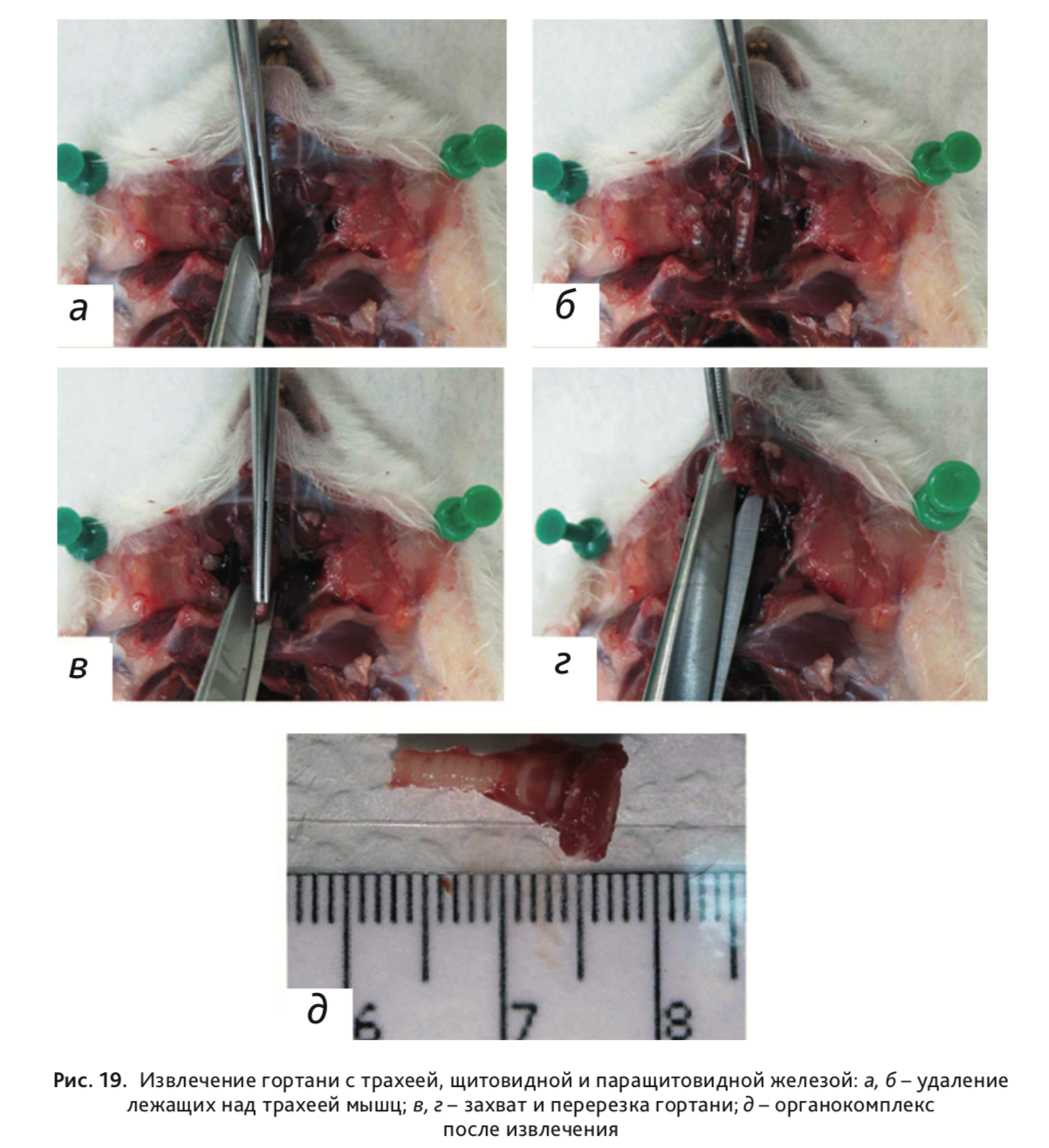
25. Удалить мышцы, лежащие над трахеей (рис. 19, а), и извлечь гортань с трахеей, щитовидной и паращитовидной железой (рис. 19, б–г).
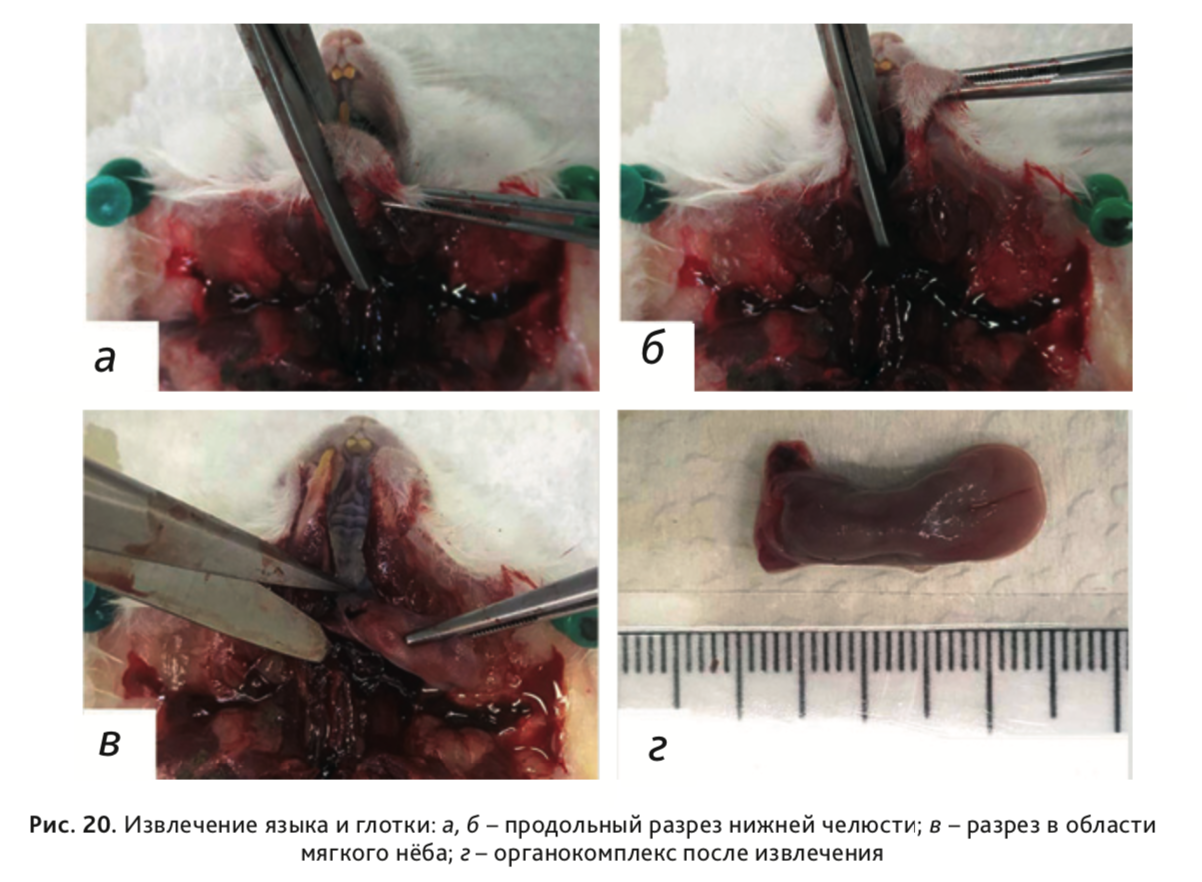
26. Для извлечения языка и глотки сделать продольный разрез нижней челюсти между резцами (рис. 20, а, б) таким образом, чтобы не повредить защечные мешки. После чего анатомическим пинцетом захватить кончик языка и сделать разрез у основания корня языка, отделив его от подъязычной кости (рис. 20, в). Далее разрезать ткани в области мягкого неба в дорсальном направлении, извлекая язык вместе с глоткой (рис. 20, г).
27. Извлечь молочные железы иссечением участка кожи в области живота (рис. 21).

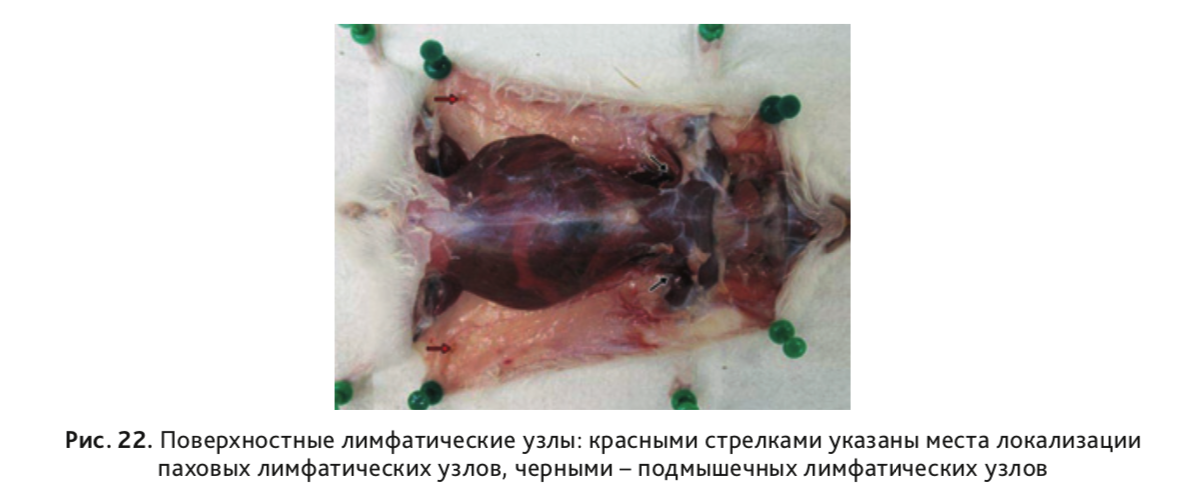
28. Извлечь поверхностные лимфатические узлы: подмышечные и паховые (рис. 22).
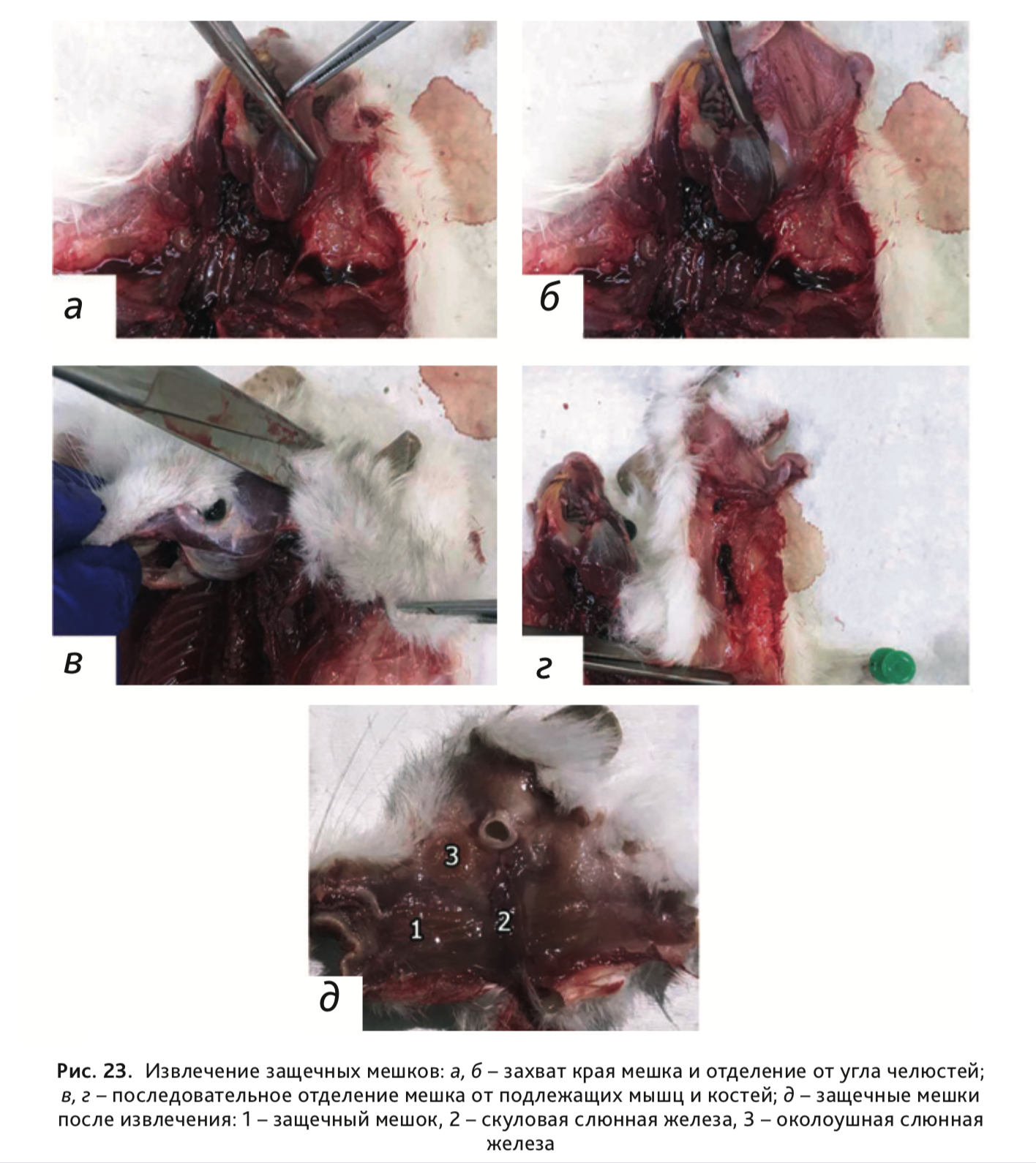
29. Извлечь левый и правый защечные мешки, простирающиеся от углов рта и до лопаток (в некоторых случаях могут заканчиваться на середине спины), вместе со скуловой и околоушной слюнной железой. Для этого захватить пинцетом край защечного мешка (рис. 23, а) и, стараясь не нарушить его целостность, последовательно отделить от подлежащих мышц и костей (рис. 23, б-г), захватив при этом ушную раковину, скуловую и околоушную слюнные железы (рис. 23, д).
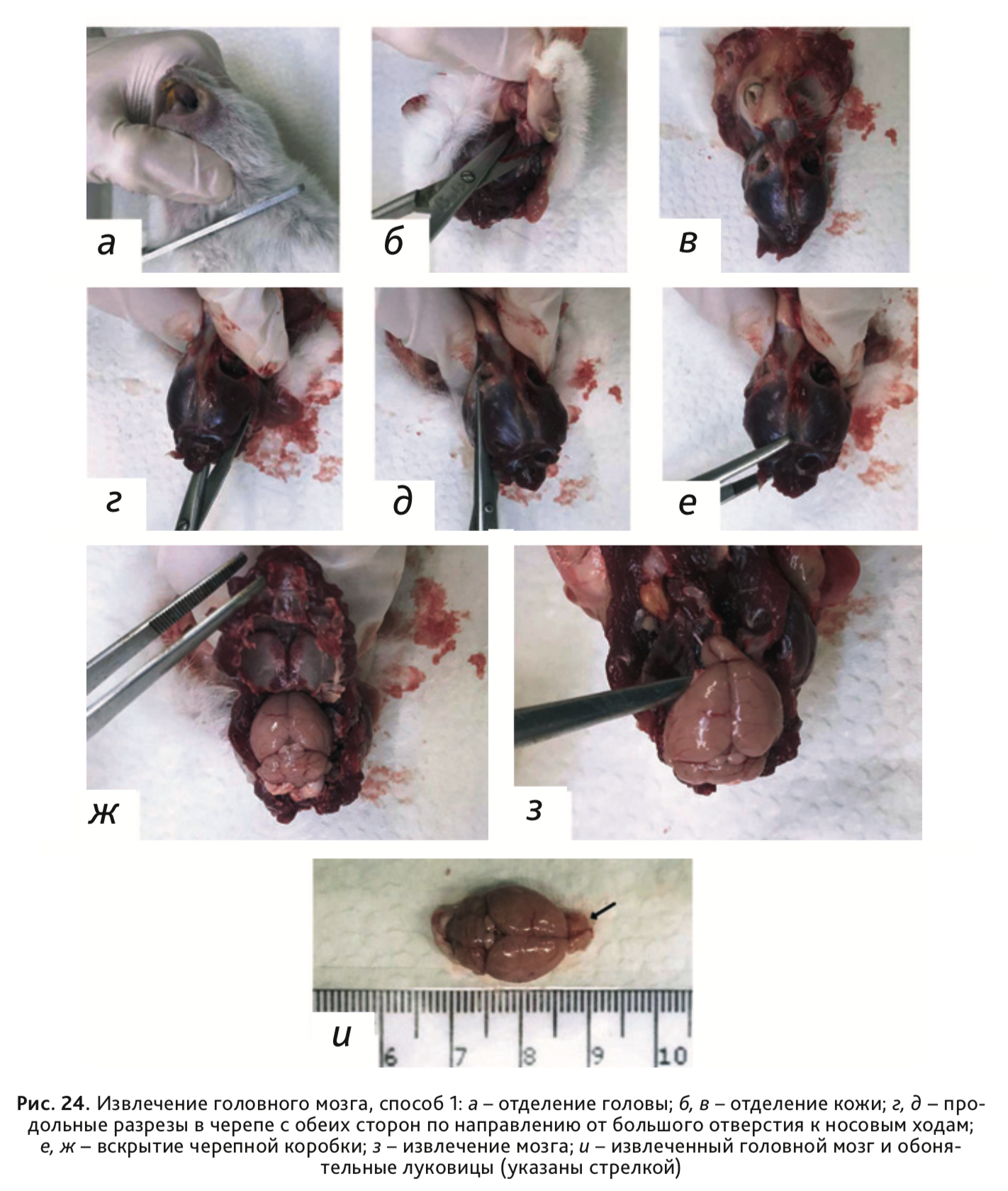
30. Извлечение головного мозга осуществляется двумя способами:
Способ 1: При помощи ножниц отрезать голову по линии между атлантом и черепом (рис. 24, а). Отпрепарировать от кожи и фасций верхнюю часть черепной коробки (рис. 24, б). Сделать продольные разрезы в черепе по направлению от большого отверстия к носовым ходам справа и слева (рис. 24, в, г). Пинцетом отделить крышку черепа, обнажив тем самым головной мозг (рис. 24, д). Начиная от зоны фронтальной части, подцепить и извлечь головной мозг вместе с обонятельными луковицами (рис. 24, е).
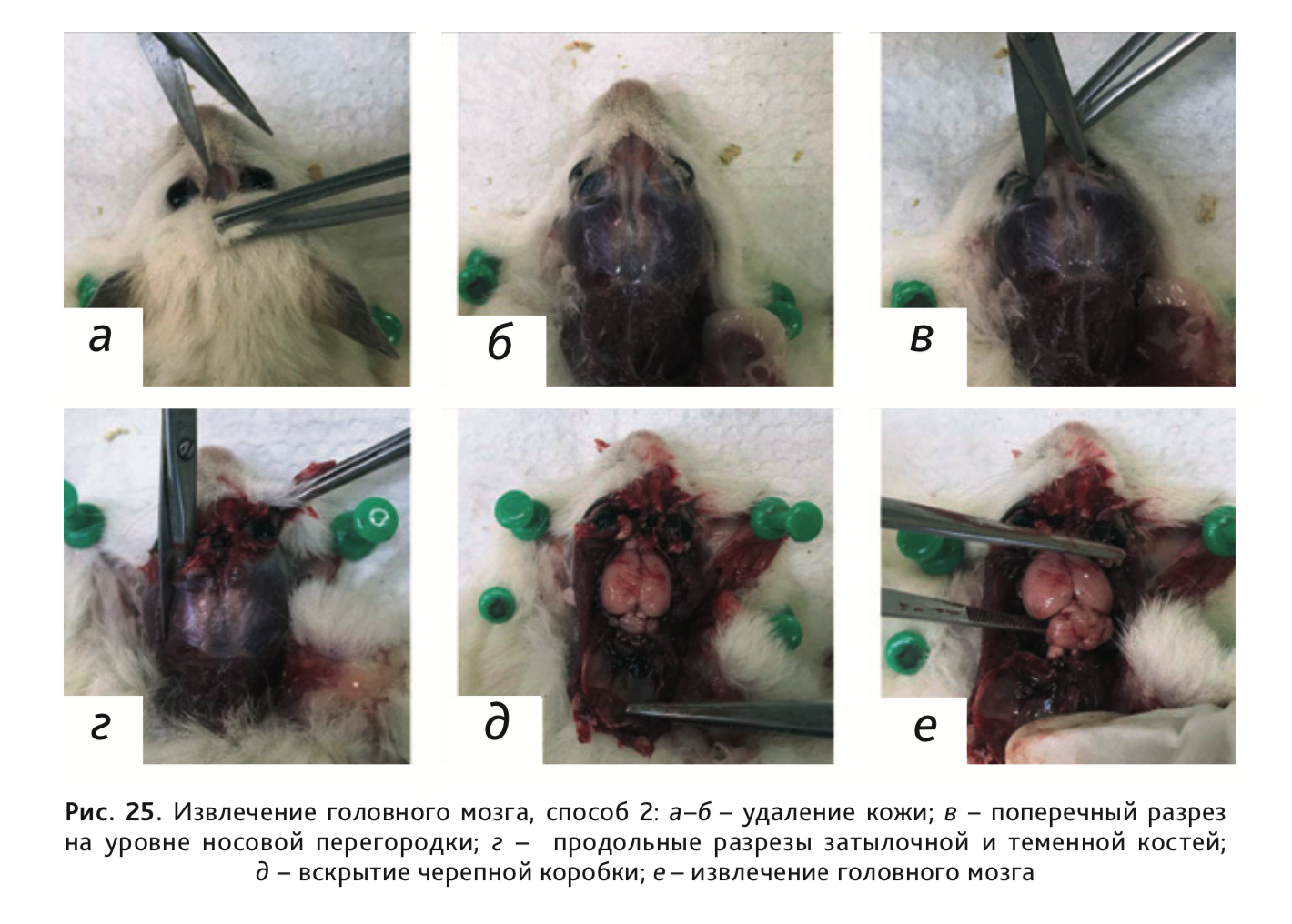
Способ 2: Ножницами разрезать кожу на уровне носовой перегородки и сделать продольный разрез по направлению к затылку (рис. 25, а, б). После отделения кожи сделать поперечный разрез черепа на уровне носовой перегородки (рис. 25, в). Далее, обращая внимание на то, что ножницы не слишком глубоко проникают в носовую полость, продолжить разрезать затылочную и теменную кости (рис. 25, г). Удалить череп, обнажив мозг и мозговые оболочки (рис. 25, д). Извлечь головной мозг (рис. 25, е).
31. Гипофиз отбирается и фиксируется вместе с черепом после извлечения головного мозга.
32. Извлечь глаз вместе с веками, слезной железой и зрительным нервом (рис. 26).

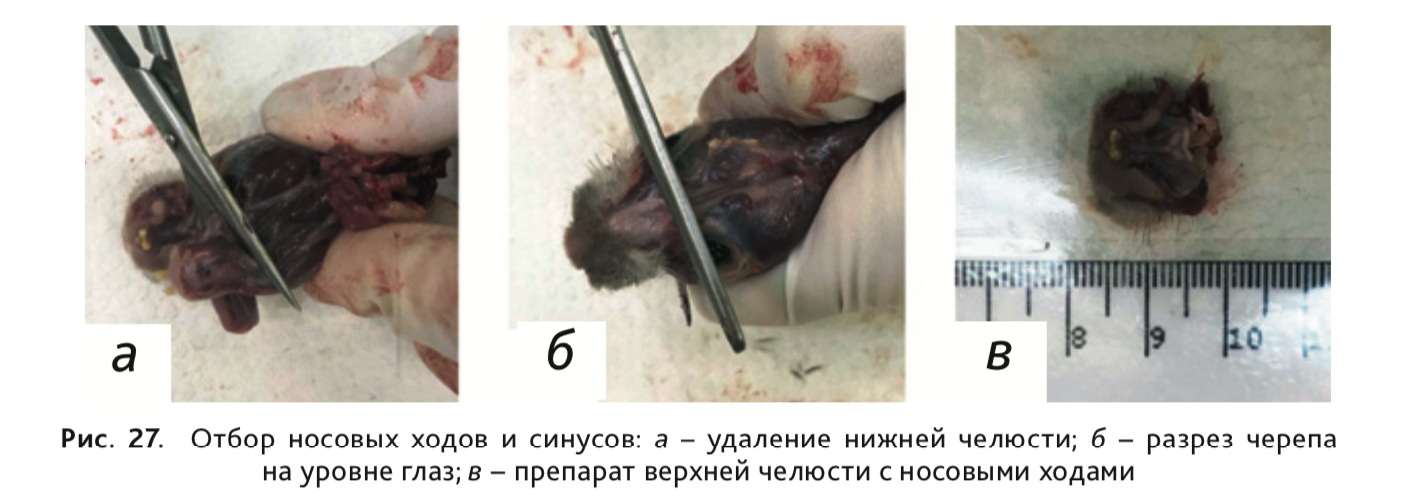
33. Для отбора носовых ходов после декапитации и очистки черепа от кожи и мышц удалить нижнюю челюсть (рис. 27, а). После чего сделать разрез верхней челюсти на уровне глаз (рис. 27, в), отделяя тем самым препарат верхней челюсти с носовыми ходами (рис. 27, г).
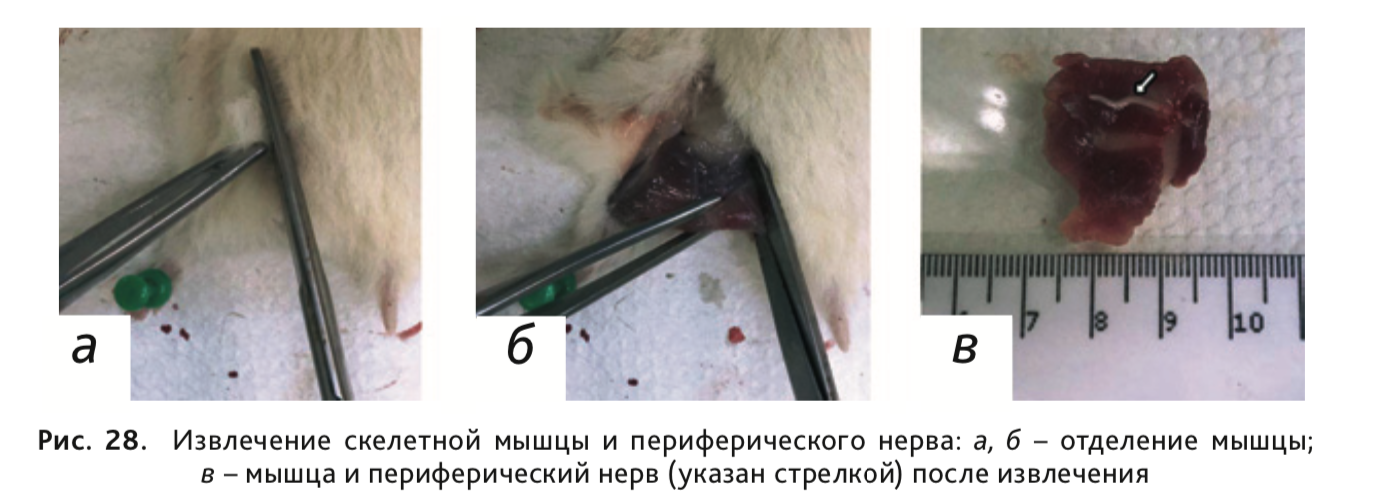
34. Извлечь скелетную мышцу и периферический нерв. Для этого сделать глубокий разрез кожи и подлежащих мышц, отпрепарировать мышцы и фасции, затем извлечь скелетную мышцу и нерв (рис. 28).
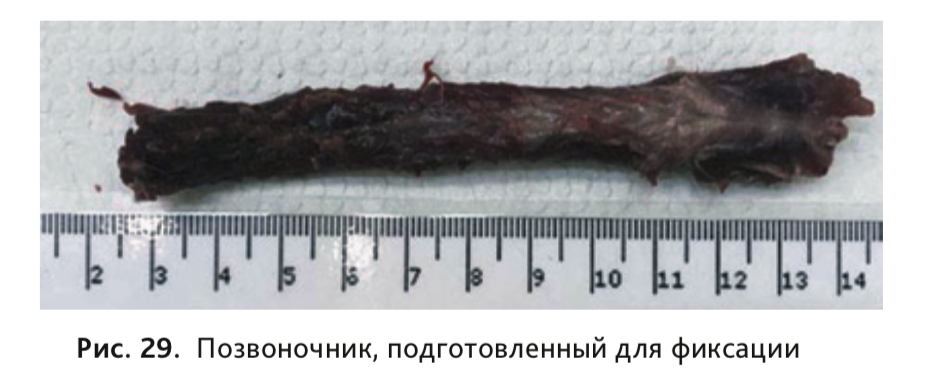
35. Фиксация отделов спинного мозга проводится вместе с позвоночным столбом без извлечения мозга из спинномозгового канала (рис. 29). Для подготовки спинного мозга к фиксации необходимо рассечь вдоль позвоночника мышцы спины, пересечь с обеих сторон остистые отростки позвонков и ребра, после чего максимально очистить позвоночный столб от мягких тканей.
Заключение
Предложенная нами методика позволяет:
- Обеспечить полное последовательное вскрытие с возможностью досконального исследования всех полостей, систем органов и различных частей тела хомячка;
- Провести извлечение всех необходимых органов и тканей, в том числе предусмотренных планом исследования;
- Минимизировать повреждения структур и избежать загрязнения органов и тканей, тем самым исключая возникновение некоторых артефактов при последующем гистологическом исследовании.
Список источников
- Коптяева К.Е., Мужикян А.А., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Методика вскрытия и извлечения органов лабораторных животных. Сообщение 1: крыса. Лабораторные животные для научных исследований. 2018. N2. C. 71-92. doi: 10.29296/ 10.29296/2618723X-2018-02-08.
- Коптяева К.Е., Мужикян А.А., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Методика вскрытия и извлечения органов лабораторных животных. Сообщение 2: мышь. Лабораторные животные для научных исследований. 2018. N4. C. 50-73. doi: 10.29296/2618723X-2018-04-05.
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности патологоанатомического исследования группы экспериментальных животных. СПб.: Международный вестник ветеринарии. 2014. N1. С. 75-80.
- Рыбакова А.В. Методы эвтаназии лабораторных животных в соответствии с европейской директивой 2010/63 / А.В. Рыбакова, М.Н. Макарова // Международный вестник ветеринарии. 2015. N2. С. 96-107.
- Fiette L., Slaoui M. Necropsy and Sampling Procedures in Rodents // Drug Safety Evaluation: Methods and Protocols, Methods in Molecular Biology. 2011. Vol. 691. P. 39-56. doi :10.1007/978-1-60761-849-2_3
- McInnes E. (Ed.). Pathology for Toxicologists: Principles and Practices of Laboratory Animal Pathology for Study Personnel. Chichester: John Wiley & Sons. 2017. P. 25-26.
- Parkinson C. et al. Diagnostic necropsy and selected tissue and sample collection in rats and mice // Journal of Visualized Experiment. 2011. N54. P. 2-7. doi: 10.3791/2966
- Revised guides for organ sampling and trimming in rats and mice – Part 1 // Experimental and Toxicologic Pathology. 2003. Vol. 55. P. 91-106. doi: 10.1078/0940-2993-00311
- Reznik G., Schuller, Hildegard M., Mohr U. Clinical anatomy of the European hamster, Cricetus cricetus, L. Bethesda, Maryland. 1978. URL: digital.library.unt.edu/ark:/67531/metadc28308 (accessed: 09.01.2019)
- Scudamore C. L. (Ed.). A Practical Guide to the Histology of the Mouse. Chichester: John Wiley & Sons. 2014. P. 17-20.
- Suckow M.A., Stevens K.A., Wilson R.P. (Eds.). The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. London: Academic Press; Elsevier. 2012. P. 135-136.



