Caenorhabditis elegans как модельный объект для биомедицинских исследований
Гайдай Е.А., Матичин А.А., Гайдай Д.С., Макарова М.Н. Caenorhabditis elegans как модельный объект для биомедицинских исследований Лабораторные животные для научных исследований
Резюме
Резюме. Статья посвящена нематодам вида Caenorhabditis elegans и возможностям использования их в биомедицинских исследованиях. В конце 60-х годов Расселом и Берчем была предложена концепция 3R, которая на сегодняшний день является общепринятым мировым стандартом, позволившим в значительной степени сократить число лабораторных животных, используемых в научных целях. Согласно этой концепции возрос интерес исследователей к беспозвоночным моделям, в частности к такой модели, как крошечные свободно живущие нематоды Caenorhabditis elegans. За более чем 40 лет интенсивных исследований раскрыты секреты их генетики, физиологии, анатомии и поведения. Известно точное количество нервных клеток в их нервной системе (302), синаптическая структура нервной системы, а каждый из нейронов полностью изучен электронно-микроскопически; геном был тщательно изучен в 1998 г. Общий план строения в основных чертах такой же, как и у большинства высших животных: удлиненное тело обладает билатеральной симметрией и состоит из обычных тканей (нервы, мышцы, кишечник, кожный покров). Взрослые особи представлены 2 формами – гермафродитами и самцами. При самооплодотворении в основном возникают гомозиготные потомки. Полный цикл развития составляет около 3 сут. Caenorhabditis elegans (С. elegans) как модельный объект для биомедицинских исследований обладает рядом преимуществ перед позвоночными животными: они дешевы и просты в использовании, у них короткий жизненный цикл и есть возможность пользоваться большой выборкой. На них не распространяются биоэтические ограничения. Важность этого организма для научного прогресса подчеркивается тремя Нобелевскими премиями, присужденными в XXI веке. Нематоды C. elegans как модельный объект используются для изучения основных биологических, генетических и физиологических процессов, которые являются общими для всех животных. Они могут служить моделями различных заболеваний человека, а также быть полезны при разработке и тестировании терапевтических агентов для этих заболеваний. C. elegans широко применяются в доклинических исследованиях при оценке генотоксичности, проницаемости, эффективности лекарственных средств (ЛС), токсичности наночастиц, изучения нейротоксичности различных соединений.
Введение
В 1959 г. Расселом и Берчем [18] была предложена концепция 3R, которая на сегодняшний день является общепринятым мировым стандартом, позволившим в значительной степени сократить число лабораторных животных, используемых в экспериментах. В связи с этой концепцией возрос интерес исследователей к беспозвоночным моделям. Их использование привело к открытиям почти в каждой области биологии и медицины – от эмбрионального развития до процессов старения. В настоящее время наиболее распространенной моделью являются крошечные нематоды Caenorhabditis elegans [21].
C. elegans как модельный объект для биомедицинских исследований обладает рядом преимуществ перед позвоночными животными, в частности такими, как небольшие размеры, высокая продуктивность и короткое время генерации, возможность долгосрочной криоконсервации, прозрачность покровов тела, число и развитие инвариантных клеток, простота содержания в лабораторных условиях, низкие затраты на обслуживание [15], отсутствие биоэтических ограничений для использования этих животных в экспериментальных целях.
Нематод вида C. elegans используют для изучения основных биологических и физиологических процессов, которые являются общими для всех животных [19], в качестве модели нейродегенеративных заболеваний, диабета, рака, иммунных расстройств, а также для разработки и тестирования терапевтических агентов для этих заболеваний [2, 7, 14–16].
Строение и жизненный цикл Caenorhabditis elegans
C. elegans – это небольшая свободно живущая нематода, распространенная по всему миру.
Тип: Nematoda (нематоды, или круглые черви), Класс: Secernentea, отряд: Rhabditida, семейство: Rhabditidae, род: Caenorhabditis, вид: Caenorhabditis elegans (Maupas, 1900) [26].
Дикий тип нематоды был выделен из садового компоста в г. Бристоль (Великобритания) и был назван N2 Bristol. Позднее C. elegans была обнаружена практически на всех континентах планеты [17].
Длина взрослой особи достигает ≈1 мм, тело состоит примерно из 1000 клеток. C. elegans имеет достаточно простое строение (рис. 1). Снаружи нематоды одеты многослойной кутикулой, своеобразным наружным скелетом. Под кутикулой залегает гиподерма. Соответственно 4 продольным линиям гиподерма образует 4 обращенных внутрь валика. Под гиподермой лежат продольные мышечные волокна, которые контролируют движение организма, а также брюшной и спинной нервные стволы, которые иннервируют мышцы. Внутри нейромышечной области находятся пищеварительная, выделительная и репродуктивная системы. У нематод этого вида одна из самых «простых» нервных систем. Взрослая гермафродитная особь состоит из 959 клеток (самец – из 1031 клетки) и имеет всего 302 нейрона, связи между которыми тщательно изучены [17, 25].
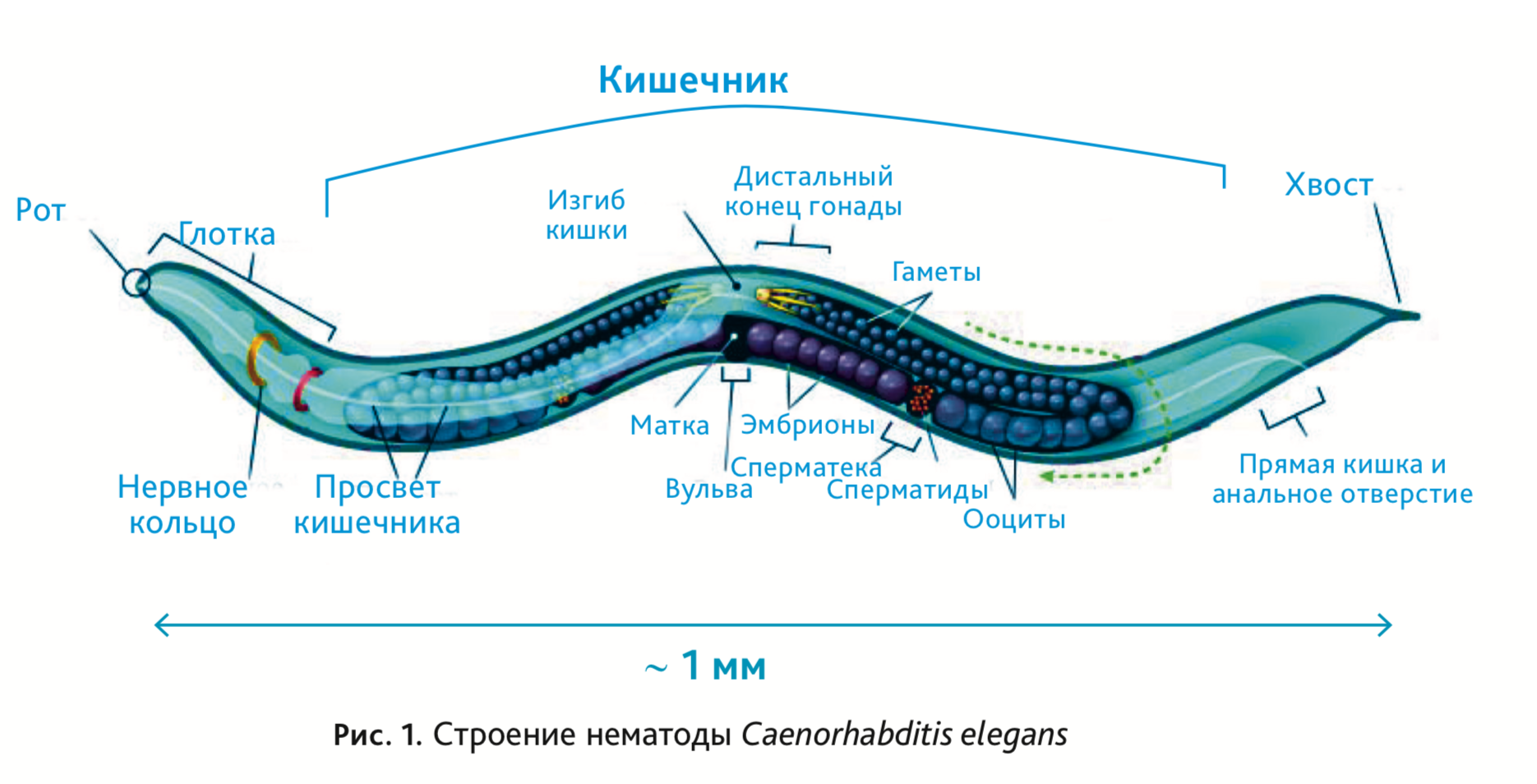
Нематоды этого вида обладают прозрачным телом, что позволяет совершать прижизненное наблюдение за делением, миграцией и дифференцировкой клеток, а также описывать генеалогические отношения и поведение всех клеток, начиная от стадии одноклеточного яйца и заканчивая взрослым животным [17].
Дикий тип C. elegans имеет 2 половые формы: самооплодотворяющиеся гермафродиты и самцы. Гонады гермафродитов образуют сначала гаплоидную амебоидную сперму, которая хранится в сперматеке, а затем в зрелом возрасте зародышевая линия переключается, чтобы производить ооциты. Гермафродиты образуют до 300 яиц, которые оплодотворяются хранящейся спермой. При спаривании с самцами гермафродиты способны вырабатывать порядка 1000 яиц, что указывает на то, что сперма, произведенная гермафродитом, является лимитирующим фактором самооплодотворения. Оба пола являются диплоидами для 5 аутосомных хромосом. Половое отличие между этими формами заключается в том, что гермафродиты имеют 2 Х-хромосомы, а самцы имеют 1 Х-хромосому. Пол определяется отношением X к аутосоме (X:A) [17]. Большинство потомков – гермафродиты; только 0,1–0,2% потомства являются самцами из-за редкого мейотического нерасхождения X-хромосомы [17, 25].
Самооплодотворяющиеся гермафродиты имеют преимущество для содержания популяции в лабораторных условиях, поскольку одно животное образует генетически однородную популяцию.
C. elegans имеет короткий жизненный цикл (3 дня при температуре 25°С от яйца до яйцекладущей
взрослой особи). Эмбриогенез занимает приблизительно 16 ч при температуре 20°С (все последующие стадии
развития также протекают при температуре 20°С). Практически непроницаемая оболочка яйца образуется сразу после
оплодотворения, что позволяет эмбриону развиваться независимо
от матери. Однако эмбрионы обычно сохраняются
внутри гермафродита примерно до 24-клеточной стадии. После вылупления зародыш становится личинкой первой стадии
(L1). Животные начинают питаться и проходят через 4 личиночных стадии (L1-L4). Каждый этап заканчивается
периодом бездействия, называемым летаргус [25], во время которого производится новая кутикула. Примерно через 12 ч
после линьки на стадии L4 взрослые гермафродиты начинают производить потомство в течение 2–3 дней вплоть
до полного использования всех их сперматозоидов; дополнительное потомство может быть сгенерировано, если гермафродит
соединяется с самцом. После репродуктивного периода гермафродиты могут жить еще несколько недель, а потом
умирают.
Когда истощаются пищевые ресурсы или животные переполняют место обитания, личинки L2 активируют альтернативный жизненный цикл [25] и линьку в альтернативную личиночную стадию L3 – «спящую» личинку. Кутикула «спящей» личинки полностью окружает животное и затыкает рот, предотвращая питание животного, тем самым останавливая развитие. Кутикула «спящей» личинки обладает повышенной устойчивостью к химическим веществам, она обеспечивает более эффективную защиту от воздействия окружающей среды и едких веществ. Такие личинки могут выживать в течение многих месяцев и являются формой, наиболее часто встречающейся в дикой природе. Когда «спящие» личинки попадают в новую среду, богатую бактериями, они линяют и продолжают свое развитие, слегка отличаются от личинки L4.
Использование С. еlegans в биомедицинских исследованиях
В качестве модельного объекта впервые нематод этого вида использовал Сидни Бреннер еще в 70-х годах ХХ века при генетических исследованиях. Он разработал метод культивирования нематоды в лабораторных условиях на плотной питательной среде с E. coli в качестве питательного субстрата [6].
Важность этого организма для научного прогресса подчеркивается тремя Нобелевскими премиями, присужденными в XXI
веке. 1-й (2002) были удостоены Сидни Бреннер, Роберт Хорвитц и Джон Салстон «за открытия, посвященные
генетической регуляции развития органов и программированной клеточной гибели» [21]. Эндрю Файер
и Крейг Мелло получили 2-ю Нобелевскую премию в 2006 г. «за открытие РНК-интерференции –
эффекта гашения активности определенных генов» [15]. Нобелевскую премию по химии 2008 г. разделили Мартин
Чалфи и Колумбийский университет за работу по исследованию зеленого флюоресцентного белка (GFP). У Чалфи
возникла идея использовать GFP как индикатор при исследованиях нематоды C. elegans. Он встроил ген GFP
в определенные участки генома нематоды C. elegans. В результате у потомства нематоды нейроны
стали светиться зеленым светом. В экспериментах с C. elegans было показано, что GFP принимал
нативную конформацию и образовывал флюорофор при комнатной температуре без добавления дополнительных
кофакторов, что обеспечило возможность использования белка в качестве маркера в клетках многих организмов
[8]. Благодаря экспрессии
флюоресцентного белка GFP у данного вида нематод можно наблюдать in
vivo клеточные и метаболические процессы.
C. elegans – первый многоклеточный организм, чей геном был полностью секвенирован. С помощью биоинформационных подходов была выявлена высокая степень гомологии (60–80%) многих генов нематоды с генами человека [9]. Установлено, что 12 из 17 известных сигнальных путей, среди которых тирозинкиназный, серин-треониновый пути и др., консервативны как у человека, так и у C. elegans [13]. В связи с этим C. elegans является ценным модельным тест-объектом для изучения токсичности.
За более чем 40 лет интенсивных исследований раскрыты секреты генетики, физиологии, анатомии и поведения
нематоды C. elegans. Нервная система C. elegans хорошо изучена. На сегодняшний день известно, что
нервная система нематоды состоит из 302 нейронов 118 подтипов [10], 6393 химических, 890 электрических и 1410
нейромышечных синапсов [9]. Были также составлены карты всех нейронов различных клеточных линий нематоды [20].
Совокупность этих знаний делает
C. elegans удобным объектом для нейротоксикологических исследований,
а также для изучения механизмов управления движениями, передачи сигналов по нейронной сети, хемотаксиса
и т.п. [24].
У человека и C. elegans обнаружено много общего во взаимодействиях на генетическом и молекулярном уровнях. В результате нематода C. elegans стала инструментальной моделью для понимания молекулярных механизмов многих заболеваний человека [15]. C. elegans – удачный объект генетики, иак как можно легко получить организмы с мутациями, трансгенами и нокаутами [15, 17, 23].
Исследования на C. elegans осветили механизмы развития нервных клеток, показав, что ген sem-4 участвует в контроле развития мезодермальных и нейронных клеток [3]. Ген lin-9, который влияет на пути передачи сигнала, контролирующего развитие гонад нематоды, имеет аналоги у многих видов, что делает C. elegans полезной моделью для исследований биологии развития и механизмов межклеточной сигнализации [5].
C. elegans используют в качестве модели для изучения фактора транскрипции, который контролирует продолжительность жизни, метаболизм и реакции стресса. Нематоды этого вида могут переходить в стадию гипометаболизма, что также важно для определения белков-мишеней в стрессовых реакциях высших животных. Подобные исследования могут способствовать к выявлению терапевтических целей для таких заболеваний человека, как ишемия, резистентность к инсулину, нейродегенеративные заболевания и рак [21].
C. elegans – перспективный модельный организм для изучения сигналов AMPK (5'-AMP-активированной протеинкиназы) [4] за счет наличия этих сигнальных путей. AMPK часто называют «основным метаболическим переключателем», так как он играет ключевую роль в регулировании метаболизма, синтезе белка и клеточном росте, и в опосредовании действия гормонов [4]. Изучение путей эндокринной передачи сигналов и контроля гормонов у C. elegans дало импульс для исследования сходных путей у человека [21].
Врожденный иммунитет C. elegans стал предметом для изучения иммунной защиты и роли клеточного стресса в реакции организма на инфекцию. Нематоды также были задействованы для моделирования активации генов в ответ на инфекцию [21].
Нематоды этого вида широко используются в качестве модели инфекционных заболеваний. C. elegans исследовали с точки зрения поведения и генетики привыкания, использования долговременной и короткой памяти для обучения, а также нейронных и молекулярных механизмов поведения [21].
C. elegans является важной моделью для понимания патофизиологии и молекулярных механизмов нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона [11, 22].
У трансгенных нематод, созданных для экспрессии β-амилоидного белка человека (Abeta), развиваются внутриклеточные отложения с фибриллярным компонентом амилоида, что характерно для болезни Альцгеймера [14].
Болезнь Паркинсона также изучали с использованием C. elegans, которые имеют не только дофаминовые нейроны, рецепторы, переносчики и ферменты, катаболизирующие допамин, но и ортологи большинства генов Паркинсона человека [15]. В результате различных генетических манипуляций с нематодами были созданы модели генетических и молекулярных путей болезни Паркинсона. C. elegans применяют в анализах экспрессии генов человека для идентификации генов, связанных с болезнью Паркинсона. Гены сверхэкспрессированы в дофаминовых нейронах; если они связаны с заболеванием, нематоды демонстрируют признаки нейродегенерации. C. elegans были предложены в качестве альтернативы позвоночным животным при скрининге препаратов с терапевтическим потенциалом для болезни Паркинсона [21].
C. elegans наделены множественными копиями гена sir-2.1 (аналоги встречаются у человека),
который работает в сочетании с транскрипционным фактором DAF-16 для увеличения продолжительности жизни.
Продолжительность жизни основана на семействе белков 14-3-3, которые активируют путь,
повышающий устойчивость
как к окислительному, так и к генотоксическому
стрессу [21].
Беспозвоночные оказались полезны при изучении эффектов ионизирующего излучения на Земле и в космосе. Так, C. elegans используют для оценки влияния на организм микропучкового излучения, для изучения долгосрочных эффектов радиационного воздействия в космических полетах и оценки гравитационных эффектов космических полетов по экспрессии мускульных генов [21].
Благодаря клеточному и генетическому сходству с человеком C. elegans служит важной моделью для скрининга терапевтических агентов [15].
Нематоды вида C. elegans просты и дешевы для содержания в лабораторных условиях. В лабораториях C. elegans содержат в чашках Петри или культуральных флаконах (рис. 2). В качестве субстрата применяют плотную питательную агарозную среду, содержащую бактерии E. coli, которые служат пищей для нематод. Без пищи нематоды способны задерживать развитие на личиночной стадии и в этом состоянии могут выживать в течение 1 мес (при температуре 15○С могут быть сохранены на срок до 6 мес).

Нематод содержат при температуре от 12 до 20○С и наличии кислорода около 13%. При температуре выше 25○С животные становятся стерильными [12, 25].
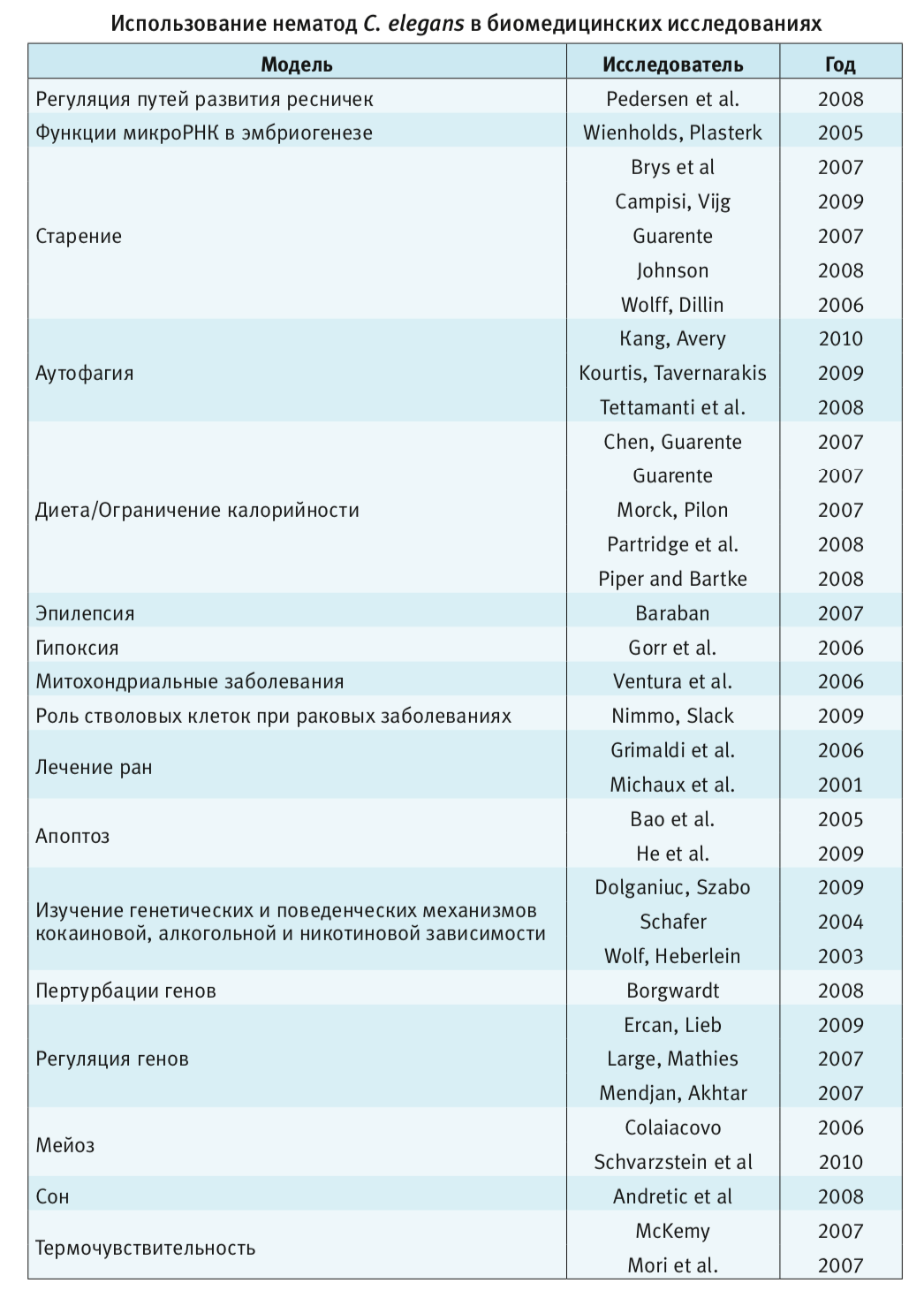
Нематод C. elegans широко используют в доклинических исследованиях при оценке генотоксичности, проницаемости, эффективности ЛС, токсичности наночастиц, изучения нейротоксичности различных соединений по изменению следующих параметров: поведение (подвижность, хемотаксис, питание), молекулярные параметры (экспрессия генов, активность ферментов), морфология, о чем свидетельствуют многочисленные исследовательские работы (см. таблицу).
Большая часть исследований по изучению токсичности различных соединений проводится на водных беспозвоночных (Daphnia magna, Chlorella sp., Tetrachymena pyriformis, Stylonychia sp., Paramecium caudatum и т.п.). Изучение токсичности соединений на организмах, обитающих на суше, проводят достаточно редко.
Нематоды распространены в почвенной экосистеме, они также обнаружены в воде и осадочных породах. Чрезвычайно высокая распространенность нематод свидетельствует об их важной роли в поддержании постоянства окружающей среды. Эти свойства делают их удобными объектами для экотоксикологических исследований и биомониторинга [1].
Изначально токсикологические тесты базировались на исследовании нематоды на физиологическом уровне (оценка влияния токсического агента на организм по характеру движения), поскольку этот метод наименее трудоемкий. Позднее стали внедрять методы, позволяющие выявить механизмы токсического действия на молекулярном уровне, которые включали в себя определение:
активности ацетилхолинэстеразы – фермента, расщепляющего ацетилхолин в синаптической щели до холина и уксусной кислоты, что приводит к расслаблению мышечных клеток. Ацетилхолин – важнейший возбуждающий медиатор, вовлеченный в реализацию двигательных функций у нематоды. У C. elegans было обнаружено и охарактеризовано 4 гена, кодирующих различные изоформы фермента. Мутанты по гену ацетилхолинэстеразы (ace-1 и ace-2) характеризуются нарушением движения, что проявляется в виде судорог из-за гиперактивации миоцитов [1];
экспрессии ряда генов-маркеров стресса (генов белков шаперонов (hsp-16.1, hsp-16.2, hsp-16.48, hsp-70), металлотионеина – небольшого белка, участвующего в транспорте ионов и детоксикации (mt-1 и mt-2) вителлогенина (vit-2 и vit-6), участвующего в формировании яиц, цитохрома Р450 35A2 (cyp35a2), глутатион-S-трансферазы 4 (gst-4), супероксиддисмутазы 1 (sod-1), каталазы (ctl-2), энхансера апоптоза (ape-1) и р53-подобного белка (cep-1). Так, например, данный метод был применен при оценке токсичности фосфорорганического инсектицида хлорпирифоса и ди(2-этилгексил)фталата.
В указанных работах использовались трансгенные нематоды штамма hsp-16.2::gfp и hsp-16.48::gfp, в которых экспрессия белков шаперонов сопряжена с экспрессией зеленого флюоресцентного белка. У нематод, помещенных в загрязненную почву, увеличивалась интенсивность флюоресценции GFP, что указывало на повышенную экспрессию белков шаперонов под воздействием смеси загрязнителей [1].
Сегодня применение нематод C. elegans в качестве модельного тест-объекта охватывает широкий спектр исследований, перечень некоторых из них представлен в таблице.
Заключение
Нематоды Caenorhabditis elegans широко используются в качестве модельного объекта для биомедицинских исследований. Это экономичный и простой объект, на который не распространяются биоэтические ограничения. C. elegans служат для изучения основных биологических, генетических и физиологических процессов, в качестве модели различных заболеваний человека, а также для разработки и тестирования разных лекарственных препаратов.
Список источников
- Минуллина Р.Т., Фахруллин Р.Ф., Ишмухаметова Д.Г. Caenorhabditis elegans в токсикологии и нанотоксикологии. ВЕСТНИК ВГУ, СЕРИЯ: ХИМИЯ. БИОЛОГИЯ. ФАРМАЦИЯ. 2012; 2.
- Artal-Sanz M., de Jong L., Tavernarakis N. Caenorhabditis elegans: A versatile platform for drug discovery. Biotechnol J. 2006. Vol. 1: 1405–18.
- Basson M., Horvitz H.R. The Caenorhabditis elegans gene sema-4 controls neuronal and mesodermal cell development and encodes a zinc finger protein. Genes Dev.1996. Vol. 10: 1953–65.
- Beale E.G. 5′-AMP-activated protein kinase signaling in Caenorhabditis elegans. Exp Biol Med (Maywood). 2008. Vol. 233: 12–20.
- Beitel G.J., Lambie E.J., Horvitz H.R. The C. elegans gene lin-9, which acts in an rb-related pathway, is required for gonadal sheath cell development and encodes a novel protein. Gene. 2000. Vol. 254: 253–63.
- Brenner S. The genetics of Caenorhabditis elegans. Genetics. 1974. Vol. 77: 71–94.
- Faber P.W., Alter J.R., MacDonald M.E., Hart A.C. Polyglutamine-mediated dysfunction and apoptotic death of a Caenorhabditis elegans sensory neuron. Proc Natl Acad Sci USA. 1999. Vol. 96: 179–84.
- Grandin K. Les prix Nobel (The Nobel prizes) Stockholm: Nobel Foundation. 2008: 150–69.
- Helmcke K. J., Avila D.S., Aschner M. Utility of Caenorhabditis elegans in high throughput neurotoxicological research. Neurotoxicology and Teratology. 2010. Vol.32: 62–7
- Hobert O. Specification of the nervous. WormBook. 2005: 1–19.
- Johnson J.R., Jenn R.C., Barclay J.W., Burgoyne R.D., Morgan A. Caenorhabditis elegans: A useful tool to decipher neurodegenerative pathways. Biochem Soc Trans. 2010. Vol. 38: 559–63.
- Lee T.Y., Yoon K., Lee J.I. Cultivation of Caenorhabditis elegans in Three Dimensions in the Laboratory. J. Vis. Exp.-2016. Vol. 118.
- Leung M. C. Caenorhabditis elegans: an emerging model in biomedical and environmental toxicology. Toxicol. Sci. 2008. Vol. 106: 5–28.
- Link C.D. Transgenic invertebrate models of age-associated neurodegenerative diseases. Mech Ageing Dev. 2001. Vol. 122: 1639–49.
- Nass R., Merchant K.M., Ryan T. Caenorhabditis elegans in Parkinson’s disease drug discovery: Addressing an unmet medical need. Mol Interv. 2008. Vol. 8: 284–93.
- Pujol N., Cypowyj S., Ziegler K., Millet A., Astrain A., Goncharov A., Jin Y., Chisholm A.D., Ewbank J.J. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Curr Biol. 2008. Vol. 18: 481–9.
- Riddle D.L., Blumenthal T., Meyer B.J., et al., editors. C. elegans II. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. 1997.
- Russell W.M.S., Burch R.L. The principles of humane experimental technique. London: Methuen & Co. Ltd Survey. 1959.
- Strange K. Revisiting the Krogh principle in the post-genome era: Caenorhabditis elegans as a model system for integrative physiology research. J Exp Biol. 2007. Vol. 210: 1622–31.
- Sulston J. E. Neuronal cell lineages in the nematode Caenorhabditis elegans. Cold Spring Harbor Symp. Quant. Biol. 1983. Vol. 48: 443–52.
- Susan E. Wilson-Sanders. Invertebrate Models for Biomedical Research, Testing, and Education. ILAR Journal. 2011. Vol. 52; 2.
- Troulinaki K., Tavernarakis N. Neurodegenerative conditions associated with ageing: A molecular interplay? Mech Ageing Dev. 2005. Vol. 126: 23–33.
- Wicks S.R., Yeh R.T., Gish W.R., Waterston R.H., Plasterk R.H. Rapid gene mapping in Caenorhabditis elegans using a high density polymorphism map. Nat Genet. 2001. Vol. 28: 160–4.
- White J.G., Southgate E., Thomson J.N., Brenner S. The structure of the ventral nerve cord of Caenorhabditis elegans. Philos Trans R Soc Lond B Biol Sci. 1976. Vol. 275: 327–48.
- White J.G., Southgate E., Thomson J.N., Brenner S. The structure of the nervous system of the nematode Caenorhabditis elegans. Phil. Trans. Royal Soc. London. 1986: 1–340.
- Электронный ресурс: https://faunaeu.org/cdm_dataportal/taxon/6dd1ded7-802e-4779-877e-e20eafcada89



