Диет-индуцированные модели метаболических нарушений. Экспериментальный метаболический синдром
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Экспериментальный метаболический синдром. Лабораторные животные для научных исследований. 2018; 1. https://doi.org/10.29296/2618723X-2018-01-08
Резюме
Рост распространенности метаболического синдрома (МС) в последние 2 десятилетия приводит к значительному увеличению показателей смертности за счет ишемической болезни сердца, мозгового инсульта, онкологических и других заболеваний. Поэтому особую актуальность приобретает поиск адекватных экспериментальных моделей с целью создания новых средств профилактики и лечения МС. Наиболее близкими по этиологии и патогенезу МС человека являются диетиндуцированные модели, в которых используются высококалорийные рационы питания с повышенным содержанием жира (до 60% от общей калорийности рациона), сахарозы и фруктозы (до 60–70% от общей калорийности) и комбинированные рационы (43% жира и 15–17% сахарозы или фруктозы и др.). Для ускорения развития проявлений МС высококалорийные рационы сочетают с введением небольших доз стрептозотоцина. Модели МС на грызунах, наиболее популярны в настоящее время, не дают точного представления о патологии человека. Поэтому следует шире внедрять модели МС на кроликах, мини-свиньях и других животных, более близких по анатомии и физиологии человеку. Для оценки развития МС используют показатели липидного, белкового и углеводного обмена, антропометрические и другие показатели.
Введение
Европейское медицинское сообщество озабочено адекватностью прогнозирования результатов экспериментальных исследований на животных для клинического применения у людей [1]. При этом отмечается, что «перенос новых открытий с фундаментальных исследований на клиническое применение – это долгий, зачастую неэффективный и дорогостоящий процесс». Наиболее адекватными по этиологии и механизмам развития метаболических нарушений человека (метаболический синдром – МС, ожирение, сахарный диабет типа 2 – СД-2 и др.) являются диет-индуцированные модели. Следует отметить, что чаще всего используются дешевые и доступные модели на грызунах. Однако они часто не дают точного представления о патологии человека, поэтому существует необходимость в моделях животных, не являющихся грызунами, которые более точно имитируют различные аспекты анатомии и физиологии человека [1]. Поэтому в настоящее время более широко применяют модели на более крупных животных – кроликах, мини-свиньях и др. Каждая модель имеет свои особенности, влияющие на конечный результат исследования, поэтому ни одна из них не может быть полностью экстраполирована на человека. Таким образом, следует экспериментировать с разными моделями на различных видах животных в зависимости от поставленных целей и задач. Попробуем проанализировать и систематизировать имеющуюся на настоящий момент информацию по данной проблеме.
МС – одна из наиболее актуальных и сложных проблем современной медицины, так как он способствует существенному росту общей смертности, не только от ишемической болезни сердца и мозгового инсульта, но и от онкологических и других заболеваний. Причем последние 2 десятилетия распространенность МС прогрессивно увеличивается [2–6], что связывают в основном со снижением физической активности современных людей на фоне избыточного питания. Несмотря на высокую распространенность МС, патофизиологические механизмы его еще недостаточно выяснены, что затрудняет профилактику и лечение МС, в том числе и с помощью лекарственных средств. В связи с этим особую актуальность приобретает использование патогенетически обоснованных экспериментальных моделей МС на различных видах животных.
Характеристика метаболического синдрома
Согласно B. Balkau et al. [7], впервые одновременное наличие комплекса
симптомов (артериальной гипертензии,
гипергликемии и подагры), характерных для МС, было описано Kylin в 1923 г. Затем в конце 1940-х годов
во Франции Jean Vague сообщил о взаимосвязи ожирения, диабета, атеросклероза и подагры [7]. В 1970-х
годах немецкие исследователи впервые ввели термин «метаболический синдром», а в 1988 г. Раевен
предложил называть группу сердечно-сосудистых факторов риска, включающих гипертонию, толерантность к глюкозе,
высокий уровень триглицеридов и низкий уровень липопротеинов высокой плотности, синдромом X [6]. МС также
называют синдромом инсулинорезистентности, полиметаболическим синдромом, смертельным квартетом
и цивилизационным синдромом.
Таким образом, МС (комплекс симптомов) – это комплекс различных, но связанных между собой заболеваний и нарушений в организме, включающих ожирение, инсулинрезистентность, предиабет или СД-2, гиперинсулинемию, триглицеридемию, снижение уровня холестерина липопротеинов высокой плотности, артериальную гипертензию, стеатогепатоз [2, 4–6, 8]. Существуют разные варианты проявлений МС, при которых отмечаются лишь отдельные заболевания или нарушения метаболизма. В настоящее время выделяют 5 главных признаков МС (рис. 1), при наличии 3 из которых уже допустим диагноз «метаболический синдром». Для ранних стадий МС наиболее характерно сочетание ожирения, предиабета или СД-2 с нарушениями липидного обмена, причем главным его проявлением считается ожирение.
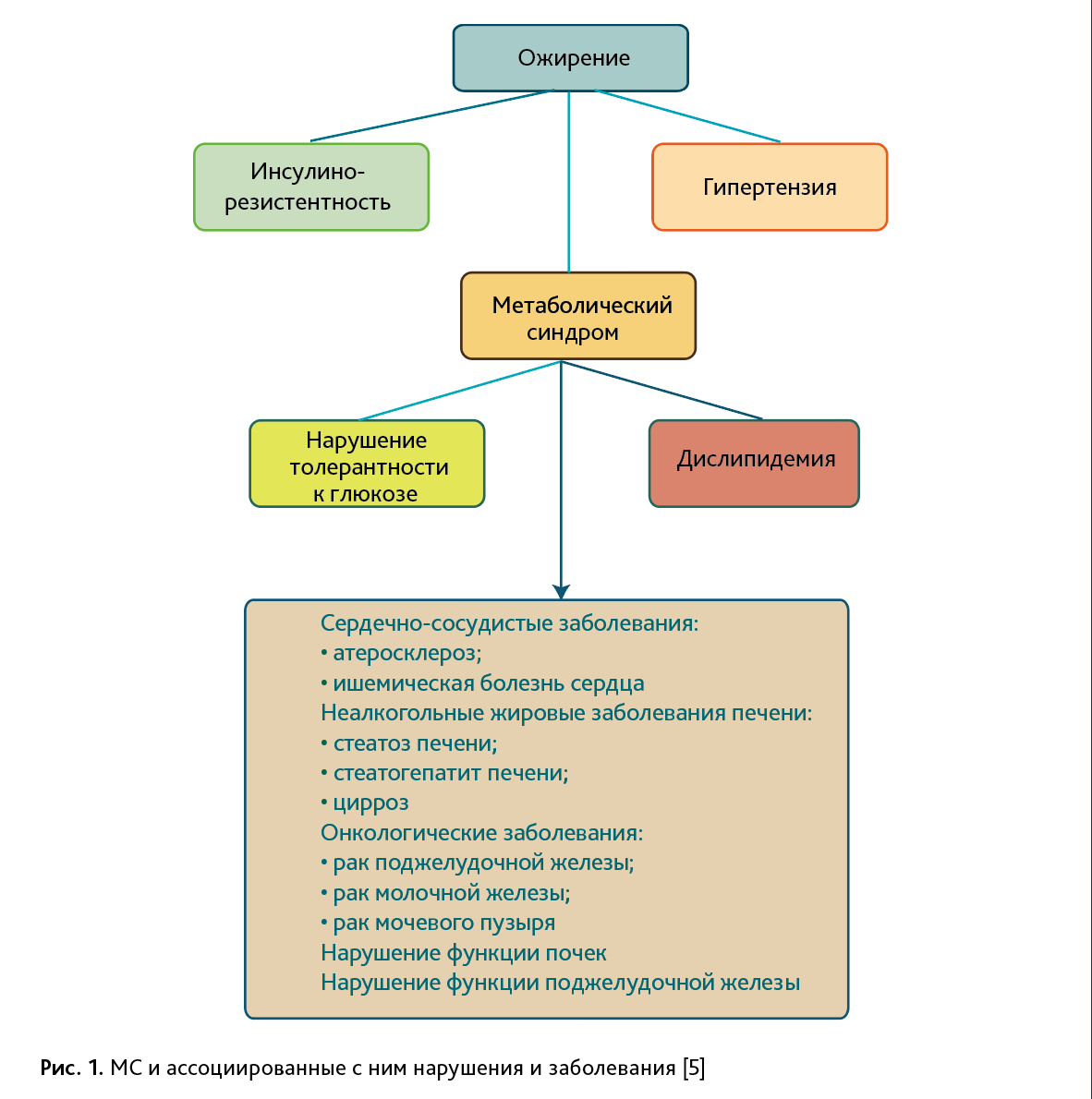
В основе патогенеза МС важнейшее значение придается инсулинорезистентности и ожирению [6]. В свою очередь этиологическими факторами возникновения инсулинорезистентности считают избыточную массу тела, малоподвижный образ жизни, курение, низкую массу тела при рождении и перинатальное недоедание, а также генетические нарушения, способствующие чрезмерному накоплению жира. Вместе с тем и абдоминальное, или висцеральное ожирение тесно связано с гиперинсулинемиией, инсулинорезистентностью, гипертензией и другими проявлениями МС, а в этиологии ожирения основную роль играет избыточное потребление рафинированных углеводов (сахарозы, фруктозы и др.) и жиров на фоне недостаточной физической нагрузки [6].
МС тесно ассоциирован с развитием сердечно-сосудистых заболеваний, неалкогольных жировых заболеваний печени, онкологических заболеваний (рак молочной железы, мочевого пузыря и поджелудочной железы), а также нарушений функции почек и поджелудочной железы (см. рис. 1) [3, 5].
Виды животных и рационы питания, используемые для индуцирования метаболического синдрома
Изначально для моделирования МС использовались высококалорийные рационы питания, обогащенные жирами. Так, например, если стандартный корм для грызунов содержит около 10% жира, то в высокожировом рационе его содержание может достигать 30% и более [3, 9, 10]. Причем модели с животными жирами (свиной жир и др.) более эффективны, чем с растительными (оливковое масло и др.), хотя и последние способны вызывать ожирение и инсулинорезистентность. Имеются также экспериментальные модели МС с обогащением рациона животных углеводами (фруктозой и сахарозой) [11, 12].
В настоящее время все большее распространение приобретают комбинированные модели МС с высоким содержанием и жира и углеводов, в том числе так называемая диета кафетерия [8]. Считается, что именно такие комбинированные модели наиболее близки к питанию человека и адекватны по механизмам развития МС. Как было показано, высокожировой рацион плюс сахароза быстрее вызывают МС, чем только высокожировой [9].
Модели МС на грызунах
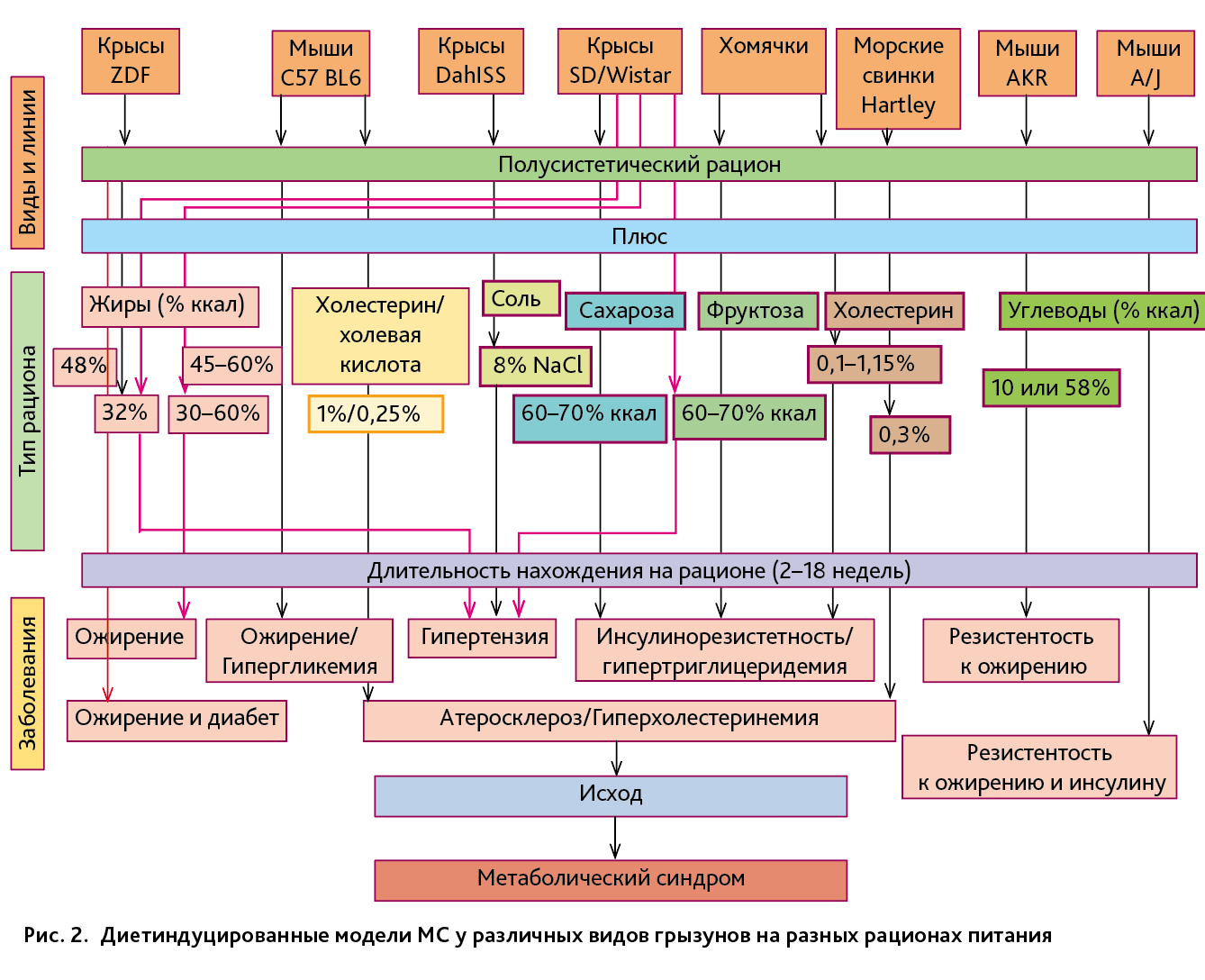
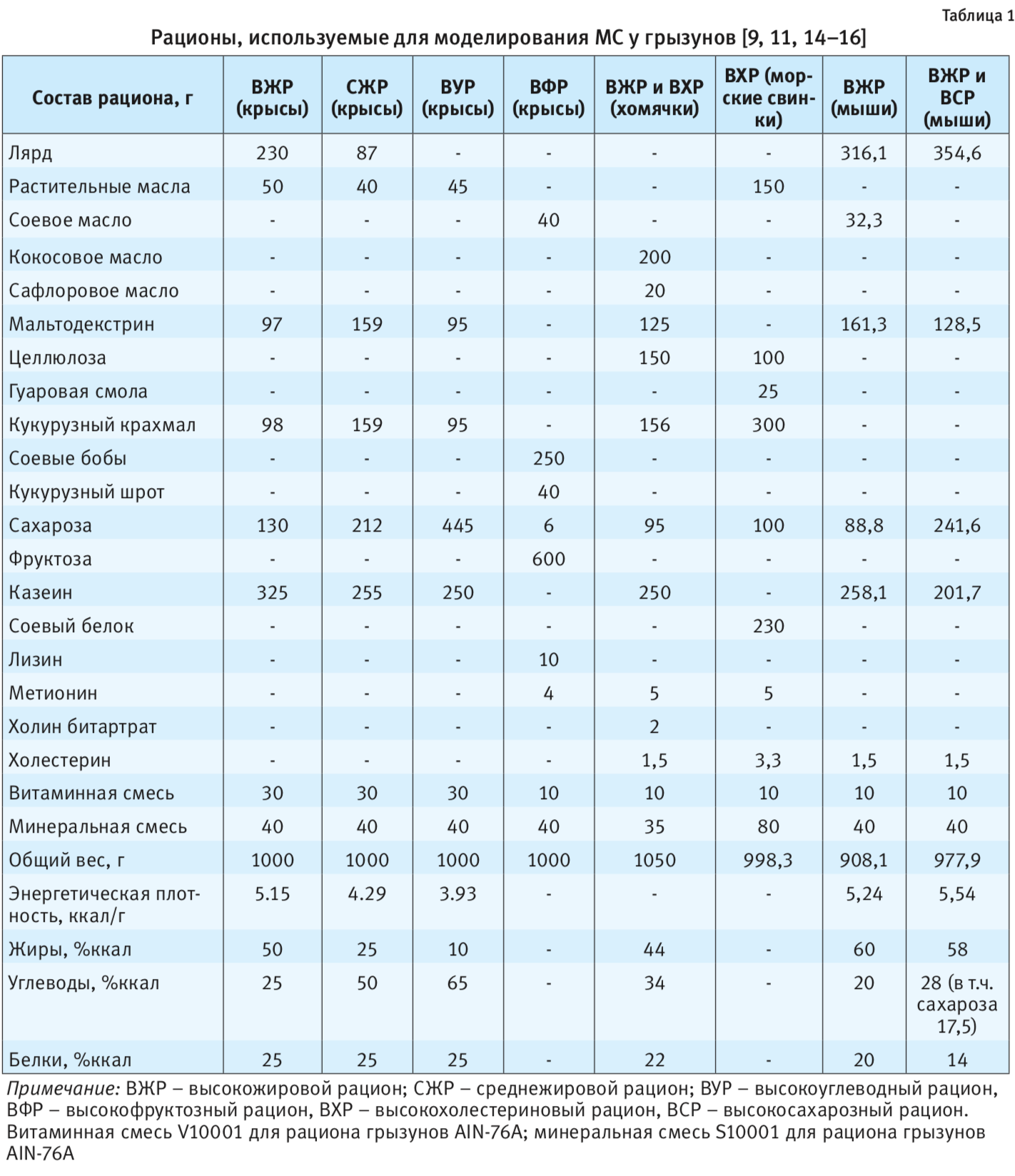
Наиболее полный анализ диетиндуцированных моделей МС на грызунах по состоянию на 2012 г. проведен S. Aydin et al. [6] (рис. 2). Так, различные проявления МС можно вызвать у животных с помощью следующих рационов питания: с повышенным количеством жиров (30–60% от калорийности рациона), холестерина (0,1–1,25% от калорийности рациона), поваренной соли (8%), сахарозы и фруктозы (60–70% от калорийности рациона). При этом использовались как генетически модифицированные животные (крысы линий ZDF, DahlSS, мыши AKR, A/J), так и дикие породы животных (крысы линии Wistar и Sprague Dawley (SD), мыши линии C57BL/6, золотистые хомячки, морские свинки). Подробная характеристика некоторых рационов представлена в табл. 1.
Высокожировые рационы
Использование рационов с различным содержанием жира у крыс Zucker (названы по имени ученого L. Zucker), со спонтанной мутацией, приводящей к развитию ожирения и СД-2 (ZDF), показало, что у самцов для развития гипергликемии было достаточно увеличить содержание жира в рационе до 23,3% от общей калорийности, а у самок гипрегликемия развивалась только при 48% жира [6]. При этом на моделях с крысами линии SD при высокожировых рационах (в среднем около 50% ккал) разные исследователи отмечали наиболее выраженное увеличение массы тела (ожирение) по сравнению с контролем на 5–6-й неделе эксперимента (см. рис. 2). Причем животный жир (лярд) влиял более интенсивно, чем растительный. Кормление крыс линии SD рационом с 32% жира от общей энергоценности в течение 10 нед способствовало развитию такого симптома МС, как артериальная гипертензия (см. рис. 2). Модели с высокожировыми рационами (45–60%) на диких мышах линии C57BL/6J способствуют довольно быстрому (8 нед) развитию ожирения и гипергликемии [13] (см. рис. 2).
Рационы с высоким содержанием холестерина
Добавление холестерина (0,33 г/100 г) в рацион самок морских свинок вызывало развитие атеросклероза и гиперхолестеринемии на 12-й неделе исследований (см. рис. 2). Умеренный атеросклероз и гиперхолестеринемия появлялись у мышей линии C57BL/6J между 14-й и 18-й неделями [6]. У хомячков, получавших 0,15% холестерина с рационом питания в течение 6 нед, отмечены достоверное увеличение общего уровня холестерина, триглицеридов и холестерина липопротеинов низкой плотности (ЛПНП) [14], что указывает на МС.
Рационы с высоким содержанием сахарозы или фруктозы
У крыс линии Wistar, получавших 60–70% сахарозы от общей энерогоценности рациона, на 8-й неделе отмечались существенные изменения инсулинорезистентности и концентрации триглицеридов (табл. 2). При этом у крыс линии SD на таком же рационе подобные нарушения отмечались уже на 2-й неделе [6]. Что касается рациона с повышенным содержанием фруктозы (60–70% ккал), то уже на 2-й неделе ее применения у золотистых хомячков развивается инсулинорезистентность и гипертриглицеридемия. Согласно данным литературы [6], у золотистых хомячков проявления МС развиваются быстрее, чем у других грызунов. Если у крысам линии Wistar и линии SD давать для питья вместо воды 10% раствор фруктозы, то уже к концу 1-й недели у них развивается гипертензия [6].
Однако мыши линий AKR и A/J резистентны к развитию ожирения при воздействии высокожировых и высокоуглеводных рационов. Поэтому нецелесообразно использование их в исследованиях по моделированию МС. Хотя у A/J мышей может развиваться инсулинорезистентность на высокоуглеводном рационе питания. Для моделирования основных проявлений МС лучше всего подходят дикие породы мышей C57BL/6 [6], а также крысы со спонтанной гипертензией линии SHR [8].
Рацион с высоким содержанием поваренной соли
Добавление 8% поваренной соли к стандартному полусинтетическому рациону вызывает у солечувствительных крыс линии DahlSS существенное повышение и систолического, и диастолического давления в период со 2-й по 4-ю неделю применения рациона (см. рис. 2).
Кроме полусинтетических рационов, широко используются стандартные рационы промышленного производства, в частности высокожировой рацион с холестерином, содержащий 60% ккал за счет жира, 20% углеводов и 20% белка, а также 0,15% холестерина (D01120401; Research Diets Inc., New Brunswick, NJ, США) и др. [9].
Показатели для оценки развития метаболического синдрома у разных видов животных
Для оценки развития МС в условиях эксперимента используются как биохимические показатели углеводного, липидного и белкового обмена (глюкоза и триглицериды крови, липидные фракции холестерина и др.), так и антропометрические и физиологические показатели (длина и масса тела, окружность живота, длина голени, артериальное давление и др.). На основании этих показателей рассчитываются различные коэффициенты (ИМТ, соотношение окружности живота к длине тела и др.); исследуется также масса органов, гистология и гистохимия органов и тканей [4, 12, 17]. Функцию почек оценивают по таким показателям, как общий белок, альбумины, креатинин и мочевина плазмы крови [4].
Антропометрические исследования проводят под наркозом. Животных обычно взвешивают еженедельно, ИМТ рассчитывают у кроликов как массу тела (кг) [длину тела (м) × высоту (м)]-1, у крыс – как массу тела (г)/длину тела2 (см2), а длину тела крысы измеряют между носовой и анальной областями [4, 11]. Окружность живота (см) измеряют рулеткой вокруг передней части живота.
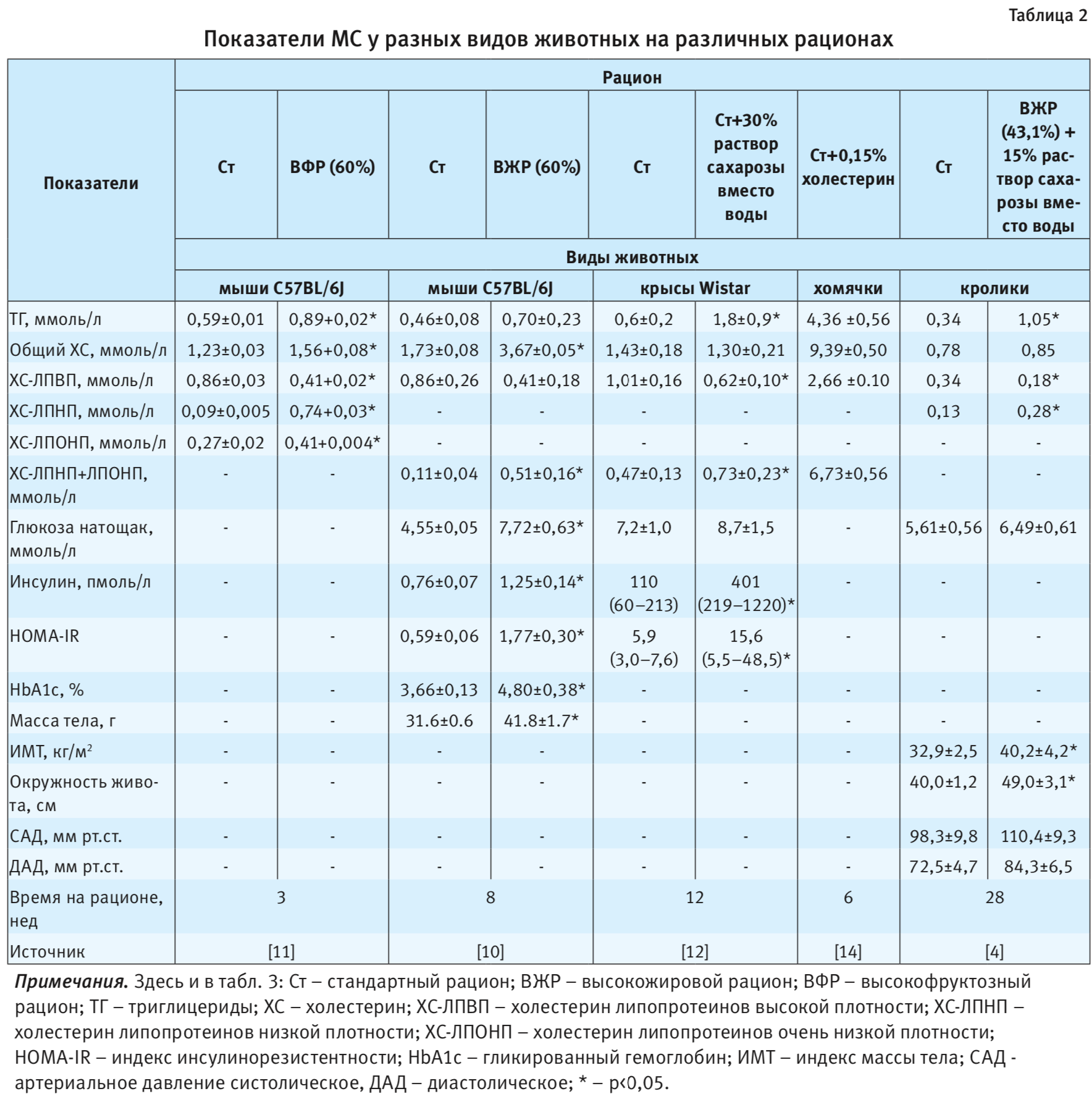
Согласно данным табл. 2 у диких мышей линии C57BL/6J уже через 3 нед нахождения на высокофруктозном рационе отмечаются существенные нарушения липидного обмена. Высокожировой рацион также вызывает у этой породы мышей дислипидемию, гипергликемию, гиперинсулинемию, ожирение и инсулинорезистентность. У крыс линии Wistar на рационе, обогащенном сахарозой, изменения липидного и углеводного обмена, инсулинорезистентность развиваются несколько позже, чем у мышей – на 12-й неделе. Следует отметить, что и у хомячков наблюдается высокое содержание триглицеридов, общего холестерина и холестерина ЛПНП и ЛПОНП. У кроликов к 28-й неделе выявляют достоверное повышение содержания триглицеридов и холестерина ЛПВП, увеличение окружности живота и ИМТ. Кроме того, отмечают выраженную тенденцию к увеличению содержания глюкозы в плазме крови, а также повышение САД и ДАД (табл. 2).
Модели МС на кроликах
Экспериментальные диетиндуцированные модели МС на кроликах адекватнее МС человека, чем модели на грызунах [4]. В одной из последних работ по данной проблеме испанские исследователи указывают, что наиболее эффективными для моделирования большинства проявлений МС у кроликов являются модели с высоким содержанием жира и сахарозы [4]. Так, они использовали высокожировой рацион S9052-E020 немецкой фирмы Ssniff (Soest) с добавлением в воду для питья 15% сахарозы. Контрольная группа животных находилась на стандартном рационе V2333-000 той же фирмы. При этом высокожировой рацион содержал 15,7% белка, 43,1% жира и 41,2% углеводов; его энергетическая плотность равнялась 3,7 ккал/г; а контрольный – соответственно 23,4, 11,1 и 65,5%, с энергетической плотностью 2,7 ккал/г. За 28 нед, в течение которых кролики находились на указанных рационах, у них развивалось множество проявлений МС (см. табл. 2).
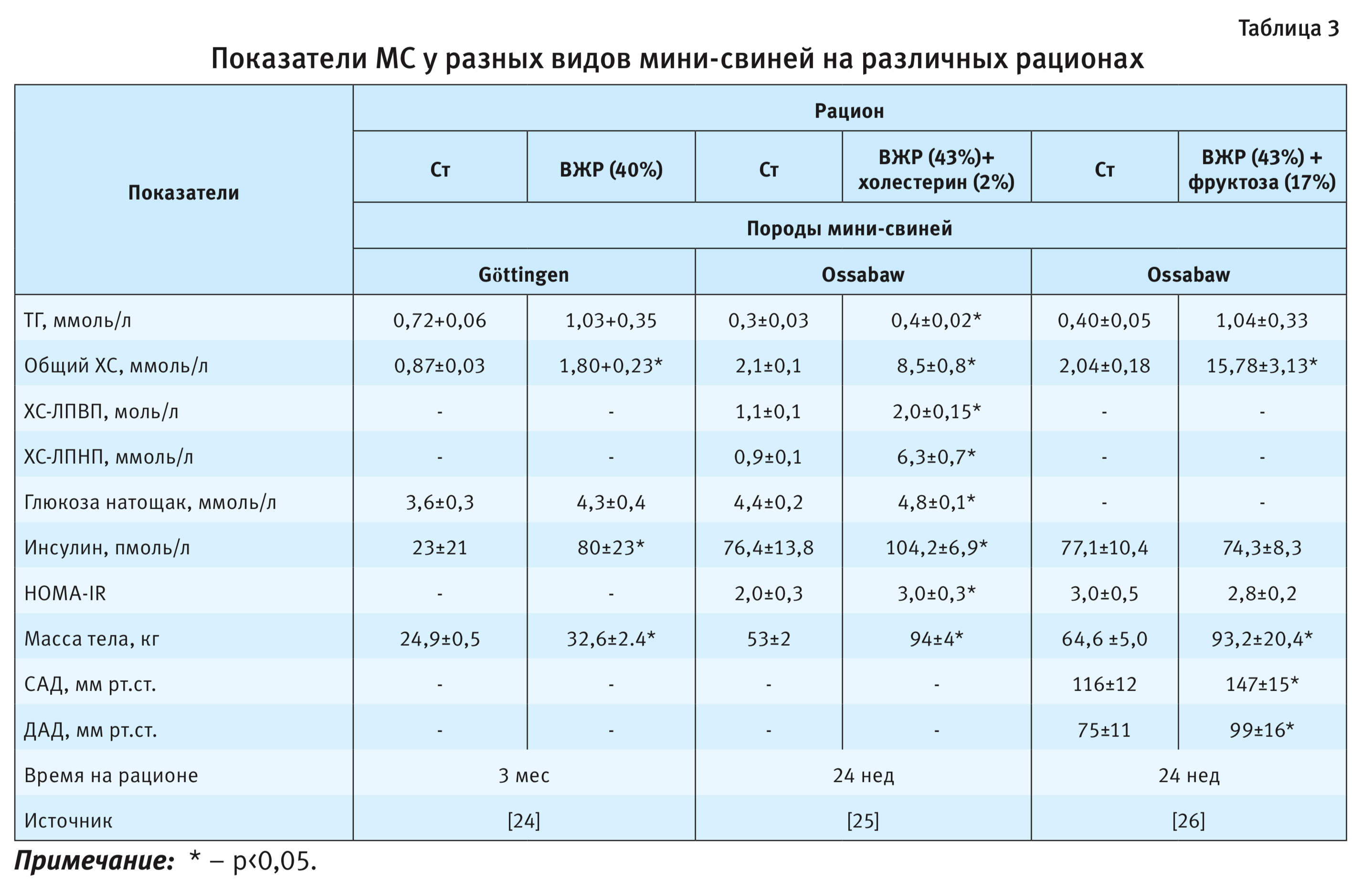
Модели МС на мини-свиньях
Модели МС на мини-свиньях наиболее близки патогенезу его развития у человека: сходство анатомии организма, желудочно-кишечного тракта, состава тела, всеядность, предрасположенность к развитию тучности и ассоциированных с ней сердечно-сосудистых заболеваний (гипертензия и атеросклероз) [1]. Тот факт, что содержание холестерина ЛПНП у мини-свиней высокое, а холестерина ЛПВП – низкое как и у человека, что дополнительно указывает на целесообразность выбора этого крупного вида животных для доклинических фармакологических исследований МС и связанных с ним заболеваний. Наиболее часто используются рационы питания с высоким содержанием жира (43%), обогащенные холестерином (2–4%) и холатом натрия (0,7%) [18].
Однако не у всех пород мини-свиней удается вызвать симптомы МС; в частности, у породы Yucatan
большинство показателей МС, за исключением дислипидемии, развивается довольно слабо. Этих животных тоже используют,
но очень редко [18–20]. В то же время у таких пород мини-свиней, как Ossabaw, Göttingen,
Chinese Guizhou, довольно легко развивается МС на фоне высококалорийного питания [1, 20, 21]. Особенно рекомендуются
и наиболее часто используются мини-
свиньи породы Ossabaw [18, 22], у которых наблюдаются основные
критерии МС: первичная инсулинорезистентность, ожирение, гипертриглицеридемия, повышение соотношения
ХС-ЛПНП/ХС-ЛПВП, гипертензия и ишемическая болезнь сердца.
Развитие МС у мини-свиней, в частности у породы Ossabaw, происходит постепенно. Примерно на 4-м месяце
применения высококалорийного (4700 ккал/сут) и высокожирового (43%) рациона (KT324, Purina Test Diet,
Richmond, IN) отмечается уже 3 основных проявления МС: ожирение, дислипидемия и гипертензия [22, 23] (табл. 3).
Затем присоединяется резистентность к инсулину, однако явная гипер-
гликемия у них не развивается
даже через 6 мес после начала кормления рационом с высоким содержанием сахарозы [1]. Поэтому для ускорения
индукции ожирения СД-2, мини-свиней рекомендуют подвергать воздействию небольших доз стрептозотоцина, выборочно
повреждающего инсулин-производящие β-клетки поджелудочной железы. Дозы стрептозотоцина подбираются
индивидуально путем титрования, с учетом того, чтобы они, вызывая гипергликемию, не стимулировали липолиз [1].
Заключение
Широкое распространение метаболического синдрома диктует необходимость создания адекватных экспериментальных моделей для поиска средств его профилактики и лечения. Используемые в настоящее время модели, имеют свои особенности, что влияет на конечный результат исследования. Поэтому ни одна из них не может быть полностью экстраполирована на человека. Следует экспериментировать с разными моделями на различных видах животных в зависимости от поставленной цели. Большинство применяемых в настоящее время моделей МС на грызунах не дают точного представления о патологии человека. Поэтому целесообразно также шире внедрять модели МС на других животных – кроликах, мини-свиньях и других.
Для моделирования основных проявлений МС больше всего подходят диетиндуцированные модели, близкие по этиологии и патогенезу МС человека. При этом наиболее часто применяются высококалорийные рационы питания с повышенным содержанием жира (до 60% от общей калорийности рациона), сахарозы и фруктозы (до 60–70% от общей калорийности) и комбинированные рационы (43% жира и 15–17% сахарозы или фруктозы). Большинство моделей требуют довольно значительного времени для индуцирования выраженных проявлений МС, поэтому широко применяется сочетание высококалорийных рационов с введением небольших доз стрептозотоцина.
Для оценки развития МС используются различные показатели, характеризующие основные проявления МС: липидный и углеводный обмен (триглицериды, фракции холестерина, глюкоза и инсулин плазмы крови, инсулинорезистентность, гликированный гемоглобин и др.), масса тела, окружность живота, артериальное давление и др.
Список источников
- Koopmans S.J., Schuurman T. Considerations on pig models for appetite, metabolic syndrome and obese type 2 diabetes: From food intake to metabolic disease. Eur J Pharmacol. 2015 Jul 15;759:231–9. DOI: 10.1016/j.ejphar.2015.03.044.
- Smoljanskijj BL, Lifljandskijj VG. Lechebnoe pitanie. M. : Eksmo, 2010. 688 s.
- Kravchuk E.N., Galagudza M.M. Jeksperimental’nye modeli metabolicheskogo sindroma. Arterial’naja gipertenzija. 2014. Vol.20; 5: 377–83.
- Arias-Mutis O.J., Marrachelli V.G., Ruiz-Saurí A., Alberola A., Morales J.M., Such-Miquel L., Monleon D., Chorro F.J., Such L., Zarzoso M. Development and characterization of an experimental model of diet-induced metabolic syndrome in rabbit. PLOS ONE, |May 23, 2017: 18. DOI: 10.1371/journal.pone.0178315. eCollection 2017.
- Panchal S.K. and Brown L. Rodent Models for Metabolic Syndrome Research. / J. Biomed. Biotechnol. Volume 2011, Article ID 351982, 14 pages. DOI:10.1155/2011/351982.
- Aydin S., Aksoy A., Aydin S., Kalayci M., Yilmaz M., Kuloglu T., Citil C., Catak Z. Today’s and yesterday’s of pathophysiology: Biochemistry of metabolic syndrome and animal models / Suleyman Aydin [et al.]. Nutrition. 2014. Jan; 30 (1): 1–9. DOI: 10.1016/j.nut.2013.05.013.
- Balkau B., Valensi P., Eschwege E., Slama G. A review of the metabolic syndrome. Diabetes Metab J. 2007;33:405–13. DOI: 10.1016/j.diabet.2007.08.001
- Kovaleva M.A., Makarova M.N., Selezneva A.I., Makarov V.G. Primenenie zhivotnyh so spontannoj gipertenziej dlja modelirovanija metabolicheskogo sindroma. Obzory po klinicheskoj farmakologii i lekarstvennoj terapii, 2012; 4: 91–94.
- Neuhofer A., Wernly B., Leitner L., Sarabi A., Sommer N.G., Staffler G., Zeyda M., Stulnig T.M. An accelerated mouse model for atherosclerosis and adipose tissue inflammation. Cardiovasc Diabetol. 2014 Jan 17;13:23. DOI: 10.1186/1475-2840-13-23.
- Kim H.J., Kim S., Lee A.Y., Jang Y., Davaadamdin O., Hong S.-H., Kim J.S., Cho M.-H. The Effects of Gymnema sylvestre in High-Fat Diet-Induced Metabolic Disorders. American. J. Chin. Med., 2017. Vol. 45; 4: 1–20. DOI: 10.1142/S0192415X17500434
- Ajiboye T.O., Hussaini A.A., Nafiu B.Y., Ibitoye O.B. Aqueous seed extract of Hunteria umbellata (K. Schum.) Hallier f. (Apocynaceae) palliates hyperglycemia, insulin resistance, dyslipidemia, inflammation and oxidative stress in high-fructose diet-induced metabolic syndrome in rats. J. Ethnopharmacol. 2017 Feb 23; 198: 184–93. DOI: 10.1016/j.jep.2016.11.043
- Lucero D., Olano C., Bursztyn M., Morales C., Stranges A., Friedman S., Macri E.V., Schreier L., Zago V. Supplementation with n-3, n-6, n-9 fatty acids in an insulin resistance animal model: Does it improve VLDL quality? Food Funct. 2017 May 24; 8 (5): 2053–61. DOI: 10.1039/c7fo00252a.
- Chu D.T., Malinowska E., Jura M., Kozak L.P. C57BL/6J mice as a polygenic developmental model of diet-induced obesity. Physiol Rep. 2017 Apr; 5 (7). pii: e13093. DOI: 10.14814/phy2.13093.
- Wilson T.A., Nicolosi R.J., Delaney B., Chadwell K., Moolchandani V., Kotyla T., Ponduru S., Zheng G.H., Hess R., Knutson N., Curry L., Kolberg L., Goulson M., Ostergren K. Reduced and high molecular weight barley beta-glucans decrease plasma total and non-HDL-cholesterol in hypercholesterolemic Syrian golden hamsters. J Nutr. 2004 Oct; 134 (10): 2617–22.
- Dourmashkin J.T, Chang G.Q., Gayles E.C., Hill J.O., Fried S.K., Julien C., Leibowitz S.F. Different forms of obesity as a function of diet composition. Int J Obes (Lond) 2005; 29: 1368–78. DOI: 10.1038/sj.ijo.0803017.
- Zern T.L., West K.L., Fernandez M.L. Grape polyphenols decrease plasma triglycerides and cholesterol accumulation in the aorta of ovariectomized guinea pigs. J. Nutr 2003; 133: 2268–72.
- Hansen A.K. Animal Models of Metabolic and Inflammatory Diseases In: J. Hau, S.J. Schapiro (editors) Handbook of Laboratory Animal Science, Volume III, Third Edition. Animal Models. CRC Press. – 2013. – P. 159–94.
- Zhang X., Lerman L.O. Investigating the Metabolic Syndrome: Contributions of Swine Models. Toxicol Pathol. 2016 Apr; 44 (3): 358–66. DOI: 10.1177/0192623316630835.
- Neeb Z.P., Edwards J.M., Alloosh M., Long X., Mokelke E.A., Sturek M. Metabolic Syndrome and Coronary Artery Disease in Ossabaw Compared with Yucatan Swine. Comparative Medicine. – 2010. – Vol. 60, 4: 300–15.
- Litten-Brown J.C., Corson A.M., Clarke L. Porcine models for the metabolic syndrome, digestive and bone disorders: a general overview. Animal. 2010 Jun;4(6):899-920. DOI: 10.1017/S1751731110000200.
- M. E. Spurlock, N.K. Gabler The Development of Porcine Models of Obesity and the Metabolic Syndrome J. Nutr. 2008.138: 397–402.
- Westover A.J., Johnston K.A., Buffington D.A., Humes H.D. An Immunomodulatory Device Improves Insulin Resistance in Obese Porcine Model of Metabolic Syndrome. J. Diabetes Res. 2016. Vol. 2016, Article ID 3486727, 10 pages. DOI: 10.1155/2016/3486727.
- Sham J.G., Simianu V.V., Wright A.S., Stewart S.D., Alloosh M., Sturek M., Cummings D.E., Flum D.R. Evaluating the Mechanisms of Improved Glucose Homeostasis after Bariatric Surgery in Ossabaw Miniature Swine. J. Diabetes Res. Vol. 2014, Article ID 526972, 7 pages. DOI: 10.1155/2014/526972.
- Larsen M.O., Rolin B., Wilken M., Carr R.D., Svendsen O. High-Fat High-Energy Feeding Impairs Fasting Glucose and Increases Fasting Insulin Levels in the Gettingen Minipig: Results from a Pilot Study. Ann. N.Y. Acad. Sci. 2002 Jun; 967: 414–23.
- Bell L.N., Lee L., Saxena R., Bemis K.G., Wang M., Theodorakis J.L., Vuppalanchi R., Alloosh M., Sturek M., Chalasani N. Serum proteomic analysis of diet-induced steatohepatitis and metabolic syndrome in the Ossabaw miniature swine. Am. J. Physiol. Gastrointest. Liver Physiol. 2010. 298 (5), G746-G754. DOI: 10.1152/ajpgi.00485.2009.
- Liang T., Alloosh M., Bell L.N., Fullenkamp A., Saxena R., Van Alstine W., Bybee P., Werling K., Sturek M., Chalasani N., Masuoka H.C. Liver Injury and Fibrosis Induced by Dietary Challenge in the Ossabaw Miniature Swine. PLoS ONE, 2015. 10 (5): e0124173. DOI:10.1371/journal.pone.0124173



