Гистологическая оценка патологических изменений суставов при различных способах индукции хронического артрита у крыс
Мужикян А.А., Шекунова Е.В., Кашкин В.А., Макарова М.Н., Макаров В.Г. Гистологическая оценка патологических изменений суставов при различных способах индукции хронического артрита у крыс. Лабораторные животные для научных исследований. 2018; 1. https://doi.org/10.29296/2618723X-2018-01-04
Резюме
Цель данного исследования – апробация известных гистологических критериев оценки изменений в суставах и сравнительный анализ 2 экспериментальных моделей хронического артрита – артрита, индуцированного введением полного адъюванта Фрейнда, и артрита, вызванного введением каррагинина. Клинические и гистопатоморфологические признаки оценивались не только качественно, но и категориальной системе. Показано, что введение полного адьюванта Фрейнда моделирует состояние ревматоидного артрита. Напротив, введение каррагинина способствует развитию хронического воспалительного артрита, лишенного аутоиммунологического компонента. Полученные результаты могут служить основой для выбора определенного методического подхода для фармакологической оценки эффективности лекарственных препаратов с антиревматоидным, противовоспалительным и (или) иммуномодулирующими свойствами давления. Приводится информация об изменениях основных характеристик в зависимости от пола и возраста лабораторных животных. Каждая из рассмотренных линий грызунов имеет специфические свойства, характерные для сахарного диабета и метаболического синдрома, что позволяет всесторонне изучать механизмы развития патологий, а также потенциальных лекарственных препаратов для терапии данных заболеваний.
Введение
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани аутоиммунной природы, при котором поражаются суставы. РА страдают около 1% взрослого населения планеты [1] и около 1 млн населения Российской Федерации [2]. Заболевание распространено во всем мире, частота встречаемости увеличивается с возрастом, причем женщины болеют в 3 раза чаще, чем мужчины. Хотя причины возникновения РА окончательно неясны, хорошо изучены механизмы воспалительного процесса, который приводит к постепенному разрушению суставов [3]. Воспаление приводит к прогрессирующей деструкции хрящевой ткани суставов, синовиальной гиперплазии, синовиту, эрозии костной ткани, повышению уровня медиаторов воспаления.
В экспериментальных исследованиях хронический артрит моделируется введением различных агентов, в том числе введением полного адъюванта Фрейнда, лямбда-каррагинина, коллагена, формалина. Данные модели широко используются для изучения специфической противовоспалительной и противоревматоидной активности фармакологических веществ. Однако клиническая картина, развивающаяся при введении различных индуцирующих агентов, имеет свои особенности. Так, клинические признаки артрита появляются приблизительно через 10 дней после введения адъюванта и через 21 день после введения каррагинина [4]. Адъювант-индуцированный артрит (АИА) – это Т-лимфоцитарнозависимый артрит, который во многом схож с РА, включая развитие отека околосуставных тканей, деградацию хряща, потерю функциональной активности сустава, лимфоцитарную инфильтрацию внутрисуставной полости. При АИА наблюдается резорбция костной ткани, однако поражения хряща выражены в меньшей степени, чем при экспериментальном артрите, вызванном введением коллагена [5]. Напротив, каррагининовая модель артрита не сопровождается подобной активацией иммунного ответа, так как макрофаги не способны к переработке молекулы каррагинина, в результате чего происходит его накопление в лизосомах с развитием воспалительной реакции и последующей гибелью клетки [6]. Таким образом, активированные Т-клетки
не участвуют в запуске иммунного ответа при данной модели артрита.
В данном исследовании был проведен сравнительный анализ 2 экспериментальных моделей хронического артрита – артрита, индуцированного введением полного адъюванта Фрейнда, и артрита, вызванного введением каррагинина. Были детально изучены гистопатоморфологические изменения, которые наблюдались на разных этапах развития патологии. Полученные результаты могут служить основой для выбора определенного методического подхода для фармакологической оценки эффективности лекарственных препаратов с антиревматоидным, противовоспалительным и (или) иммуномодулирующими свойствами.
Материал и методы
Эксперименты выполнены на самках крыс линии Вистар массой 200–250 г (питомник «Рапполово», Россия). Животных содержали в стандартных условиях, согласно Директиве 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях и в соответствии с Санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) (СП 2.2.1.3218-17; утв. постановлением Главного государственного санитарного врача РФ № 41 от 29 августа 2014 г.).
В период адаптации крысы группами по 4 особей были размещены в прозрачных клетках из поликарбоната с площадью пола 1419 см2 (минимально допустимая площадь на 1 животное – 250 см2). В качестве подстила использовали древесные гранулы (ООО «Биосфера», Санкт-Петербург, Россия).
Корм для лабораторных животных «ЛБК–120», изготовленный в соответствии с ГОСТ Р 50258-92 «Комбикорма полнорационные для лабораторных животных», давали ad libitum в кормовое углубление стальной решетчатой крышки клетки.
Животные получали воду, очищенную и нормированную по органолептическим свойствам, по показателям рН, сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака, хлоридов, сульфатов, кальция и тяжелых металлов на основании СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». Воду в стандартных поилках со стальными крышками-носиками давали ad libitum.
Животных содержали в контролируемых условиях окружающей среды (при температуре 19–25°C и относительной влажности воздуха 30–70%, NH3≤10 мг/м3, CO2≤0,15 об.%). Световой режим составил 12 ч света и 12 ч темноты. Был установлен режим воздухообмена, обеспечивающий смену около 15 объемов помещения в час.
За неделю до начала эксперимента животные были рассажены в клетки индивидуального содержания.
Экспериментальные процедуры были одобрено комитетом по биоэтике НПО «Дом фармации» (БЭК №1.36/16) и выполнены в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента, Совета Европейского Союза от 22 сентября 2010 г. по охране животных и политикой Национальных институтов здоровья США «Принципы лабораторного ухода за животными». Все данные были собраны и проанализированы 2 независимыми наблюдателями, которые не знали о групповой принадлежности животных. Это исследование соответствовало принципам 3R (reduction, refinement and replacement). Все усилия были направлены на минимизацию страданий животных и сокращение их числа.
Индукция артрита и дизайн эксперимента. Адъювант-индуцированный артрит АИА. Для индукции артрита крысам в плантарную поверхность задней лапы вводили полный адъювант Фрейнда (complete Freund adjuvant (CFA)) производства Sigma-Aldrich в объеме 100 мкл [7, 8].
Каррагенин-индуцированный артрит (КИА). При моделировании каррагенин-индуцированного артрита в плантарную часть задней лапы крыс самок вводили 100 мкл 3% λ-каррагенина [9].
На 29-й день эксперимента животные были эвтаназированы в СО2-камере.
Гистологическое исследование. Исследуемые отделы конечностей ампутировали на уровне нижней трети голени рассечением мягких тканей, большой и малой берцовой костей, без нарушения целостности суставов, с фиксацией материала для гистологического исследования.
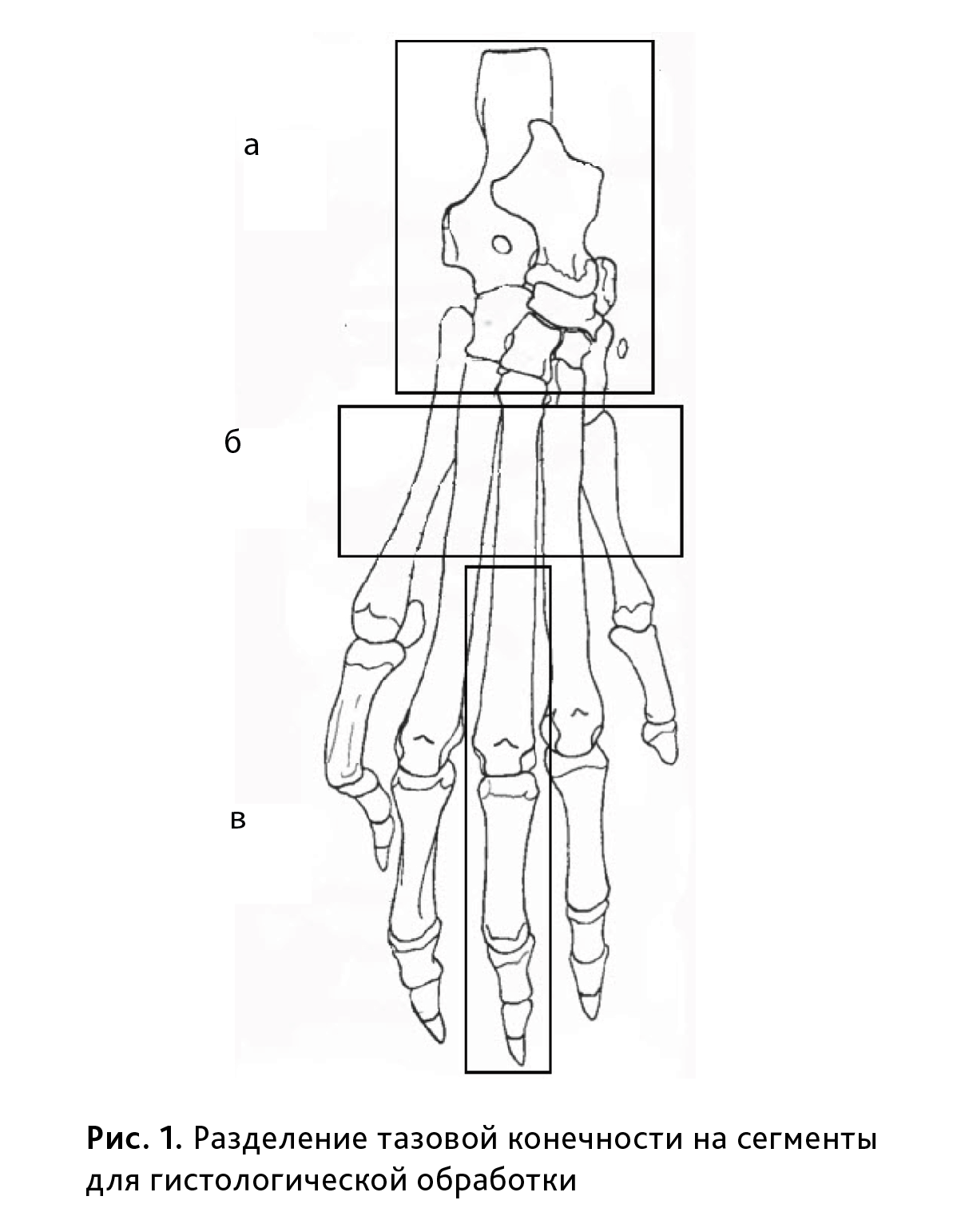
Гистологическому исследованию были подвергнуты пораженные суставы крыс, в том числе заплюсневый сустав, образованный блоком костей голени, костями заплюсны и проксимальным концом плюсневых костей, включающий в себя art. tarsocruralis, aa. intertarsae (представленный a. talocalcaneonavicularis, a. talocalcanea, a. calcaneocuboidea, a. cuneonavicularis), art. tarsometatarsea, а также плюснофаланговые, венечные и дистальные межфаланговые суставы пальцев стопы. Для этого конечности крыс фиксировали в 10% растворе нейтрального формалина, затем декальцинировали в электролитном растворе на основе муравьиной и соляной кислот в течение 14 дней, после чего делили на сегменты (рис. 1) и заливали в парафин. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином.
Анализ гистологических препаратов выполняли с помощью светооптического микроскопа Carl Zeiss Axio Scope A1 (Германия) при увеличении 50, 100, 200 и 400. Микрофотографирование проводили цифровой фотокамерой AxioCam ICc 1 и с помощью программного обеспечения AxioVision Rel. 4.8 (Германия).
Структуры заплюсневого сустава и мягких тканей изучали на сагиттальных и плантарных срезах конечности (см. рис.1, а, б); для изучения межфаланговых суставов дистальную часть конечности отделяли поперечным разрезом плюсневых костей, а суставы, образованные плюсневыми костями, проксимальными, средними и дистальными фалангами изучали на сагиттальных срезах (см. рис. 1, в). Таким образом, было исследовано не менее 10 суставов каждого животного, попавших на срез. Критериями гистологической оценки служили изменения околосуставного аппарата (фиброзной и синовиальной капсулы), наличие воспалительного инфильтрата, состояние суставного хряща и костной ткани. В баллах от 0 (норма) – до 5 (максимальная выраженность патологии) оценивали 6 параметров.
Степень поражения суставов оценивали по модифицированной шкале Hegen (2003) [10], при этом анализировали следующие показатели:
- выраженность общего воспаления сустава (наличие инфильтрата, эдемы, выпота);
- степень сужения суставной полости;
- изменения костной ткани (остеолизис);
- изменения синовиальной оболочки (гиперплазия);
- выраженность паннуса (наличие в субинтимальном слое суставной капсулы грануляционной ткани с высоким содержанием фибробластов, лимфоцитов и макрофагов);
- степень дегенерации хряща.
При максимальной выраженности патологического процесса комплексная оценка для 1 животного составляла 30 баллов.
Более детально оценивали характер и выраженность изменений хрящевой ткани сустава по модифицированной шкале Mankin в баллах от 0 (норма) до 3 [11, 12]. Анализировали следующие показатели:
структура поверхности (1 балл – неровности, эрозии, 2 балла – трещины, 3 балла – расслоение);
клеточный состав (1 балл – незначительное снижение количества хондроцитов, 2 балла – значительное снижение количества хондроцитов, 3 балла – нет клеток);
окрашивание (1 балл – незначительное снижение окрашивания, 2 балла - значительное снижение окрашивания, 3 балла – нет окрашивания);
пролиферация клеток (1 балл – изогенные группы хондроцитов; по 2 клетки в группе; 2 балла – изогенные группы хондроцитов; по 2 и 3 клетки в группе); 3 балла – очаги пролиферации (более 3 клеток в группе).
При максимальной выраженности патологического процесса комплексная оценка для 1 животного составляла 12 баллов.
Статистическая обработка. Для анализа данных использовали тест Манна–Уитни, критерий Уилкокосона. Различия были определены при уровне значимости р<0,05. Статистический анализ выполняли с помощью программного обеспечения SPSS v16 (IBM Corp., США).
Результаты
АИА. Комплексная оценка состояния суставов включала в себя анализ основных изменений, характерных для ревматоидного/адъювантного артрита, а именно:
выраженность общего воспаления сустава;
изменения костной ткани;
изменения синовиальной оболочки (гиперплазия);
степень сужения суставной полости (анкилоз сустава);
выраженность паннуса, степень дегенерации хряща.
У всех животных контрольной группы в той или иной мере были обнаружены изменения суставного аппарата различной степени тяжести, характерные для ревматоидного артрита. Изменения проявлялись, прежде всего, усиленной пролиферацией синовиоцитов, гиперплазией, отечностью и утолщением синовиальной оболочки с нечеткими контурами и наличием на синовиальной интиме темных луковицеобразных ворсин (рис. 2, 3). В строме обнаруживался умеренный периваскулярный инфильтрат, представленный в основном лимфоцитами и плазматическими клетками. Прослеживалась картина развития негнойного пролиферативного синовита.
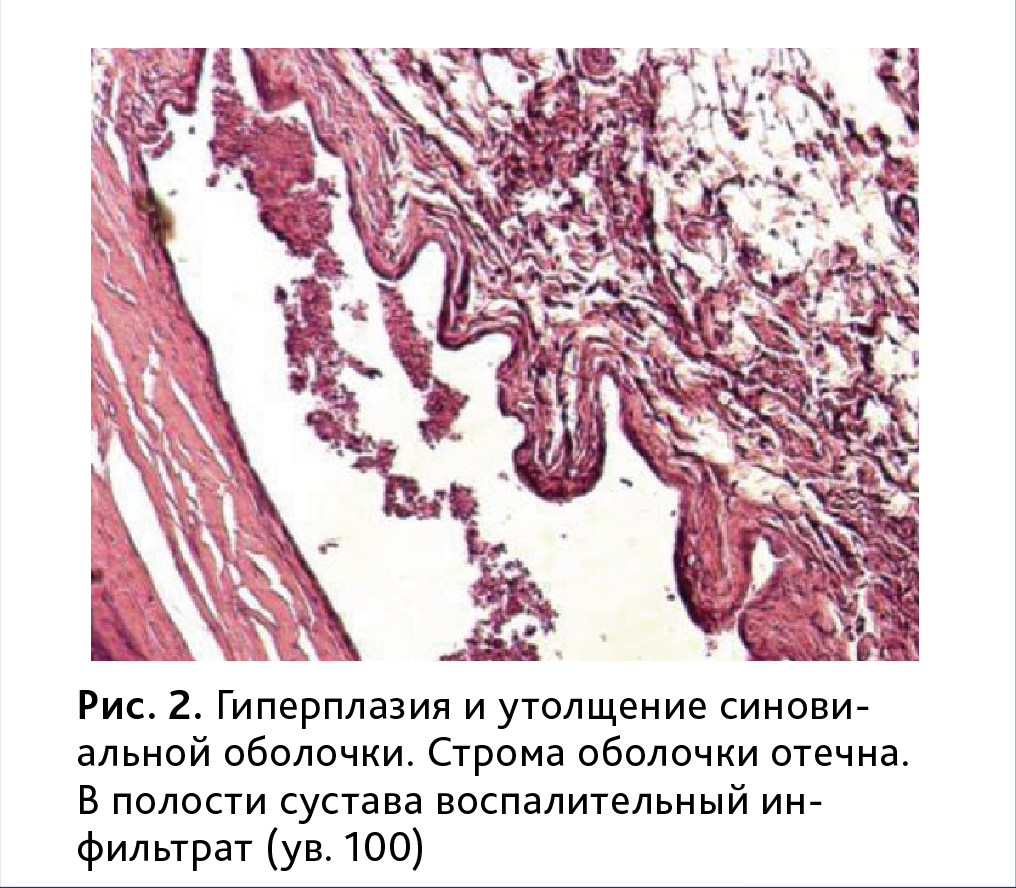
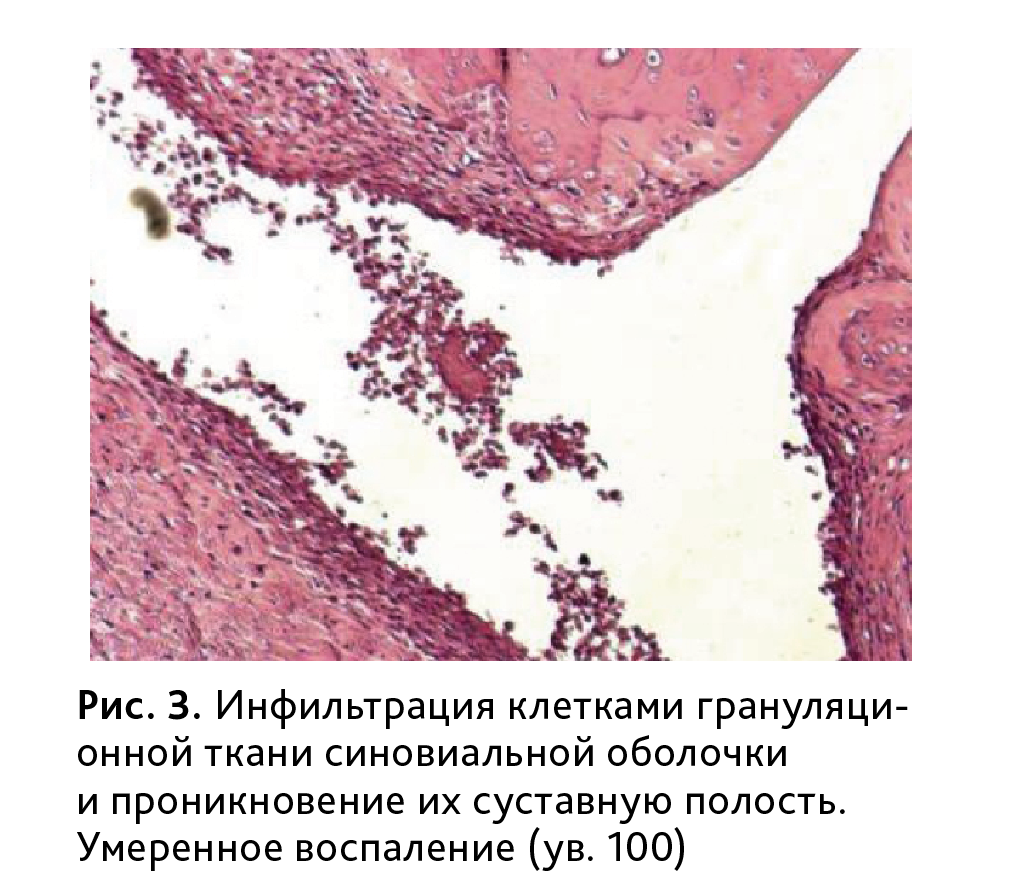
В большинстве случаев нормальная синовиальная оболочка замещалась молодой грануляционной тканью, состоящей из аморфного межуточного вещества, содержащего многочисленные кровеносные сосуды, а также клеток фибробластического ряда, макрофагов, нейтрофильных и эозинофильных лейкоцитов. У всех животных в разной степени отмечался паннус, образованный активно пролиферирующей грануляционной тканью, врастающей в субинтимальную оболочку фиброваскулярного слоя синовии. Процесс формирования паннуса (от нормы до максимальной степени выраженности) представлен на рис. 4. Максимальная степень выраженности наблюдалась у 25% животных.
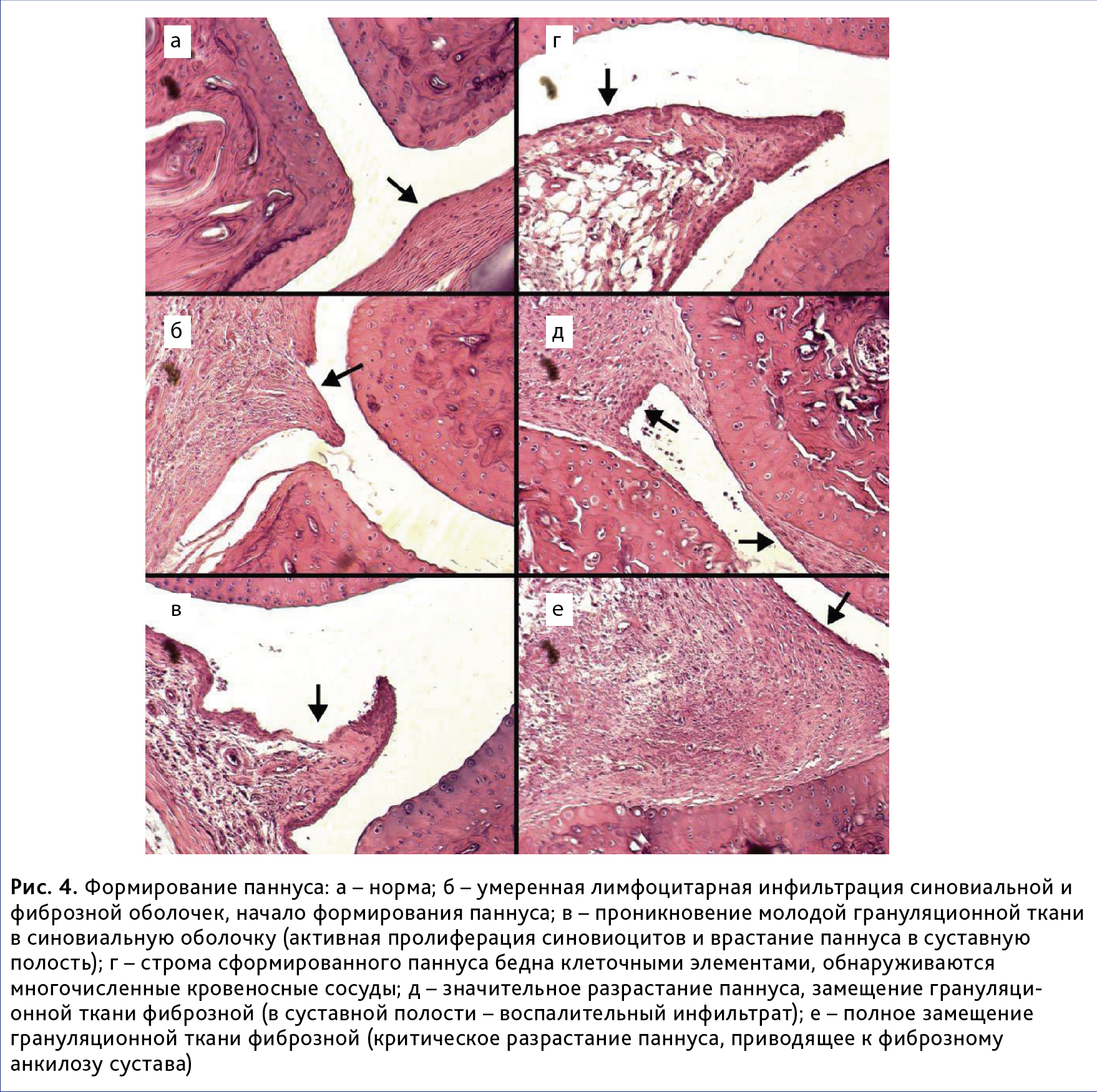
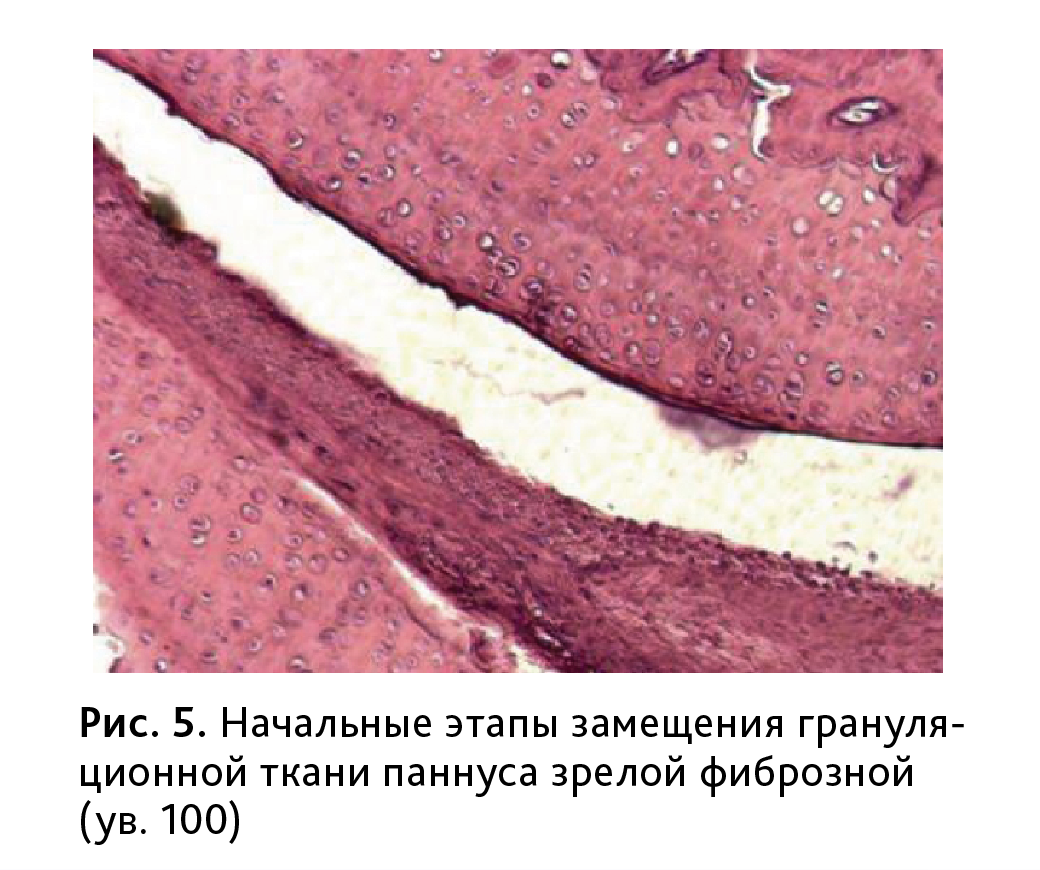
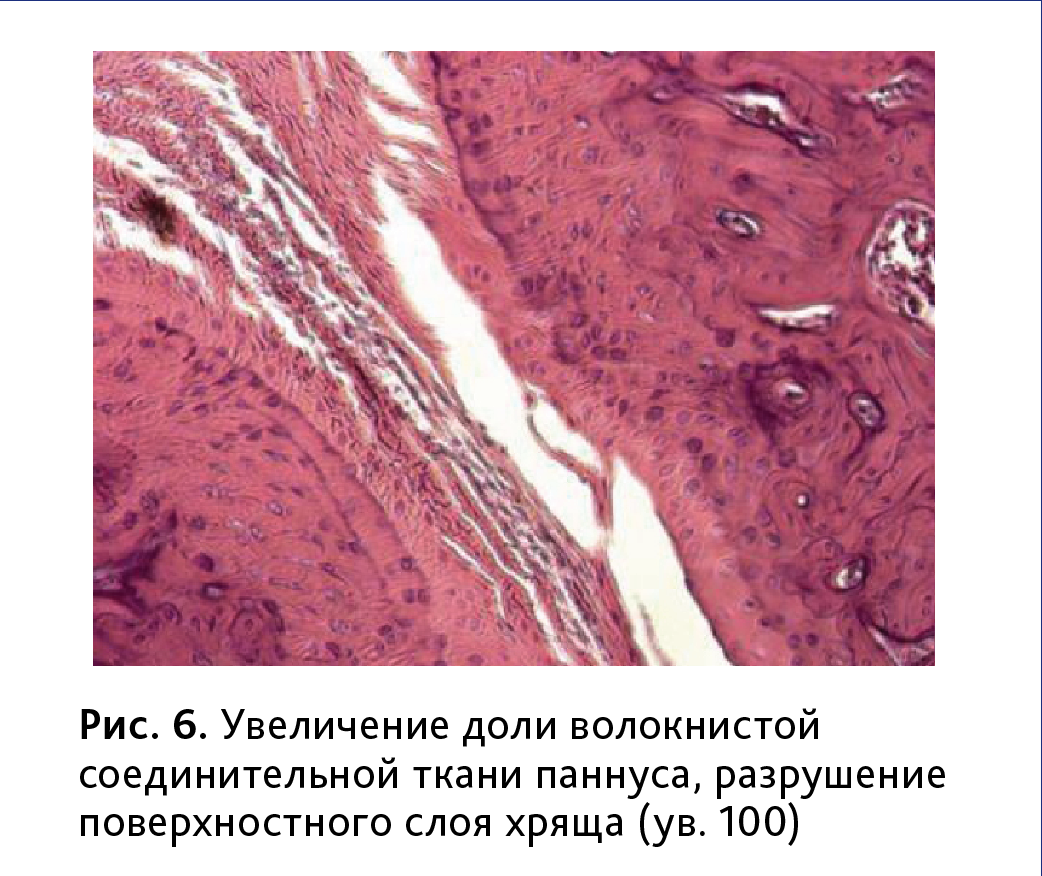
В 70% случаев грануляционная ткань паннуса замещалась зрелой фиброзной (рис. 5), что приводило, в том числе к глубоким изменениям гиалинового хряща, проявляющимся в формировании узур и трещин, набухании и вакуолизации матрикса, развитию дистрофических и некротических поражений хондроцитов
(рис. 6).
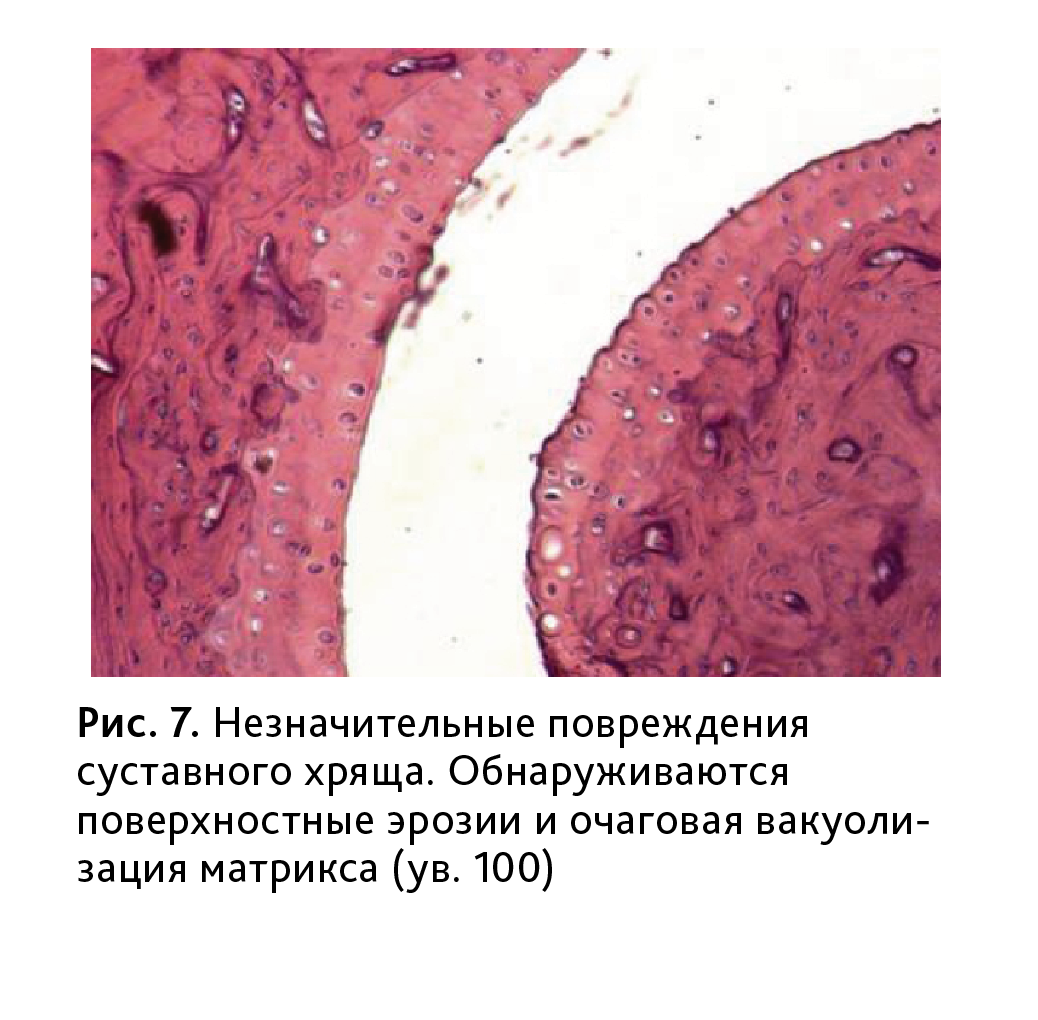
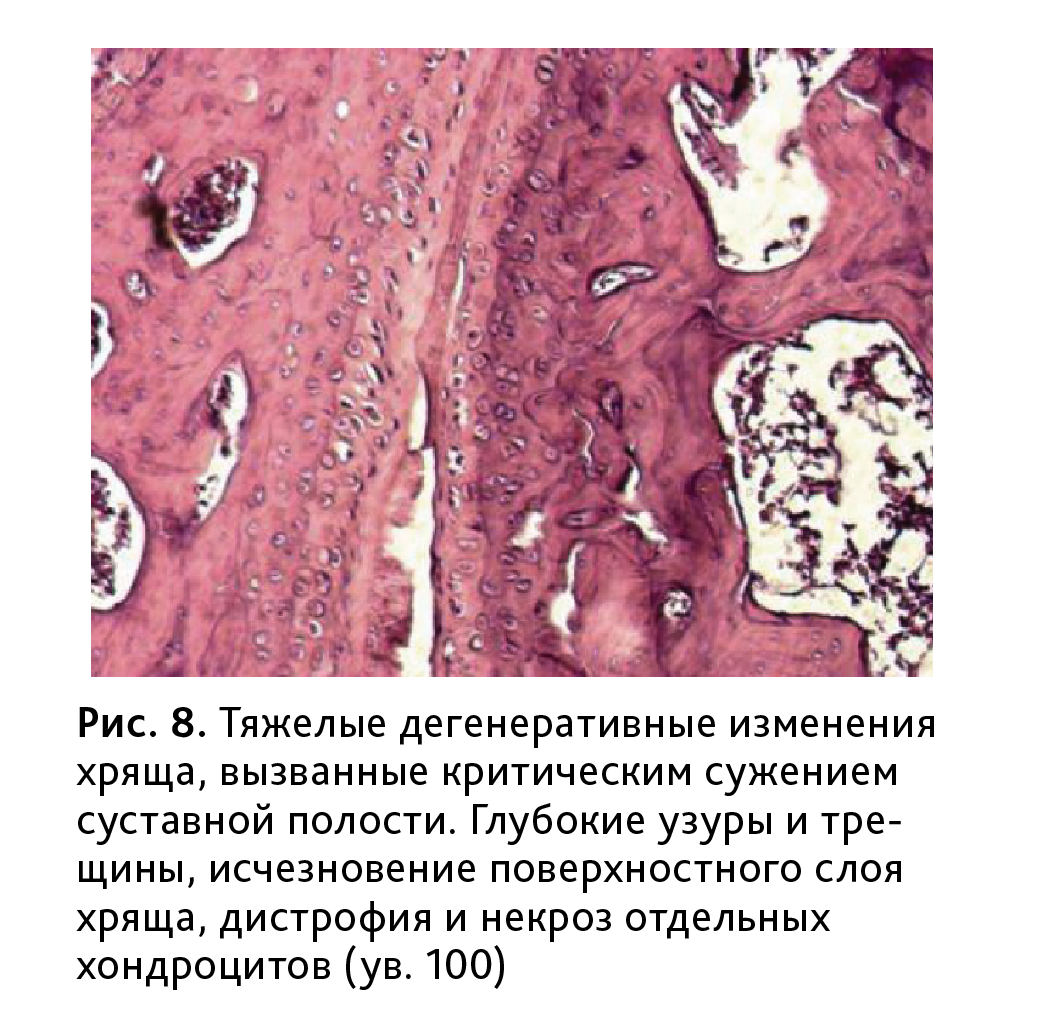
В хрящевой ткани обнаруживались поверхностные эрозии (рис. 7). Снижалась степень окрашивания хряща, указывающая на деструктивные изменения межклеточного матрикса, границы между слоями были размыты (рис. 8).
В тяжелых случаях отмечалось истончение и обеднение клетками хрящевой ткани, с очагами пролиферации, встречающееся часто при сужении суставного пространства, вызванного главным образом поражением околосуставного аппарата. У таких животных обнаруживались также субхондральные кисты и очаги остеопороза.
Различные варианты наблюдаемого в данном исследовании патологического сужения суставной полости представлены на рис. 9.
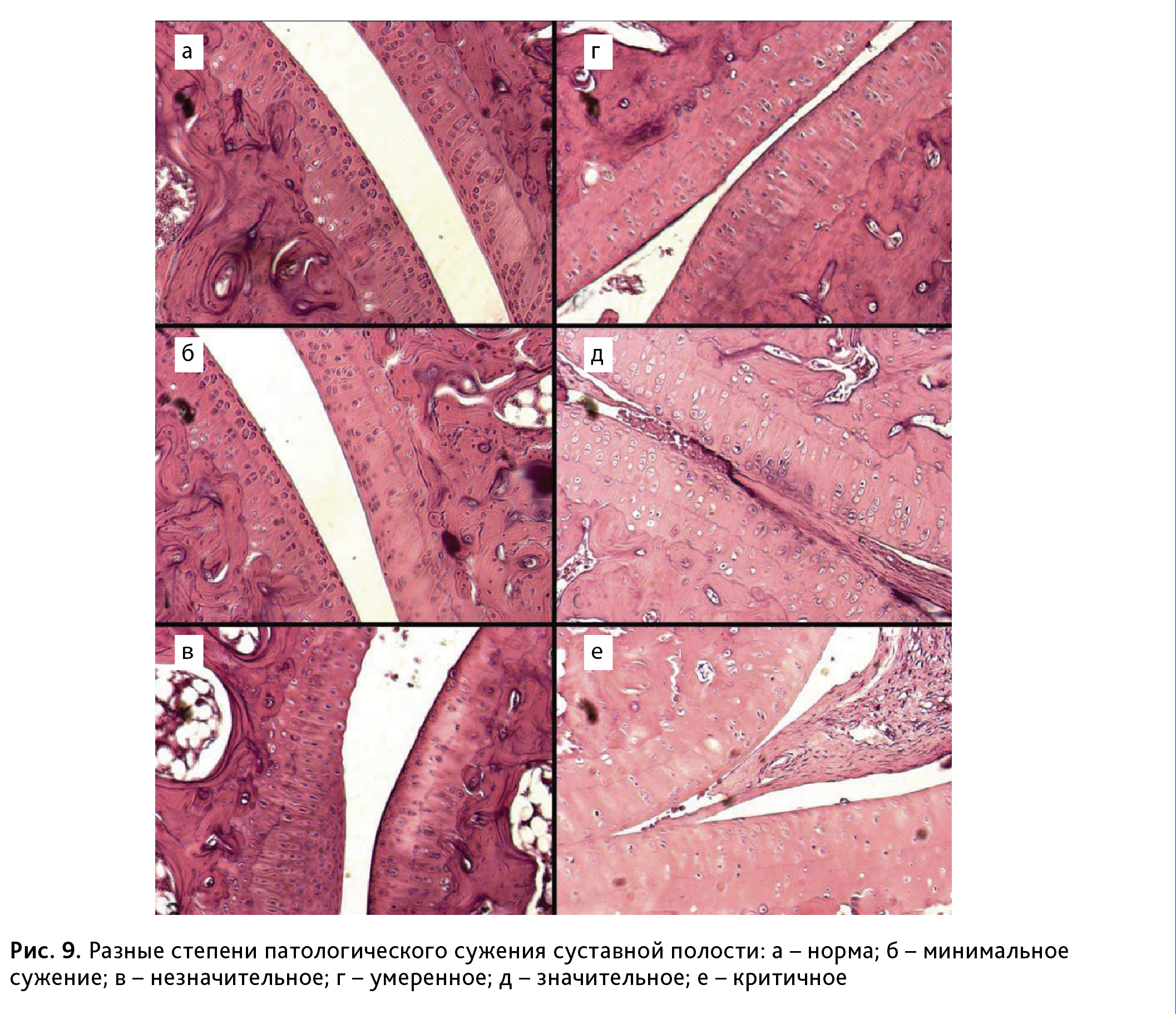
Таким образом, результаты гистологического анализа подтвердили наличие патоморфологических изменений, характерных для ревматоидного артрита.
У 4 животных из 6 наблюдались незначительные изменения (меньше 10 баллов по комплексной шкале оценки), у остальных животных отмечено развитие артрита в средней и тяжелой формах (более 11 баллов).
Выявлены следующие патоморфологические признаки: значительное увеличение паннуса, выраженные дегенеративные изменения хрящевой ткани, остеолиз, фиброзный анкилоз суставов, образование клеточных клонов (дуплетов, триплетов).
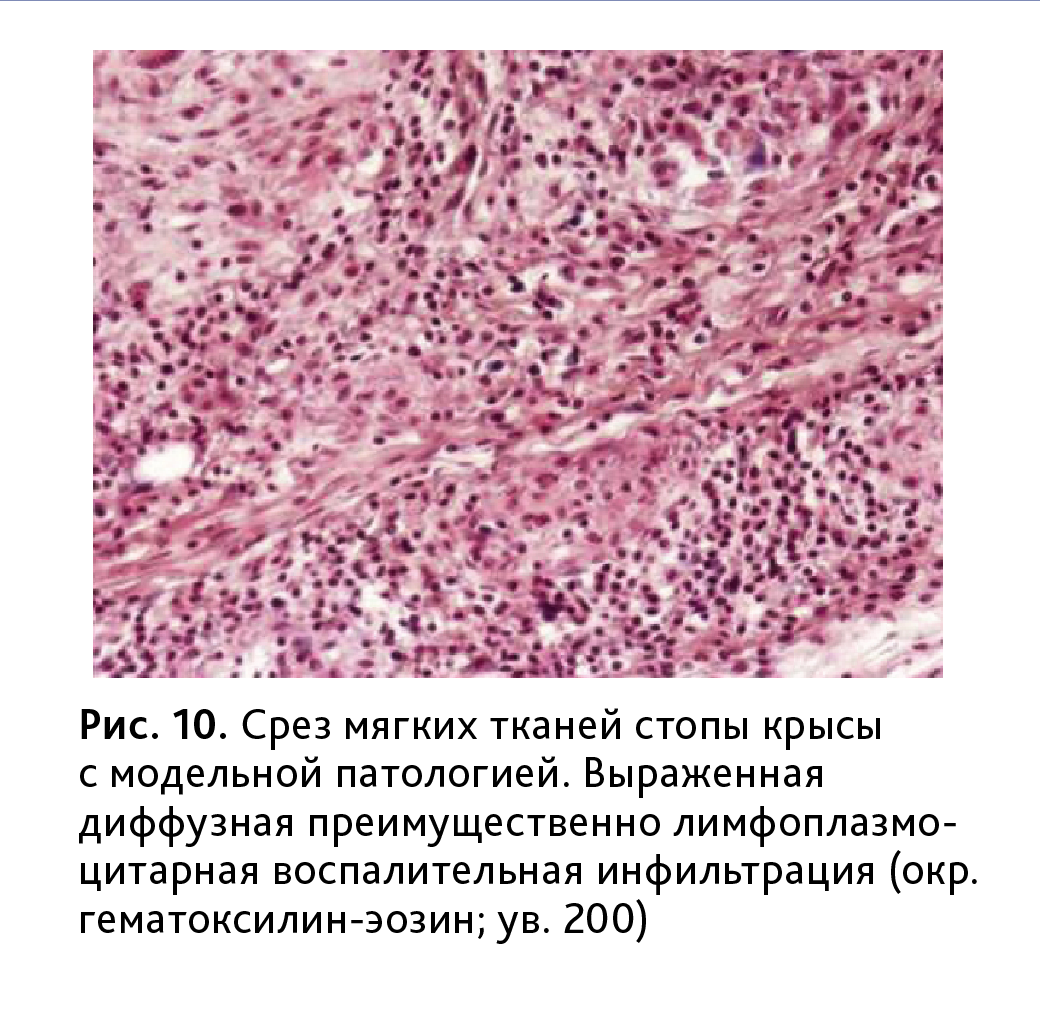
КИА. При анализе гистологических препаратов, полученных от поврежденных конечностей, выявлены изменения суставного аппарата и мягких тканей стопы с выраженным отеком и воспалительная инфильтрация глубоких слоев дермы и подкожной клетчатки (рис. 10).
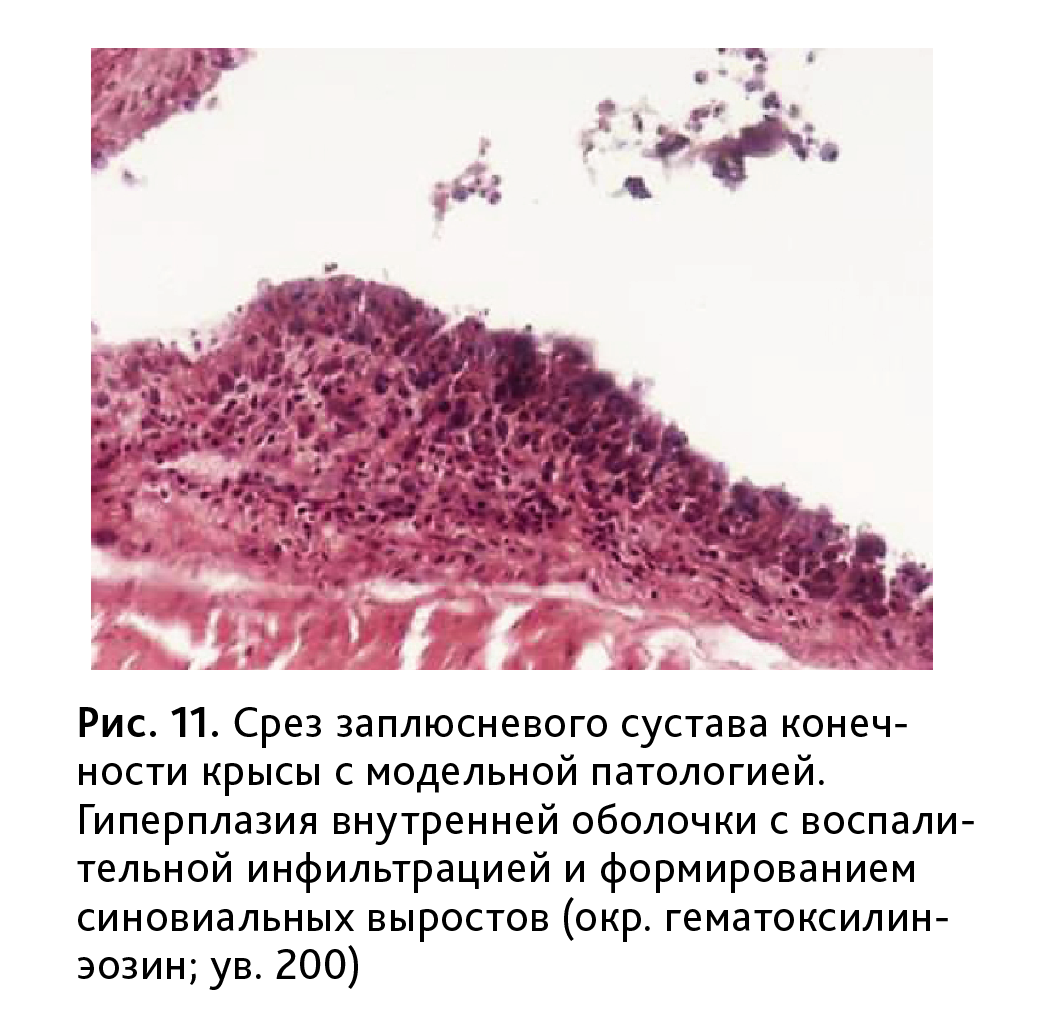
Повреждения суставного аппарата касались, прежде всего, фиброзной и синовиальной оболочек. Отмечалась усиленная пролиферация синовиоцитов, гиперплазия, отечность и утолщение синовиальной оболочки, с нечеткими контурами и наличием на синовиальной интиме темных луковицеобразных ворсин (рис. 11). Строма оболочки была диффузно инфильтрирована лимфоцитами и плазмоцитами, в большом количестве проникающими в суставную полость.
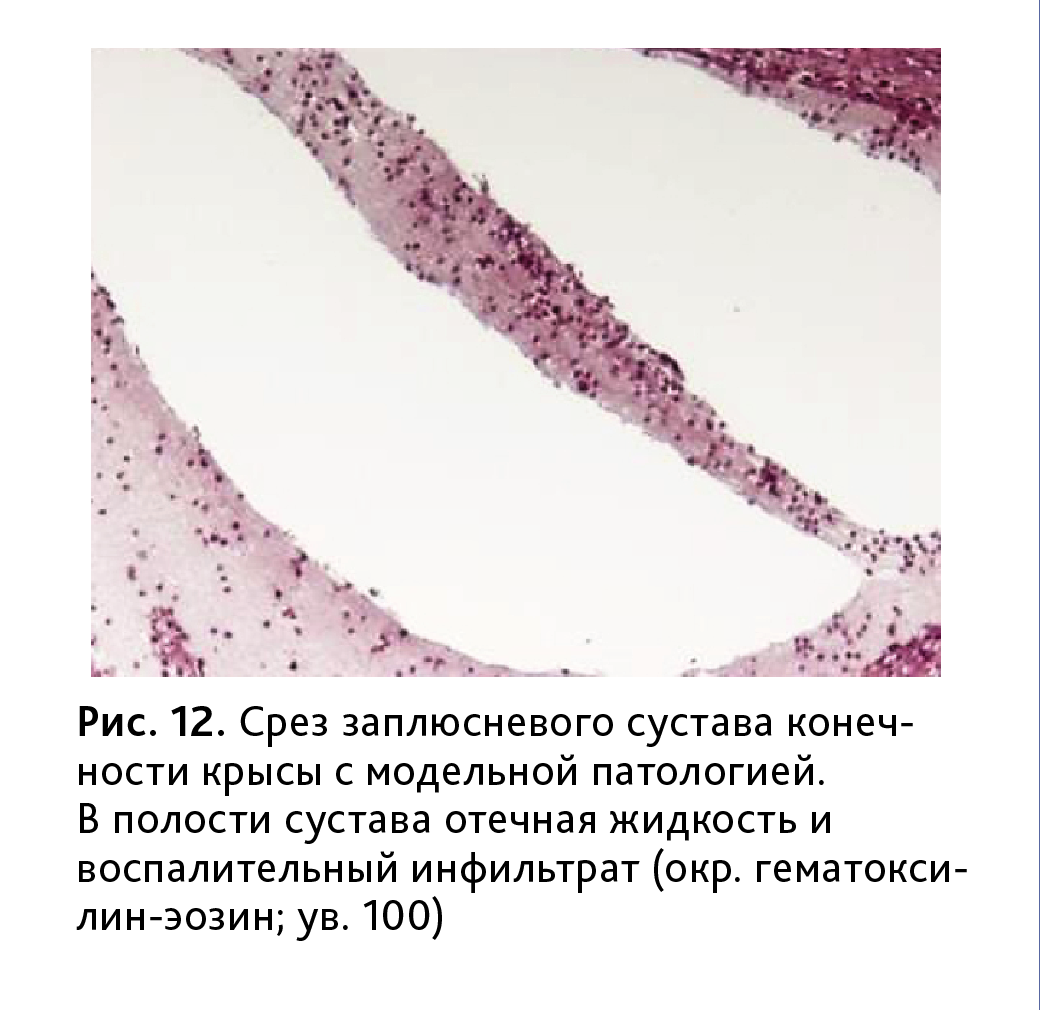
В пораженных суставах имелись деформации хряща с повреждениями поверхностного слоя в виде неглубоких узур и трещин. В суставной полости выявлялись отечная жидкость, лейкоциты и десквамированные фрагменты синовиальной оболочки (рис. 12). Указанные изменения отмечались преимущественно в межфаланговых суставах, тогда как структуры заплюсневого сустава не были вовлечены в патологический процесс. Локализация патологии в области введения индуктора, на фоне выраженной воспалительной реакции в мягких тканях, очевидно, связана с развитием вторичного синовита, не носящего системный характер.
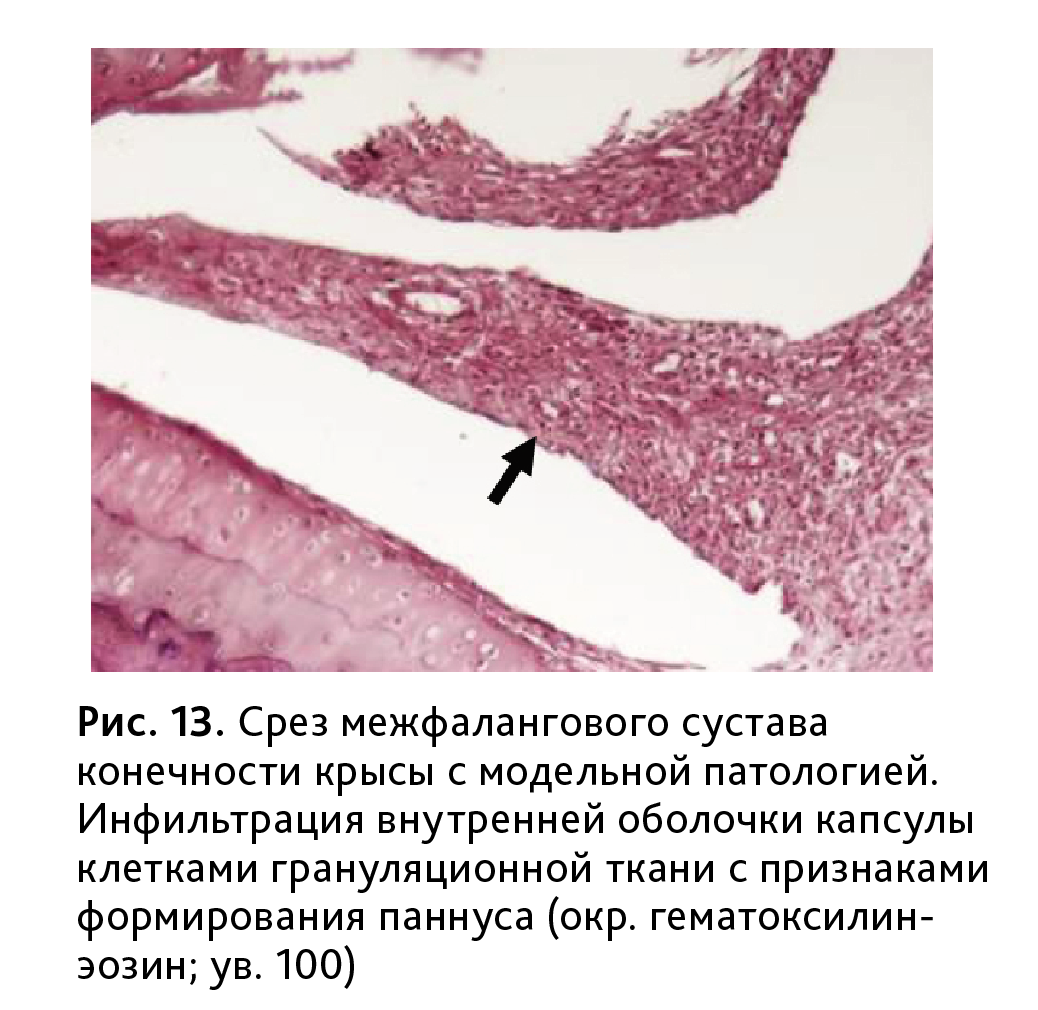
В суставной полости наблюдались небольшие оптически плотные образования, представленные связанными между собой клеточными элементами и бесструктурными массами, вероятно подвергающимися дальнейшему распаду или рассасыванию, с сохранением умеренной гиперплазии синовиоцитов, инфильтрации оболочки грануляционной тканью с признаками формирования внутрисуставного паннуса (рис. 13).
В табл. 1 представлены результаты полуколичественной оценки тяжести развития патологии при АИА и КИА индукции артрита адъювантом или каррагенином.
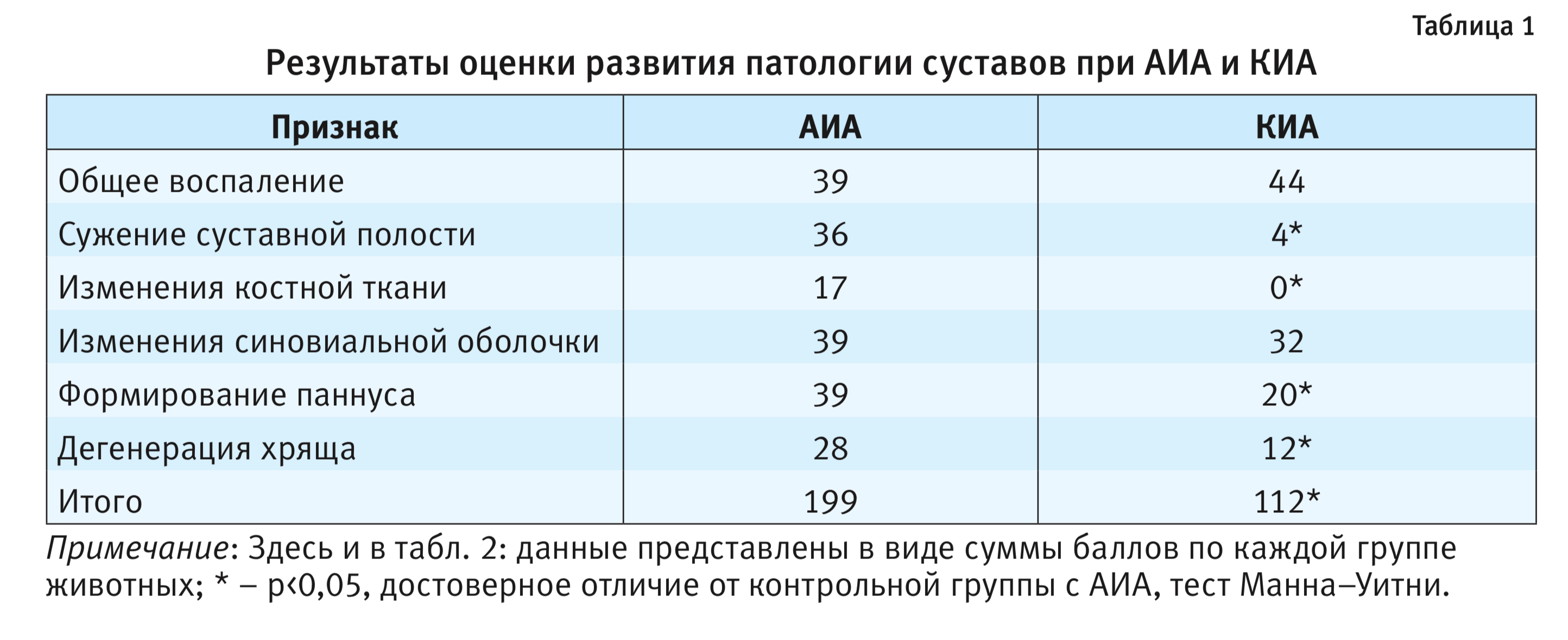
Действительно, АИА приводил к изменениям синовиальной оболочки, изменениям костной ткани (формирование новой костной ткани, остеолизис), формированию паннуса, что сопровождалось критическим сужением суставной полости, изменениями хрящевой ткани. В случае КИА воспалительный компонент был выражен несколько сильнее, однако остальные патологические признаки были выражены в меньшей степени, изменения костной ткани отсутствовали.
Состояние хряща более детально оценивалось по модифицированной шкале Mankin [11, 12] (табл. 2).
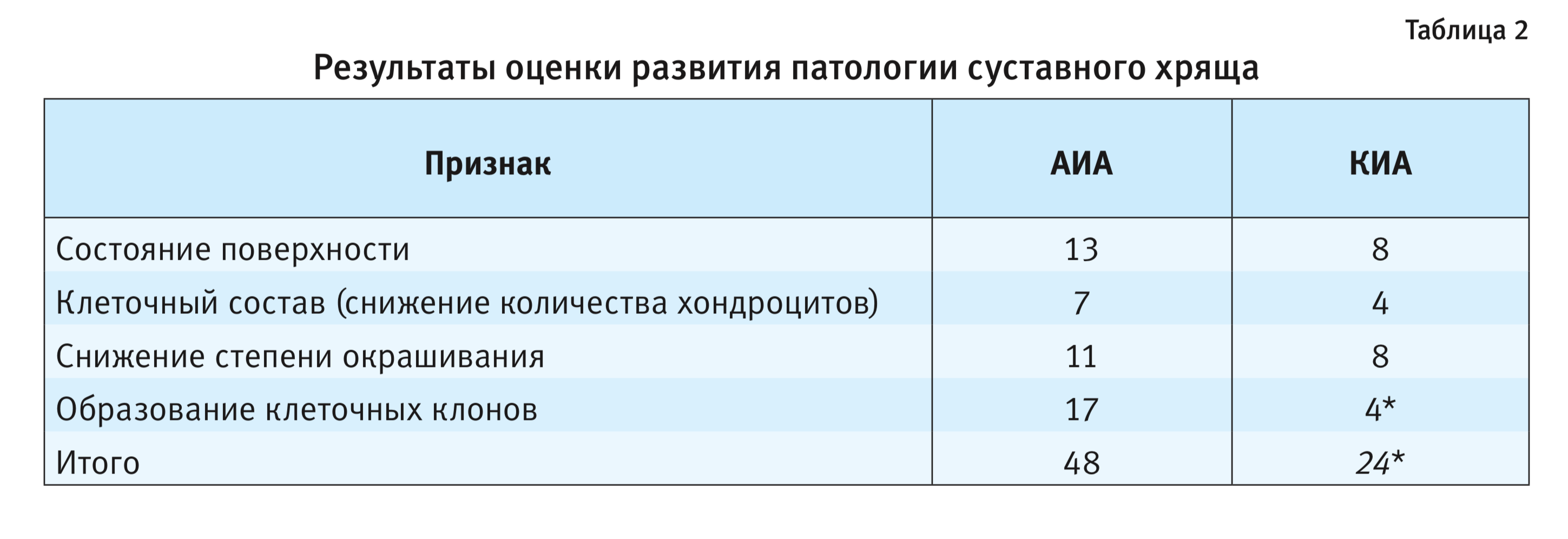
Наиболее выраженные патологические изменения хрящевой ткани наблюдались у животных с АИА. При введении каррагенина изменения хрящевой ткани в основном проявлялись в нарушении поверхности хряща, появлении неровностей (эрозий, узур или трещин), а также в незначительном снижении количества хондроцитов. Образование клеточных клонов (дуплетов, триплетов) было незначительным, в отличие от структуры хряща животных с АИА.
Заключение
Введение CFA крысам привело к развитию дегенеративных поражений суставного аппарата, характерных для РА. В ходе эксперимента у животных наблюдалось развитие отека и покраснения (эритема) околосуставных тканей, отек развивался уже в течение 1 сут после введения адъюванта, что характеризует присутствие острого воспалительного процесса. Отечность конечности, развивающаяся в результате накопления жидкости в тканях, окружающих сустав (эдема) [13], в той или иной степени сохранялась на протяжении 29 дней эксперимента.
К концу 2-й недели после введения адъюванта у большинства животных (80%) стали проявляться признаки артрита, а именно деформация конечностей, в основном в области межфаланговых суставов, приблизительно у 25% животных наблюдалась генерализация патологического процесса, затрагивающая суставы контралатеральной задней лапы и/или суставов передних лап и/или суставов в основании хвоста (данные не представлены). Временные характеристики развития экспериментального артрита соответствовали данным литературы. Так, очевидные клинические признаки адъювантного артрита наблюдают с 9–10-го [14] по 14-й [10, 15] день после введения адъюванта.
При КИА выявлены явно выраженные признаки воспаления непосредственно после введения индуктора, воспаление затрагивало только инъецированную конечность, генерализация процесса отсутствовала (данные не представлены). Воспалительная реакция имела место у всех животных, степень выраженности воспаления, однотипная у всех животных, с незначительными вариациями, оценивалась в баллах по результатам клинического наблюдения.
Гистопатоморфологическое исследование подтвердило наличие изменений суставного аппарата различной степени тяжести, характерных для РА при введении адъюванта. Изменения проявлялись прежде всего усиленной пролиферацией синовиоцитов, гиперплазией, отечностью и утолщением синовиальной оболочки. У всех животных в разной степени выраженности отмечался паннус, образованный активно пролиферирующей грануляционной тканью, врастающей в субинтимальную оболочку фиброваскулярного слоя синовии. В тяжелых случаях отмечалось истончение и обеднение клетками хрящевой ткани, с очагами пролиферации, встречающееся часто при сужении суставного пространства, вызванного главным образом поражением околосуставного аппарата. У таких животных обнаруживались также субхондральные кисты и очаги остеопороза. Снижалась степень окрашивания хряща, указывающая на деструктивные изменения межклеточного матрикса, границы между слоями были размыты. Однако изменения хряща были относительно невелики по сравнению с другими патологическими изменениями суставного аппарата, что характерно для РА [14].
Однако гистологическое исследование при моделировании КИА показало развитие у животных преимущественно воспалительного процесса, который затрагивал суставы, непосредственно прилегающие к месту инъекции индуктора. Фиксировали признаки вторичного подострого синовита межфаланговых суставов стопы с умеренными повреждениями суставного хряща.
Таким образом, введение в плантарную поверхность лапы крысы как адъюванта, так и каррагенина приводило к незамедлительному развитию местной воспалительной реакции и повреждению суставов. Однако дальнейшее развитие патологического процесса, вызванного введением адъюванта, приводило к распространению патологического процесса на суставы, удаленные от места введения индуктора, при этом характер повреждения суставов был схож с наблюдаемым при развитии РА в клинике. Введение каррагенина приводило к воспалительным процессам околосуставного пространства и незначительному повреждению хрящевой ткани суставов. Характер повреждения предлежащих к месту инъекции каррагенина суставов в большей степени отражал картину острого синовита и острого артрита. При подходе к выбору экспериментальной модели артрита следует руководствоваться фармакологическим профилем исследуемых веществ.
Список источников
- Scott D. L., Wolfe F., Huizinga T. W. Rheumatoid arthritis. Lancet. 2010. T. 376; 9746: 1094–108.
- Зинчук И. Ю., Амирджанова В. Н. Социальное бремя ревматоидного артрита. Научно-практическая ревматология. 2014. T. 52; 3: 331–5.
- Joseph A., Brasington R., Kahl L., Ranganathan P., Cheng T. P., Atkinson J. Immunologic rheumatic disorders. J. Allergy Clin. Immunol. 2010. T. 125; 2. Suppl 2: 204–15.
- Hansra P., Moran E. L., Fornasier V. L., Bogoch E. R. Carrageenan-induced arthritis in the rat. Inflammation. 2000. T. 24; 2: 141–55.
- Hegen M., Sun L., Uozumi N., Kume K., Goad M. E., Nickerson-Nutter C. L., Shimizu T., Clark J. D. Cytosolic phospholipase A2alpha-deficient mice are resistant to collagen-induced arthritis. J. Exp. Med. 2003. T. 197, 10: 1297–302.
- Vinegar R., Truax J. F., Selph J. L., Johnston P. R., Venable A. L., McKenzie K. K. Pathway to carrageenan-induced inflammation in the hind limb of the rat. Fed Proc. 1987. T. 46, 1: 118–26.
- Bartlett R. R., Schleyerbach R. Immunopharmacological profile of a novel isoxazol derivative, HWA 486, with potential antirheumatic activity--I. Disease modifying action on adjuvant arthritis of the rat. Int. J. Immunopharmacol. 1985. T. 7, 1: 7–18.
- Blackham A., Burns J. W., Farmer J. B., Radziwonik H., Westwick J. An X-ray analysis of adjuvant arthritis in the rat. The effect of prednisolone and indomethacin. Agents Actions. 1977. T. 7, 1: 145–51.
- McCaffrey G., Staatz W.D., Sanchez-Covarrubias L., Finch J. D., Demarco K., Laracuente M. L., Ronaldson P. T., Davis T. P. P-glycoprotein trafficking at the blood-brain barrier altered by peripheral inflammatory hyperalgesia. J Neurochem. 2012. T. 122, № 5: 962–75.
- Hegen M., Keith J. C., Jr., Collins M., Nickerson-Nutter C. L. Utility of animal models for identification of potential therapeutics for rheumatoid arthritis. Ann. Rheum. Dis. 2008. T. 67, 11: 1505–15.
- Chang T. K., Huang C. H., Huang C. H., Chen H. C., Cheng C. K. The influence of long-term treadmill exercise on bone mass and articular cartilage in ovariectomized rats. BMC. Musculoskelet. Disord. 2010. T. 11: 185.
- Mankin H. J., Dorfman H., Lippiello L., Zarins A. Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips. II. Correlation of morphology with biochemical and metabolic data. J Bone Joint Surg Am. 1971. T. 53; 3: 523–37.
- Whitehouse M. W. Adjuvant arthritis 50 years on: The impact of the 1956 article by C. M. Pearson, ‘Development of arthritis, periarthritis and periostitis in rats given adjuvants’. Inflamm. Res. 2007. T. 56% 4: 133–8.
- Bendele A., McComb J., Gould T., McAbee T., Sennello G., Chlipala E., Guy M. Animal models of arthritis: relevance to human disease. Toxicol. Pathol. 1999. T. 27; 1: 134–42.
- Fitzpatrick L. R., Green C., Frauenhoffer E. E., French K. J., Zhuang Y., Maines L. W., Upson J. J., Paul E., Donahue H., Mosher T. J., Smith C. D. Attenuation of arthritis in rodents by a novel orally-available inhibitor of sphingosine kinase. Inflammopharmacology. 2011. T. 19; 2: 75–87.



