Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши . Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-08
Резюме
В статье представлены результаты изучения и анализа референсных интервалов биохимических показателей крови мышей – одной из ключевых тест-систем, используемых на доклиническом этапе исследования лекарственных веществ. Данные получены в центре АО «НПО «Дом Фармации» в период с января 2018 г. по декабрь 2019 г. в ходе мониторинга здоровья животных. В проанализированном массиве находились данные от 100 самцов и 100 самок (небеременные и нерожавшие). В период адаптации и последующих экспериментов животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26оС, относительная влажность 40–75%, 12-часовой световой день. Кормление мышей проводили в соответствии с директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) и в соответствии с правилами надлежащей лабораторной практики. Определение биохимических показателей для всех животных проводили в равных условиях с применением принятых в испытательном центре аналитических методов. В сыворотке крови мышей определяли следующие показатели: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин. Данные, представленные в статье, указывают на необходимость периодического пересмотра референсных интервалов у лабораторных животных, используемых в экспериментах. Кроме того, результаты, полученные в ходе исследования, подтверждают необходимость создания в каждом специализированном испытательном центре внутрилабораторных референсных интервалов не только для мышей, но и для каждого вида животных, применяемых в доклинических экспериментах, для более точной и детальной оценки клинического состояния исследуемых животных. Полученные референсные интервалы рассматриваемых показателей согласуются с аналогичными показателями из источников литературы, что косвенно свидетельствует об их надежности.
Введение
Этап доклинических исследований, направленный на оценку безопасности и изучение эффективности нового химического вещества [1, 2], является одним из наиболее важных при создании лекарственных средств. В связи с этим перспективность дальнейшего изучения свойств соединения будет зависеть от результатов, полученных на данном этапе исследования. В настоящее время остаются нерешенными важные вопросы, возникающие при проведении доклинической стадии изучения и требующие решения [3]. Одним из необходимых и определяющих этапов является подтверждение правильности использования методик измерения и интерпретации клинических лабораторных тестов, применяемых для изучения эффективности потенциального лекарственного агента на биоматериале от животных, а также периодическое обновление референсных интервалов биохимических показателей крови, мочи и т.д. Таким образом, выполнение данной процедуры – обязательный этап, отражающий качество работы клинической лаборатории и правильной интерпретации полученных результатов исследования [4].
Наиболее часто используемой тест-системой в доклинических исследованиях являются мыши [5]. Есть несколько моментов, связанных с этим аспектом: экономическая целесообразность – стоимость мышей относительно многих других лабораторных животных не требует больших денежных затрат, кроме того, их легко содержать. Они хорошо изучены, поэтому это сравнительно простая и понятная модель; эволюционно мышь близка к человеку, и ее эмбриональное развитие повторяет многие аспекты человеческого развития с точки зрения формирования структуры тела и активации генов [6]. Еще одним фактором является продолжительность жизни мыши – этот момент важен при оценке некоторых факторов, связанных с жизненным циклом в случае различных гериатрических исследований, с изменениями биохимических и иных показателей крови, мочи и др. Именно поэтому беспородных мышей и их биологический материал в настоящее время продолжают использовать в самых разнообразных исследованиях особенно в области токсикологии и фармакологии, направленных на изучение широкого диапазона свойств и активностей, таких как противоопухолевая [7], противодиабетическая [8], анксиолитическая [9], антидепрессивная [10] и др.
Важность и необходимость применения мышей в качестве тест-системы в доклинических исследованиях указывает на важность правильной интерпретации биохимических показателей крови животных, участвующих в эксперименте, которые указывают на нормальную работу внутренних органов и систем [6]. Для определения наличия либо отсутствия какого-либо патологического процесса (изменения биохимических показателей) у лабораторных животных необходимо иметь представление о вариабельности изучаемых показателей в данной популяции животных, т.е. о значениях референсных интервалов [11].
Цель работы – установить референсные интервалы у мышей – одной из самых востребованных тест-систем [6] для оценки основных биохимических показателей, используемых в доклинических исследованиях, и сделать анализ частоты статистических выбросов для этих показателей.
Материал и методы
Данные получены в АО НПО «Дом Фармации» в период с января 2018 г. по декабрь 2019 г. в ходе мониторинга здоровья животных. Использованы животные интактных групп, возраст самцов и самок аутбредных мышей составлял 2–3 мес, масса тела – 25,3±3,8 г. В проанализированном массиве находились данные от 100 самцов и 100 самок (небеременные и нерожавшие). В период адаптации и последующих экспериментов животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26оС, относительная влажность 40–75%, 12-часовой световой день. Кормление мышей проводили в соответствии с директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) и в соответствии с правилами надлежащей лабораторной практики. Определение биохимических показателей для всех животных проводили в равных условиях с использованием общепринятых аналитических методов. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) определяли следующие показатели: креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), холестерин (ХС), триглицериды (ТГ), общий белок, альбумин, глюкоза и общий билирубин (ОБ). Концентрацию ОБ определяли с помощью набора реактивов (Вектор-Бест, Россия), для определения уровня остальных аналитов использовали биохимические наборы (BioSystems, Испания). Статистическую обработку осуществляли с использованием пакета программ Statistica10.0 (StatSoft, Россия), статистические выбросы оценивали с помощью метода Тьюки, вид распределения определяли с помощью критерия Шапиро–Уилка, сравнение между животными разного пола проводили с применением U-критерия Манна –Уитни.
Результаты и обсуждение
Показатели, полученные в ходе мониторинга здоровья животных, были подвергнуты статистической обработке. Из общего массива данных были исключены статистические выбросы (СВ) для устранения аномальных значений, которые определяли отдельно для каждого рассмотренного показателя и пола по методу Тьюки. Были исключены данные, лежащие за пределами интервала Q3 и Q1 (1-го и 3-го квартилей). Межквартильный интервал IQR определяли как Q3–Q1. Верхний и нижний пределы рассчитывали следующим образом [2]:
\[Q1–1,5•IQR~~и~~Q3+1,5•IQR \]
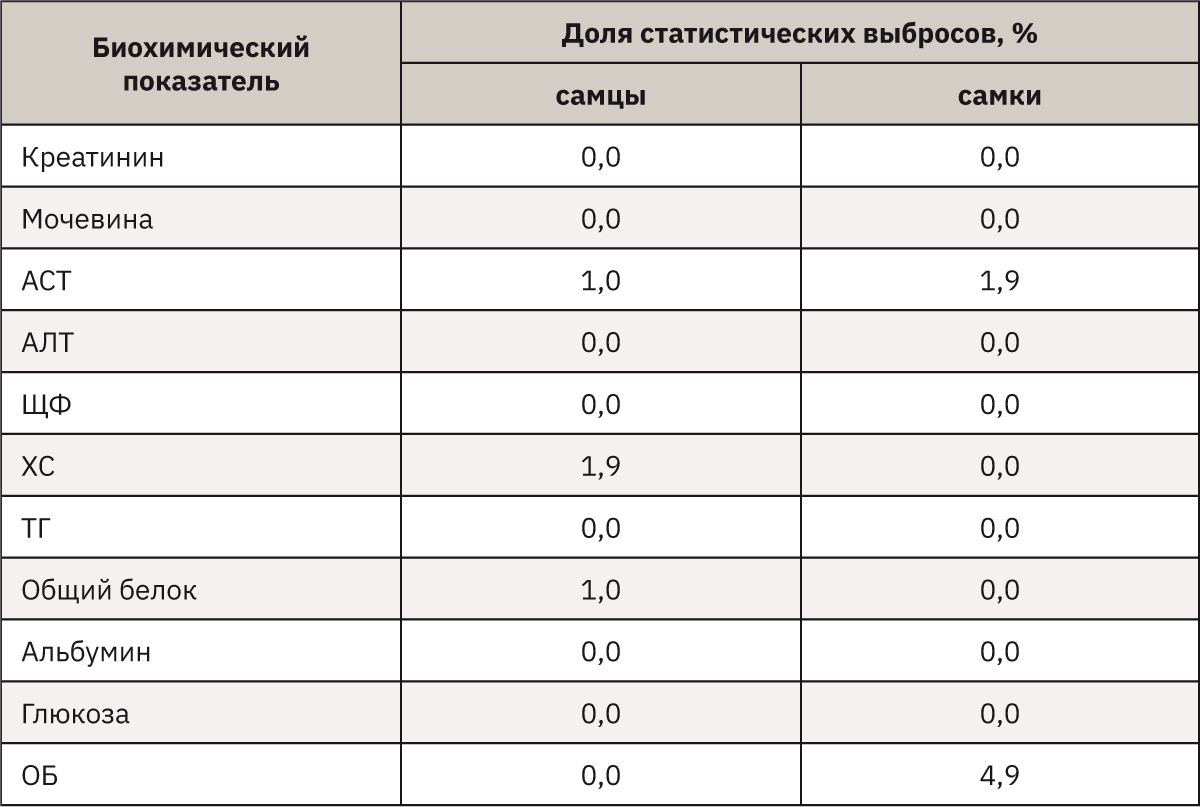
Данные о доле статистических выбросов по каждому показателю и выходящих за пределы референсных интервалов (РИ) представлены в табл. 1. Наиболее частые СВ при анализе сыворотки крови мышей отмечали в отношении ОБ (4,9%) и АСТ (1,9%) у самок, а также ХС (1,9%) у самцов.
Референсные интервалы для полу-ченных результатов в зависимости от вида их распределения рассчитывали следующим образом:
Хср.±1,96•SD – для нормального распределения;
2,5–97,5 процентили (‰) – для ненормального распределения (табл. 2).
Вид распределения определяли по критерию Шапиро–Уилка. Дополнительно проводили сравнение между животными разного пола методами непараметрической статистики для ненормального распределения (U-критерий Манна–Уитни) и методами параметрической статистики для нормально распределенных данных (t-критерий Стьюдента).
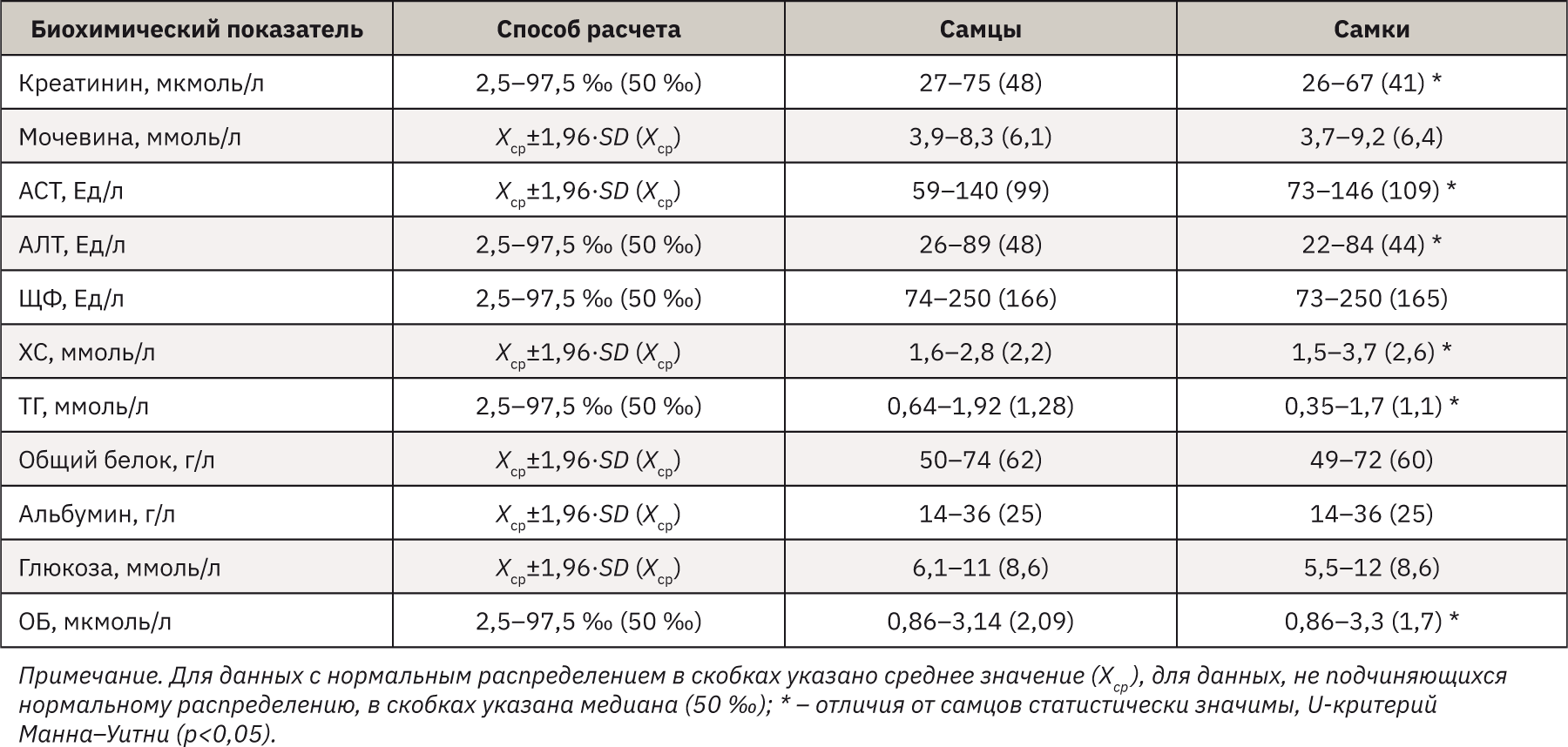
В ходе исследования выявлено, что средняя концентрация креатинина в сыворотке крови самцов может достигать более высоких значений, чем у самок (р<0,05). Данное соотношение креатинина также характерно для мужчин и женщин: 62−132, 44−97 мкмоль/л соответственно [13, 14]. Содержание внутриклеточного фермента АЛТ статистически выше в сыворотке самцов мышей (р<0,05). В норме АЛТ у мужчин составляет до 41 Ед/л, у женщин – до 31 Ед/л [13], т.е. наблюдается схожая тенденция между двумя организмами. При анализе уровня ХС установлено значимое повышение показателя в крови самок (р<0,05), хотя у человека этот показатель в норме одинаков как для мужчин, так и для женщин – 3,1–5,2 ммоль/л. Полученный уровень ТГ у самцов-мышей статистически выше, чему у самок (р<0,05). Примечательно, что РИ рассматриваемого показателя коррелирует и с нормами у человека, а повышение ТГ у мужчин относительно женщин также может наблюдаться после 20-летнего возраста – 0,55–3,21 и 0,43–1,21 ммоль/л соответственно [13, 14]. Установлено, что концентрация ОБ в сыворотке самцов значимо выше относительно самок (р<0,05). При использовании параметрической статистики показано, что значение АСТ в крови самок-мышей статистически выше, чем у самцов. У людей наблюдается обратная картина – концентрация данного фермента у мужчин превышает его количество у женщин. При рассмотрении полученных показателей мочевины, ЩФ, общего белка, альбумина и глюкозы статистической разницы не зарегистрировано.
Выявленные данные указывают на схожесть двух биологических систем (мышь и человек) по некоторым биохимическим показателям, что еще раз подтверждает важность и необходимость правильной работы клинической лаборатории в доклинических экспериментах, а также периодического пересмотра референсных интервалов используемых животных.
При анализе данных литературы, направленных на изучение биохимических показателей мышей (табл. 3), и сопоставление их с полученными значениями настоящего исследовании показало, что рассчитанные диапазоны РИ сопоставимы с аналогичными, указанными в литературе, но присутствуют и расхождения. Так, уровень АСТ у самок превышает аналогичный публикационный пример – 46–79 Ед/л [15, 17]. Референсный интервал ЩФ шире представленных значений в литературе – 51–134 Ед/л [15]. Стоит отметить, что данные отличия могут быть обусловлены множеством различных независимых друг от друга факторов – возрастными особенностями, условиями содержания, стрессоустойчивостью отдельно взятого животного, индивидуальными особенностями, сезонностью исследования, аналитическими методами. По результатам сравнения РИ, полученных в исследовании, с показателем источников литературы [6, 11, 15–17] можно сделать вывод о сопоставимости данных, что косвенно свидетельствует об их степени достоверности.
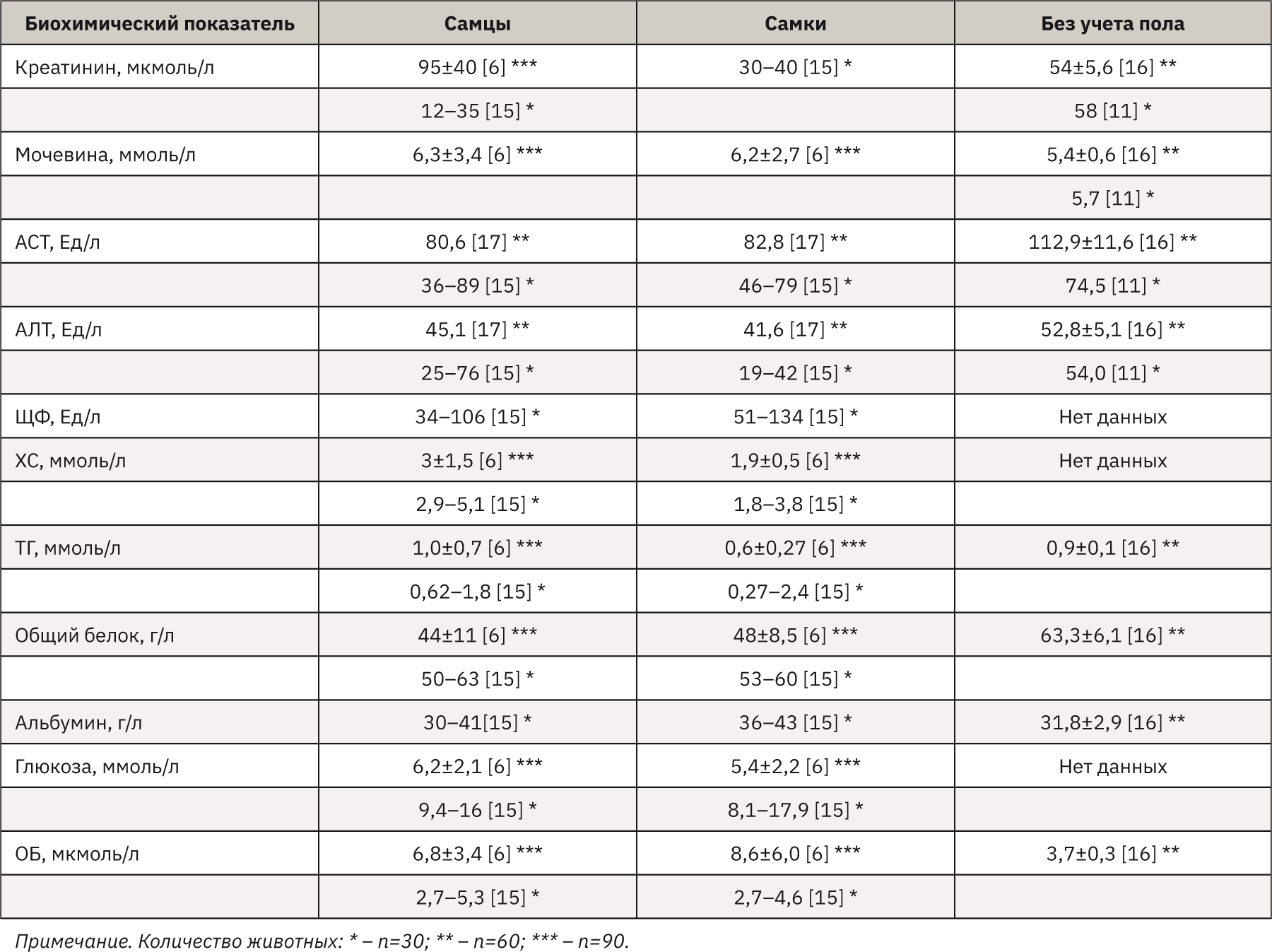
Значения, полученные в ходе исследования, подтверждают необходимость создания в каждом специализированном испытательном центре внутрилабораторных баз данных РИ не только для мышей, но и для каждого вида животных, применяемых в доклинических экспериментах, для более точной и детальной оценки клинического состояния исследуемых животных.
Известно, что в состоянии здоровья полученные результаты исследования нестатичны и непостоянны, испытывают колебания, амплитуда и ритм которых отражают его связь с некоторыми физиологическими процессами, называемыми внутрииндивидуальной биологической вариацией (CVi). В популяции индивидуальные амплитуды вариации могут не совпадать, отражая различия между здоровыми индивидуумами. Поэтому суммарные пределы вариации аналита для данной популяции –межиндивидуальная вариация (CVg) – всегда шире пределов внутрииндивидуальной вариации. Для каждого исследуемого показателя были рассчитаны коэффициенты вариации (CV=SD/Хср.•100%), что в грубом приближении соответствует межиндивидуальной вариабельности (CVg) этих показателей в человеческой популяции. Сравнительные данные по 2 видам приведены в табл. 4.
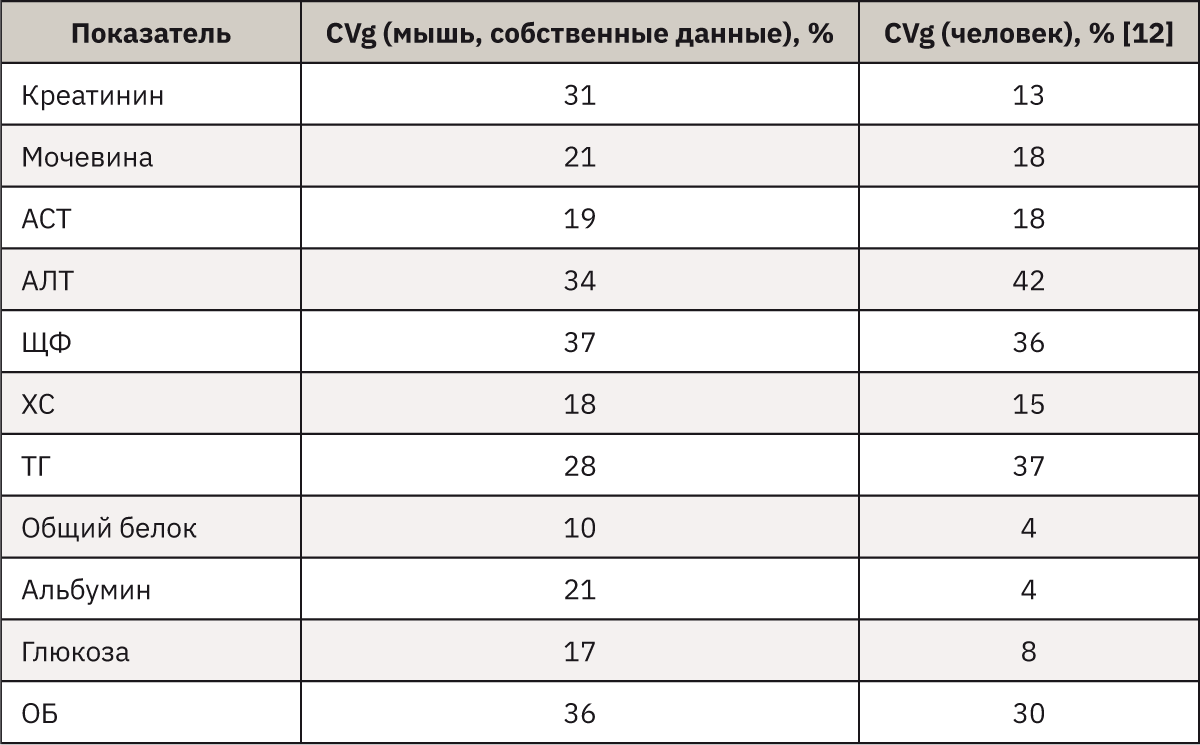
При анализе полученных данных можно отметить сходную с человеком вариабельность по большинству исследованных показателей. Так, полученные значения межиндивидуальной вариации ЩФ, мочевины, АСТ, АЛТ, ХС и ОБ мышей сопоставимы с таковыми человека. Однако в то же время показатели CVg креатинина, глюкозы, альбумина и общего белка мышей более чем в 2 раза превышают значения для человека, а уровень триглицеридов на треть меньше. Полученная картина может быть связана как с видовыми особенностями, так и с методами измерения, что свидетельствует о целесообразности обязательного установления и планового пересмотра референсных интервалов.
Заключение
Данные, представленные в статье, указывают на необходимость периодического пересмотра референсных интервалов лабораторных животных, используемых в экспериментах, а также подтверждают важность качественной оценки лабораторной диагностики доклинического этапа исследований. Полученные референсные интервалы рассматриваемых показателей коррелируют и соотносятся с аналогичными показателями из источников литературы, что подтверждает их достоверность. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови мышей и человека демонстрирует наличие видовых различий особенно для показателей, которые необходимо учитывать при рассмотрении результатов доклинических исследований.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Мирошников М.В. – сбор и систематизация материала, статистическая обработка данных, анализ и интерпретация результатов, написание, редактирование текста.
Макарова М.Н. – идея, согласование окончательной версии статьи.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- José M., Edelman E.R. From nonclinical research to clinical trials and patient-registries: challenges and opportunities in biomedical research // Revista Española de Cardiología (English Edition). – 2017. – P. 70. – №. 12. – P. 1121-1133. doi: 10.1016/j.rec.2017.07.008.
- Войтенко Н.Г., Макарова М.Н., Ковалева М.А. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 2: кролики //Лабораторные животные для научных исследований. – 2020. – №. 2. – С. 3-10. [Voitenko N.G., Makarova M.N., Kovaleva M.A. Variability of blood biochemical parameters and establishment of reference intervals in preclinical studies. Part 2: Rabbits // Laboratory animals for scientific research. – 2020. – №. 2. – P. 3-10. (In Russ.)].
- Andrade E.L., Bento A.F., Cavalli J. Non-clinical studies in the process of new drug development-Part II: Good laboratory practice, metabolism, pharmacokinetics, safety and dose translation to clinical studies // Brazilian journal of medical and biological research. – 2016. – Vol. 49. – P. 1-19. doi: 10.1590/1414-431X20165646.
- Васильев А.Н., Ниязов Р.Р., Гавришина Е.В. Драницына М.А., Куличев Д.А. Проблемы планирования и проведения доклинических исследований в Российской Федерации //Ремедиум. Журнал о российском рынке лекарств и медицинской технике. – 2017. – №. 9. – С. 6-19.[ Vasil'ev A.N., Niyazov R.R., Gavrishina E.V. Dranitsyna M.A., Kulichev D.A. Problems of planning and conduct of preclinical trials in the russian federation//Remedium. Zhurnal o rossijskom rynke lekarstv i medicinskoj tekhnike. – 2017. – №. 9. – P. 6-19 (In Russ.)].
- Mazzaccara C., Labruna G., Cito G. Age-related reference intervals of the main biochemical and hematological parameters in C57BL/6J, 129SV/EV and C3H/HeJ mouse strains // PloS one. – 2008. – V. 3. – №. 11. – P. e3772. doi: 10.1371/journal.pone.0003772
- Quimby F.W., Luong R.H. Clinical chemistry of the laboratory mouse // The mouse in biomedical research. – 2007. – P. 171-216.
- Комарова Е.Ф., Коробейникова Е. П., Ванжа Л. В. Оценка противоопухолевой активности фармацевтической субстанции эноксифол на модели экспериментальной опухоли легкого // Злокачественные опухоли. – 2017. – №. Спецвыпуск 1. [Komarova E F., Korobeynikova E.P., Vanzha L.V, Ocenka protivoopuholevoj aktivnosti farmacevticheskoj substancii enoksifol na modeli eksperimental'noj opuholi legkogo //Zlokachestvennye opuholi. – 2017. – №. Specvypusk 1. (In Russ.)].
- Спасов А.А., Косолапов В.А., Бабков Д.А. Активаторы глюкокиназы-перспективный класс противодиабетических средств // Проблемы эндокринологии. – 2018. – Т. 64. – №. 3. – С. 180-187. [Spasov A.A., Kosolapov V. A., Babkov D.A. Glucokinase activators – a promising class of antidiabetic drugs//Problems of endocrinology. – 2018. – Vol. 64. – №. 3. – P. 180-187. (In Russ.)].
- Maltsev D.V., Spasov A.A., Yakovlev D.S. Searching for new anxiolytic agents among derivatives of 11-dialkylaminoethyl-2, 3, 4, 5-tetrahydrodiazepino [1, 2-a] benzimidazole // European Journal of Pharmaceutical Sciences. – 2021. – Vol. 161. – P. 105792.
- Спасов А.А., Мальцев Д.В., Мирошников М.В. Антидепрессивная активность и потенциальные механизмы действия производного диазепинобензимидазола ДАБ-19 // Экспериментальная и клиническая фармакология. – 2020. – Т. 83. – №. 4. – С. 31-36. [Spasov A.A., Mal'tsev D.V., Miroshnikov M.V. The antidepressant activity of diazepinobenbenzimidazole derivative dab-19 and its potential mechanisms of action // Problems of endocrinology. – 2018. – Vol. 64. – №. 3. – P. 180-187 (In Russ.)].
- Titlow W.B., Lee C.H., Ryou C. Characterization of toxicological properties of L-lysine polymers in CD-1 mice // Journal of microbiology and biotechnology. – 2013. – Vol. 23. – №. 7. – P. 1015-1022.
- ГОСТ Р 53022.2-2008. Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) М., 2008. [GOST R 53022.2-2008 Tekhnologii laboratornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast’ 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost’, chuvstvitel’nost’, specifichnost’) M., 2008. (In Russ.)].
- Кишкун, А.А. Руководство по лабораторным методам диагностики / Москва :ГЭОТАР-Медиа, 2009. – 800 с. [Kishkun A. A. Guide to laboratory diagnostic methods: for doctors and paramedics providing the first medical aid. Help / Moscow - GEOTAR-media, 2009.-800 p. (In Russ.)].
- Лифшиц В.М., Сидельникова В.И. Биохимические анализы в клинике / Москва: ООО" Издательство" Триада", 2006. – С. 216 [Lifshits V. M., Sidelnikova V. I. Biochemical analyses in the clinic. / Moscow " Publishing House "Triada", 2006. – p. 216 (in Russ.)].
- Serfilippi L.M., Pallman D.R., Russell B. Serum clinical chemistry and hematology reference values in outbred stocks of albino mice from three commonly used vendors and two inbred strains of albino mice // Journal of the American Association for Laboratory Animal Science. – 2003. – Vol. 42. – №. 3. – P. 46-52.
- Аледо М.М., Калганов С.А. Биохимические показатели крови мышей при введении в рацион ГМ-кукурузы //В мире научных открытий: материалы III Международной студенческой научной конференции. 22-23 мая 2019 г.-Ульяновск: УлГАУ, 2019.-Т. V, Ч. 1. – УлГАУ, 2019. [Aledo M.M., Kalganov S.A., Karmeeva Y.S. Biochemical indicators of laboratory mice blood when feeding them gm-corn // V mire nauchnyh otkrytij: materialy III Mezhdunarodnoj studencheskoj nauchnoj konferencii. 22-23 maya 2019 g.-Ul'yanovsk: UlGAU, 2019.-T. V, CH. 1. – UlGAU, 2019. (In Russ.)].
- Charles River Information. CD-1 IGS Mouse Model Information Sheet. – 2013. – URL.: https://www.criver.com/sites/default/files/resources/ (дата обращения 06.2021 г.)



