Модели грибковых инфекций на животных
Боровкова К.Е., Макарова М.Н. , Никифорова Л.Р., Салмова Ю.В. Модели грибковых инфекций на животных. Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-05
Резюме
С каждым годом количество инфекций, вызванных микроскопическими грибами, растет из-за повышения резистентности к различным противогрибковым препаратам и увеличения числа людей с ослабленной иммунной системой. Исследования на животных позволяют изучить патогенез, иммунологические реакции организма на грибковую инфекцию, тестировать новые противогрибковые соединения и многое другое. Наибольшее количество моделей грибковых инфекций связано с дерматофитами, кандидой и аспергиллами, так как они являются возбудителями большинства грибковых инфекций человека. В экспериментальных моделях используют различные виды животных от мелких грызунов до крупного рогатого скота. Наиболее предпочтительными животными, используемыми в исследованиях in vivo, являются мыши. Данный вид животных имеет ряд преимуществ, таких как большое разнообразие линий, небольшая стоимость, а также простота в содержании и удобство при проведении манипуляций. Однако этот вид животных подходит не для всех исследований. Например, морских свинок часто используют для тестирования противогрибковых соединений, применяемых против дерматофитов, так как строение их кожи близко к таковому у человека. При выборе вида животного необходимо учитывать тот факт, что большинство животных являются устойчивыми к возбудителям человеческих инфекций. Для того чтобы вызвать устойчивую инфекцию, у животных, как правило, подавляют иммунитет. Также при планировании исследования, кроме выбора животных и возбудителя, необходимо учитывать способы заражения и концентрацию возбудителя. Для формирования развития инфекционного процесса необходимо использовать способ заражения, близкий к естественному пути заражения. Помимо исследований грибковых инфекций на лабораторных животных, используются альтернативные модели на беспозвоночных. Данные модели не могут полностью заменить исследования на млекопитающих, но они применяются в качестве дополнительных для расширения знаний о грибковом патогенезе, изучения вирулентности грибов, а также открытия новых противогрибковых соединений. Таким образом, при планировании исследования грибковых инфекций in vivo необходимо учитывать множество факторов для получения инфекционного процесса с клиническими признаками, близкими к человеку.
Введение
Грибковые инфекции (микозы) – заболевания кожи, ногтей, слизистых оболочек, внутренних органов, вызванные различными видами грибов. Тяжелыми или хроническими грибковыми заболеваниями ежегодно во всем мире болеет около 150 млн пациентов, в результате которых умирает примерно 1,7 млн человек в год [1, 2]. Количество грибковых инфекций за последнее время увеличилось, в частности, из-за роста числа лиц с иммунодефицитом или тех, кто проходит иммуносупрессивное лечение. Также стали чаще регистрироваться глубокие висцеральные микозы, ассоциированные с ВИЧ-инфекцией, онкогематологической патологией, пересадкой органов, выхаживанием новорожденных, при этом возросла роль грибов, считавшихся ранее апатогенными [3]. Еще одним немаловажным фактором, затрудняющим лечение, является развитие устойчивости грибов к лекарственным средствам. Таким образом, все это представляет серьезную глобальную угрозу, что приводит к необходимости выполнения различных исследований по противодействию грибковым инфекциям и поиску новых эффективных лекарственных средств.
Из примерно 1,5–5,0 млн видов грибов на Земле только несколько сотен вызывает заболевания у людей и лишь немногие из них способны поражать здоровых людей [4]. Эпидемиология грибковых инфекций во многом зависит от типа больных (новорожденные, пожилые люди и т.д.), экологии патогенных грибов и распространенности грибов в окружающей среде. Люди ежедневно подвергаются воздействию многочисленных потенциальных грибковых патогенов, которые являются комменсалами или присутствуют в окружающей среде, при вдыхании, проглатывании и контакте [5]. Для того чтобы гриб мог паразитировать на человеке, должно быть выполнено 4 условия:
- способность расти при температуре ≥37°C;
- возможность достигать тканей хозяина;
- способность переваривать и поглощать компоненты ткани человека;
- противостояние иммунной системе человека [4].
Классификация микозов
Грибы разделяют по форме на дрожжевые и нитчатые (плесневые) грибки. Дрожжи – это одноклеточные формы, которые размножаются почкованием, тогда как плесневые грибки образуют многоклеточные гифы. Грибы, имеющие более одной формы, называют диморфными. Диморфные грибы могут расти в виде дрожжей in vivo и in vitro при 37°C, а также, как и плесневые грибки, при 25°C. Диморфизм регулируется такими факторами, как температура, концентрация CO2, pH и уровень цистеина или других тиоловых соединений [6]. Более 600 видов грибов связано с болезнями, но <30 видов вызывает >99% инфекций. C 2013 г. международное общество LIFE (Leading International Fungal Education) собирает данные о грибковых инфекциях со всего мира. На портале LIFE предоставляется информация о грибках, грибковых инфекциях, диагностике и лечении. Согласно данным организации LIFE, большинство грибковых инфекций вызывается родами Trichophyton, Candida, Aspergillus и Cryptococcus. Также на их портале представлено разделение грибковых инфекций на 5 групп, в порядке уменьшения степени тяжести [7]:
1. Инвазивные грибковые инфекции, которые часто заканчиваются летальным исходом (криптококковый менингит, инвазивный аспергиллез, инфекция кровотока Candida, пневмоцистная пневмония).
2. Хроническая инфекция легких или глубоких тканей (хронический аспергиллез легких).
3. Аллергические грибковые заболевания (аллергический бронхолегочный аспергиллез, тяжелая астма с грибковой сенсибилизацией).
4. Инфекция слизистой оболочки (кандидоз полости рта и пищевода, кандидозный вагинит (молочница)).
5. Инфекция кожи, волос и ногтей (стригущий лишай, дерматомикоз, микоз стопы, онихомикоз).
В отечественной дерматологии пользуются классификацией Н.Д. Шеклакова (1976). В соответствии с ней выделяют 4 группы микозов и 5-ю группу так называемых псевдомикозов. К микозам относятся:
- кератомикозы (разноцветный лишай, пьедра, черепитчатый микоз);
- дерматомикозы (эпидермофития, микоз, обусловленный красным трихофитоном, трихофития, микроспория, фавус);
- кандидоз (поверхностный кандидоз кожи и слизистых оболочек и др.);
- глубокие микозы (кокцидиоидоз, криптококкоз и др.).
В группу псевдомикозов относят эритразму, нокардиоз и др. [8].
Наиболее часто грибковые инфекции классифицируют по клиническим проявлениям. Таким образом, грибковые инфекции подразделяют на поверхностные, подкожные, системные и оппортунистические микозы, что является наиболее простым и удобным вариантом классификации. На основании данных литературы [9–12] была составлена общая таблица микозов по клиническим проявлениям с указанием основных видов возбудителей грибковых инфекций (табл. 1).

В данной статье рассмотрим наиболее распространенные модели микозов, вызванных дерматофитами, кандидой и аспергиллами с использованием животных.
Модели дерматофитии
Дерматофития – это поверхностная грибковая инфекция, вызываемая нитчатыми грибами дерматофитами, которые проникают в ороговевшие ткани людей и животных. Дерматофиты представлены родами Epidermophyton, Microsporum и Trichophyton [13, 14].
Поражение дерматофитами кожи человека происходит в несколько этапов. На первом этапе артроконидии, образующиеся в результате фрагментации гиф в месте перегородок [15], прикрепляются к эпидермису хозяина через специализированные белки, присутствующие на поверхности грибов, а также выделяемые грибами протеазы, такие как субтилизин. На втором этапе – прорастание – артроконидии в благоприятных условиях инициируют реактивацию метаболической активности и их рост в гифы. Во время третьего этапа, называемого инвазией, гифы, образующиеся из прорастающих трубок, проникают в ороговевший слой эпидермиса, при этом переваривая кератин до небольших пептидов и аминокислот. Наконец, гифы начинают продуцировать новые артроконидии, которые высвобождаются локально, чтобы инфицировать новых хозяев или участки тела [16].
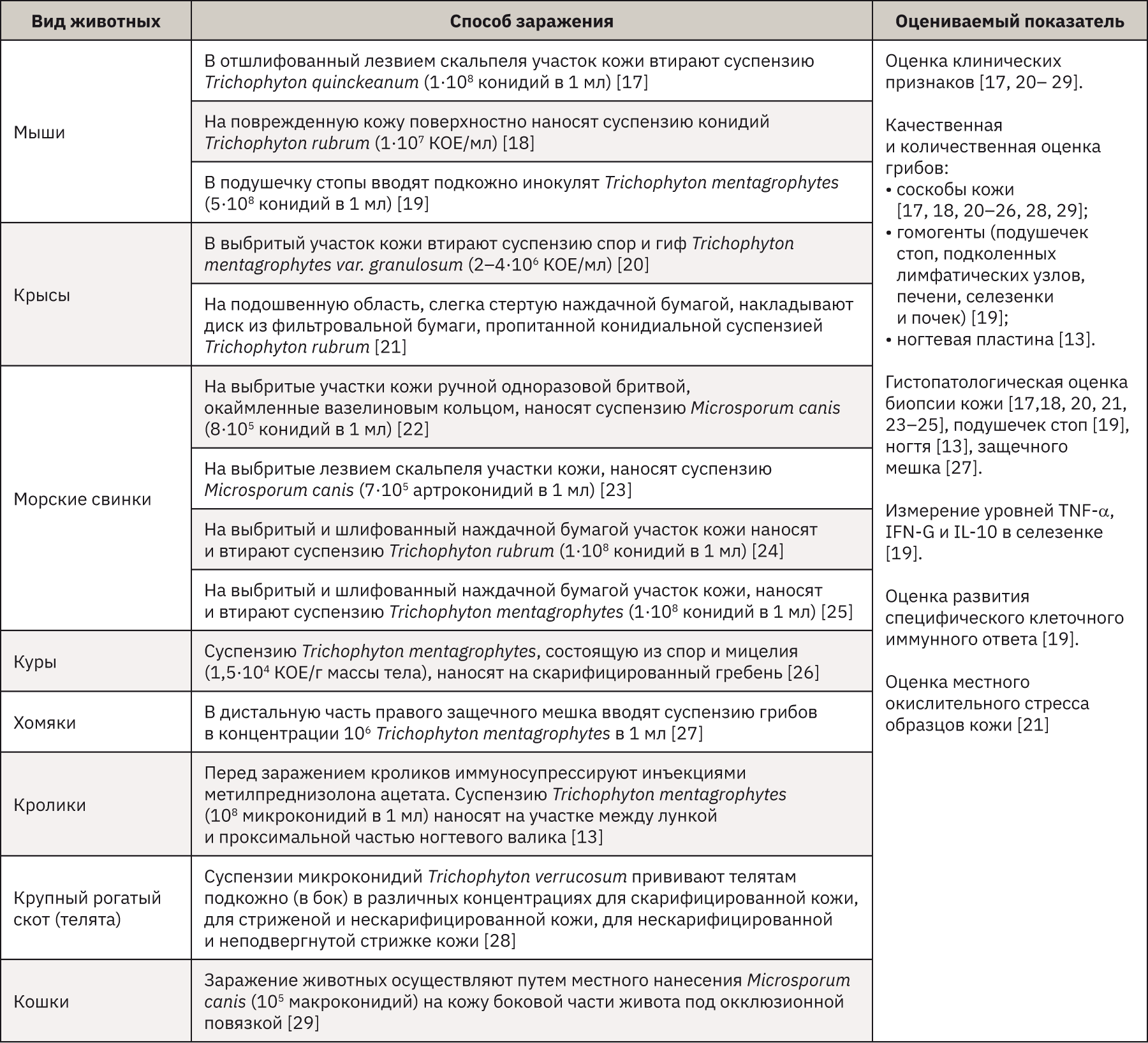
Для разработки экспериментальной модели дерматофитии применяют различные виды животных, которые обычно не являются естественными хозяевами для выбранного дерматофита. В экспериментальных моделях дерматофитии используют мышей [17–19], крыс [20, 21], морских свинок [22–25], кур [26], хомяков [27], кроликов [13], крупный рогатый скот [28], кошек [29]. Чаще всего в исследование берут мышей и морских свинок, так как с ними легко выполнять манипуляции, они относительно недорогие, восприимчивы к заражению дерматофитами, поэтому такие виды этически более приемлемы, чем мелкие домашние животные (кошки). Морских свинок чаще используют для оценки эффективности противогрибковых соединений против дерматофитов, так как кожа морских свинок близка по строению к коже человека. Модели на мышах более предпочтительны для изучения иммунного ответа, возникающего во время болезни [14, 30].
Большинство моделей дерматофитии на животных были получены с использованием зоофильных грибов (Trichophyton mentagrophytes или Microsporum canis), так как они являются более патогенными для лабораторных животных, чем антропофильные штаммы [14]. Во многих исследованиях для заражения животных используют инокулят, состоящий из конидий или смеси конидий и гифальных элементов. Некоторое количество экспериментов было выполнено с использованием артроконидий (артроспор). Конидии продуцируются исключительно in vitro на среде Сабуро, тогда как артроконидии – дерматофитами in vivo, это указывает на то, что среда имеет решающее значение для типа споруляции и роста гриба [16]. Однако посевной материал, состоящий из конидий, обычно предпочтительнее из-за длительности и сложности процедур, необходимых для получения артроконидий.
Очень важно в исследованиях на животных подобрать способ заражения в зависимости от целей исследования. В естественных условиях дерматофиты первоначально встречаются в ороговевшем слое кожи, поэтому лучше использовать надкожный способ инокуляции. В исследованиях с использованием животных без шерсти (например, у морских свинок [31]) были получены многообещающие результаты, но большинство исследований продолжают проводить на животных с шерстью, кожа которых была предварительно очищена от волос. Чтобы повысить восприимчивость к инфекции, кожу слегка повреждают путем бритья [22], эпиляции или с помощью лезвия скальпеля [17, 23], наждачной бумаги [20, 24, 25]. Помимо эпикутанного пути заражения, существую и другие способы инокуляции. Хотя дерматофиты лишь изредка поражают другие органы, кроме кожи и кожных придатков, некоторые авторы разработали экспериментальные модели системных дерматофитозов на животных [30].
Несмотря на обширное количество исследований дерматофитии на животных, возникает много трудностей в создании модели in vivo. Основные причины: у животных и людей разные структура кожи, иммунная система и возбудители инфекции, при этом грызуны обладают плохой восприимчивостью к антропофильным дерматофитам. Основные модели дерматофитии с использованием животных представлены в табл. 2.
Модели кандидоза
Кандидоз – одна из разновидностей грибковой инфекции, которая вызывается грибами рода Candida. Кандида – это диморфный гриб, который может существовать как в дрожжевой фазе (бластоспора, бластоконидии), так и в гифальной (мицелиальной). Candida размножается путем многостороннего почкования и может развиваться как мицелиальная форма, состоящая из длинных ветвящихся перегородок или нитей, либо как сферические или яйцевидные дрожжевые клетки [32].
Некоторые виды грибов Candida являются нормальными комменсалами кожи, слизистых оболочек, желудочно-кишечного тракта человека и других млекопитающих. Примерно из 100 известных видов Candida относительно немногие (12–14) вызывают инфекции у человека. Грибы Candida могут провоцировать широкий спектр заболеваний: от поверхностных инфекций (молочница и инфекции ногтевого ложа) до серьезных, опасных для жизни заболеваний (эндокардит, менингит, остеомиелит и кандидемия). Наиболее часто из клинических образцов, полученных от людей, выделяется Candida albicans в сочетании с другими видами: C. glabrata, C. parapsilosis, C. tropicalis, и C. krusei, они составляют примерно 99% всех человеческих заболеваний, связанных с кандидозом [33].
Наиболее распространенные виды животных, используемых для моделирования кандидоза, – мыши [34–39], крысы [40–43], морские свинки [44, 45] и кролики [46, 47]. Среди грызунов чаще всего в моделях кандидоза in vivo используют мышей. На таких моделях были изучены различные клинические формы Candida, включая инфекции слизистой оболочки полости рта [38, 39], влагалища [37, 39], желудочно-кишечного тракта [36, 39], глубокие и системные формы кандидоза [34, 39], которые были вызваны экспериментально у беспородных и инбредных линий мышей [48]. Большинство моделей кандидоза на животных получены с применением штаммов C. albicans. С целью имитации клинических ситуаций, близких к человеку, экспериментальные инфекции Candida могут быть вызваны не только у интактных мышей, но также у мышей с ослабленным иммунитетом путем предварительной обработки различными цитотоксическими агентами, такими как циклофосфамид [35, 38, 46, 49], 5-фторурацил [38], облучение [36] и др.
Однако не во всех опытах корректно использовать мышей. В фармакологических экспериментах метаболизм противогрибковых препаратов на мышах может отличаться от фармакокинетики или фармакодинамики, наблюдаемых у людей. На доклинических этапах исследования вориконазола обнаружено, что при введении мышам концентрации вориконазола в сыворотке были очень низкие и часто не определялись. Это было связано с быстрым метаболизмом при первом прохождении и быстрым клиренсом препарата при повторных дозах. В результате большая часть последующих работ с вориконазолом проведена на морских свинках [50, 51]. Основные модели кандидоза с использованием животных представлены в табл. 3.

Модели аспергиллеза
Аспергиллез – грибковая инфекция, передающаяся воздушно-капельным путем, вызываемая повсеместно распространенными сапрофитными плесневыми грибами, принадлежащими к роду Aspergillus [52]. Виды Aspergillus присутствуют в окружающей среде и ежедневно вдыхаются в виде конидиальных спор. Споры (конидии) легко проникают в альвеолы легких из-за небольшого размера. У здоровых людей конидии эффективно элиминируются макрофагами и нейтрофилами, у иммунокомпрометированных ингаляция конидий аспергиллов может привести к развитию инфекции, при этом происходит трансформация конидий (прорастание) в гифы, которые поражают ткань [53]. Инфекция, вызванная аспергиллезом, чаще всего возникает из-за A. fumigatus, A. flavus, A. terreus и A. niger, которые провоцируют клинически разные формы – аллергический бронхолегочный аспергиллез, аллергический грибковый риносинусит, хронический легочный аспергиллез, хронический некротический аспергиллез легких и первичный кожный аспергиллез [54, 55].
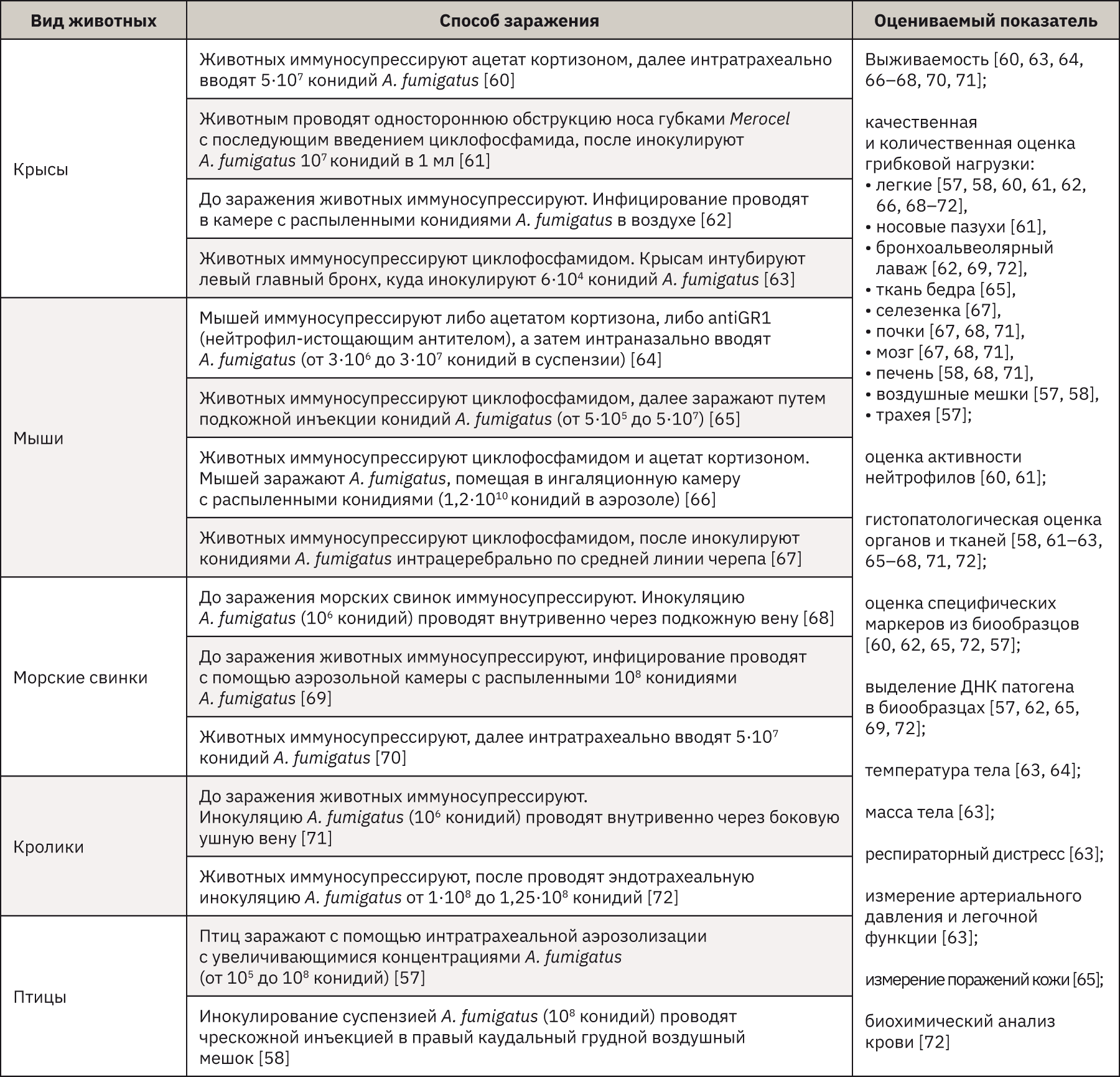
Различными исследователями было разработано множество моделей аспергиллеза на животных. В ветеринарии аспергиллез является важным заболеванием легких у птиц, в результате было разработано несколько моделей на птицах. Птицы – один из немногих видов, которые могут заразиться естественным путем при отсутствии иммуносупрессии. В целом в моделях использовались разные виды птиц – японские перепела [56], индюки [56, 57], куры [56, 58], возраст которых варьировал от вылупившихся птенцов до взрослых животных. Для заражения животных использовались как внутривенная инокуляция, так и легочные пути введения (интратрахеальный или аэрозольный). По большей части в исследованиях устанавливается быстро развивающееся заболевание со смертельным исходом уже через 2 дня после заражения [52, 59].
Эксперименты, проведенные для имитации болезней человека (или млекопитающих), основывались на моделях с использованием обычных видов лабораторных животных, таких как крысы [60–63], мыши [64–67], морские свинки [68–70], кролики [71, 72]. Данные виды животных использовались в исследованиях патогенеза, иммунного ответа, вирулентности и противогрибковой терапии. Большинство опытов проводилось на животных с ослабленным иммунитетом. Модели аспергиллеза на мышах являются предпочтительными для большинства исследователей, так как мыши демонстрируют сходство с людьми в органах и системах, биохимии и патологии. Однако по сравнению с кроликами и другими грызунами небольшой размер этого вида позволяет собирать небольшие объемы крови. Кроме того, маленький размер легких мышей может вносить вклад в иную кинетику по сравнению с людьми. При той же скорости роста грибка гораздо меньшее по размеру легкое мыши будет поражено быстрее, чем легкое человека, с возможными последствиями, касающимися вероятности гематогенного распространения [52, 59].
Низкая чувствительность и специфичность ограничивают современные методы диагностики аспергиллеза. Таким образом, в последних рекомендациях для повышения вероятности постановки точного диагноза рекомендуется одновременное использование нескольких тестов. Наличие роста Aspergillus при микробиологическом посеве не позволяет установить истинный диагноз инфекции; это может отражать простую колонизацию верхних дыхательных путей, учитывая, что споры Aspergillus распространены повсеместно [52]. Согласно рекомендациям Европейской организации по исследованию и лечению рака (EORTC) и Национального института здоровья (MSG), определение галактоманнанового антигена Aspergillus spp. включено в состав микробиологических критериев диагностики инвазивного аспергиллеза [73]. Кроме того, доступны тесты с использованием грибковых биомаркеров клеточной стенки, включая (1-3) β-D-глюканы в крови, но они не позволяют дифференцировать инвазивный аспергиллез от других грибковых заболеваний. Следовательно, эти тесты следует рассматривать как способ исключить грибковую инфекцию при отрицательном результате. Количественный ПЦР-анализ все еще не стандартизирован для обнаружения ДНК Aspergillus в образцах крови или дыхательных путей. Выявление антител Aspergillus является ценным только для диагностики хронического аспергиллеза, включая аспергиллому и аллергический бронхолегочный аспергиллез [52].
Экспериментальные модели аспергиллеза на животных помогают в изучении патофизиологических процессов, оценке диагностических средств, терапевтических эффектов противогрибковых препаратов, позволяющих бороться с инфекционными заболеваниями. Основные модели аспергиллеза с использованием животных представлены в табл. 4.
Альтернативные модели на беспозвоночных
В соответствии с руководящими принципами, лежащими в основе гуманного использования животных в научных исследованиях, приверженность указанным принципам предписывается директивой 2010/63/EU, при планировании исследования на животных необходимо соблюсти принципы «трех R» (reduction – сокращение, refinement – улучшение, replacement – замена). Использование альтернативных моделей на беспозвоночных может заменить исследования на более сложноорганизованных организмах.
В качестве моделей для изучения патогенеза грибов, помимо млекопитающих, часто используют беспозвоночных, таких как амеба (Acanthamoeba castellanii [74–76] и Dictyostellium discoideum [75]), насекомые (Drosophila melanogaster [76], Galleria mellonella [75, 76] и Bombyx mori [77, 78]) и нематода Caenorhabditis elegans [75, 76]. Эксперименты с этими моделями беспозвоночных проходят намного быстрее и проще, чем с млекопитающими. Более того, многие аспекты их врожденного иммунитета сохранены по сравнению с таковыми у млекопитающих. Однако важно отметить, что даже в рамках модельной категории беспозвоночных не все представители подвержены заражению определенным грибковым патогеном, а в некоторых случаях хозяин не подходит для изучения определенного признака патогенеза [74]. Модели на беспозвоночных имеют множество преимуществ и недостатков по сравнению друг с другом и с традиционной моделью млекопитающих (мышиной), как показано в табл. 5.
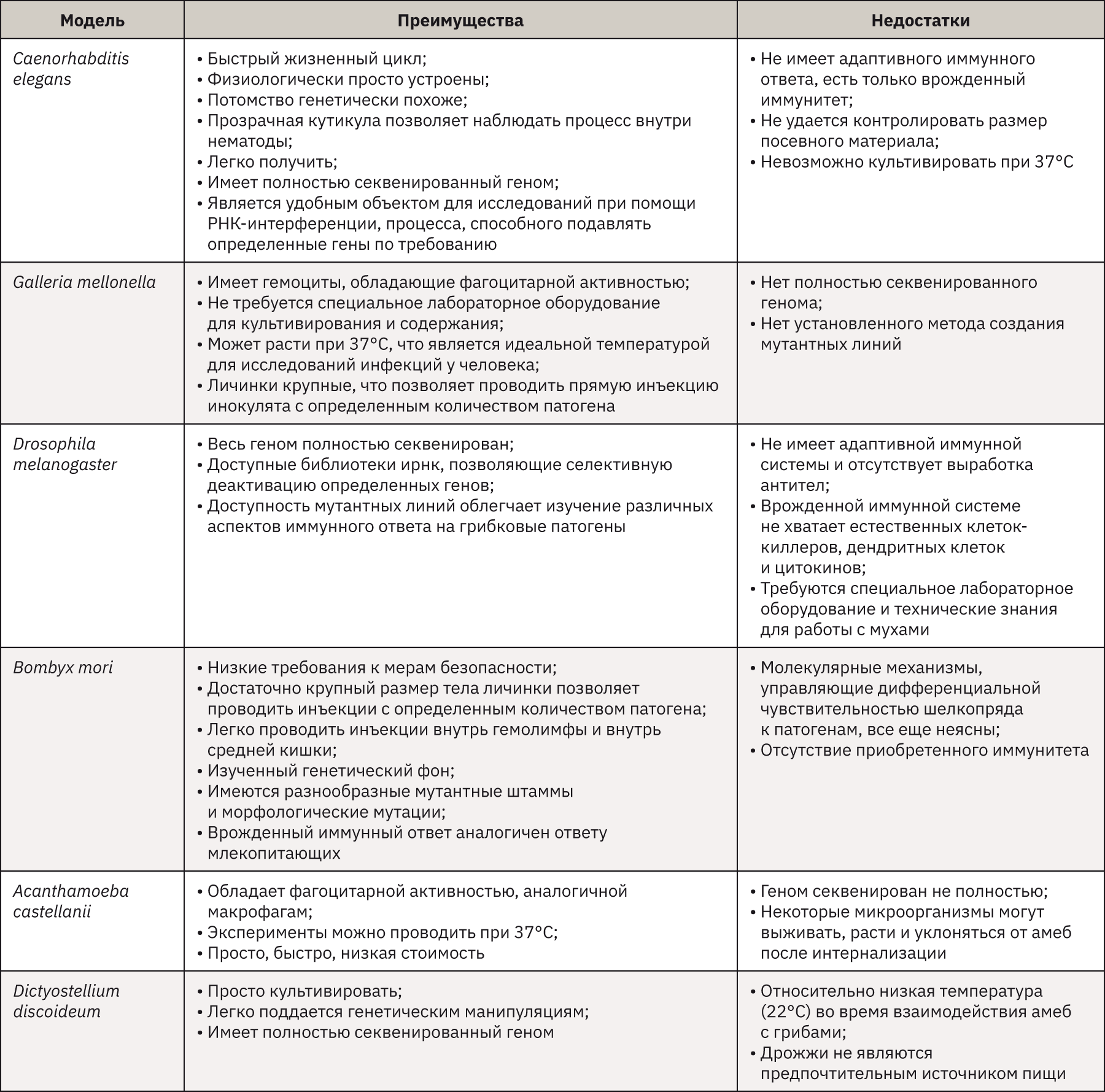
Выбор модельной системы беспозвоночных для изучения вирулентности грибов в значительной степени зависит от конкретных факторов, связанных с вирулентностью патогенов, представляющих интерес конкретных врожденных иммунных реакций хозяина. Если цель – изучение врожденных иммунных ответов, то выбирают, как правило, многоклеточный модельный организм, такой как Drosophila или C. elegans. Если цель – изучение фагоцитоза и/или результат приема внутрь, выбор включает одноклеточные организмы, такие как амебы. Точно так же, если целью является изучение грибковых процессов, которые происходят при температуре около 37°C, необходимо выбрать термостойкую модельную систему, такую как G. mellonella или Acanthamoeba castellanii [76].
Использование беспозвоночных моделей в исследованиях грибковых инфекций имеет не только множество плюсов, но и минусов, из-за которых они не могут полностью заменить млекопитающих. Данные модели можно рекомендовать в качестве дополнительных моделей для расширения знаний о грибковом патогенезе, а также об открытии новых противогрибковых лекарственных средств.
Заключение
С каждым годом количество грибковых инфекций растет за счет увеличения числа людей с ослабленным иммунитетом, а также развития устойчивости грибов к лекарственным средствам. Все это подталкивает к необходимости изучения патобиологии грибковых инфекций: определение факторов вирулентности, возникновение болезни, адаптации к среде хозяина различных грибковых патогенов человека и реакции организма на патоген. Для решения этих проблем используют различные модельные системы in vivo. Модели на мышах являются стандартными и часто используемыми. Большое разнообразие различных линий мышей, в том числе растущее число генномодифицированных и трансгенных, а также относительно низкая стоимость и использование небольшого пространства для содержания, сделали модели грибковых инфекций на мышах самыми популярными. В табл. 6 представлены основные возбудители грибковых заболеваний и очаги поражений людей, а также соответствующие грибковые модели на мышах со способами заражения.
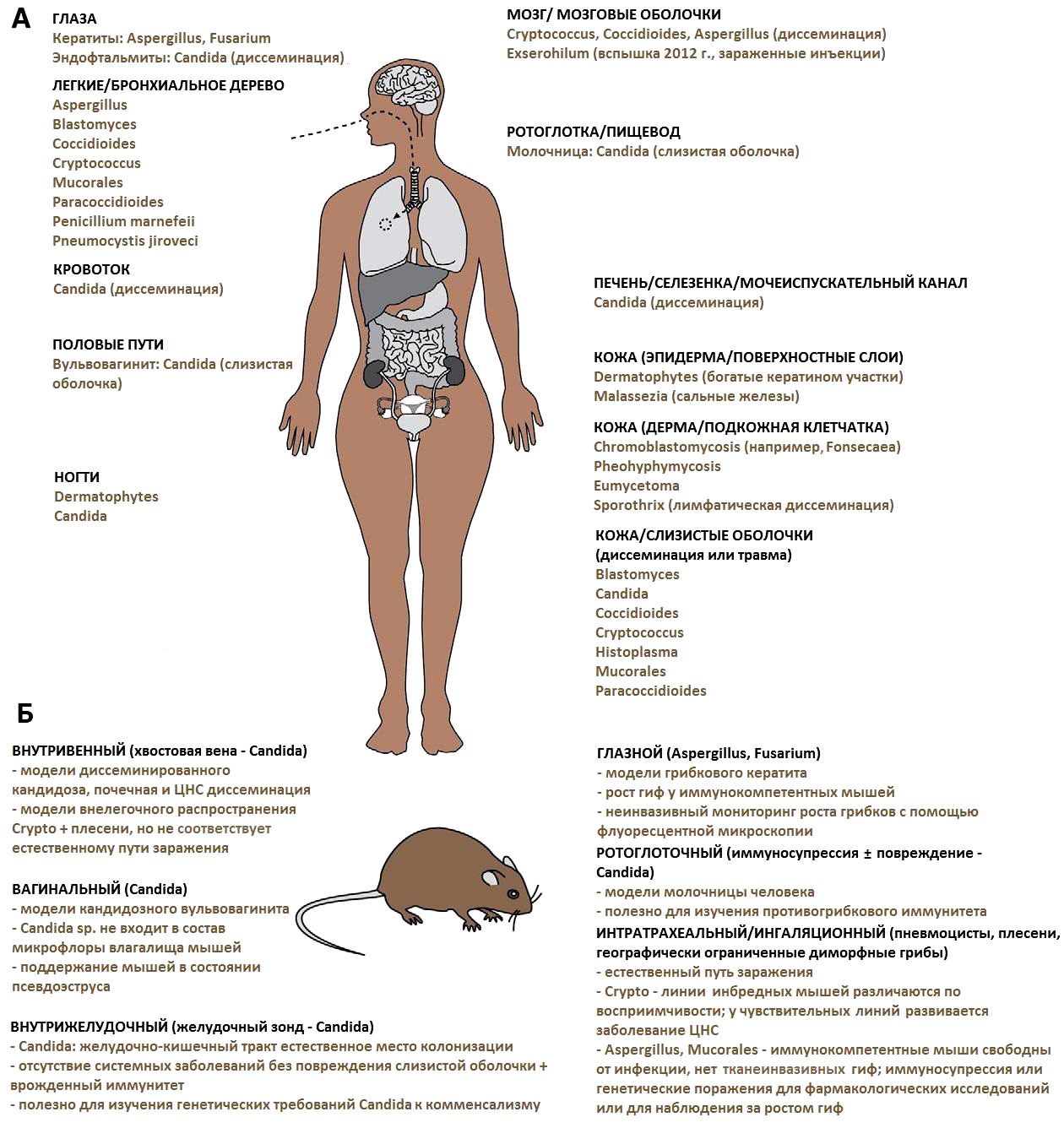
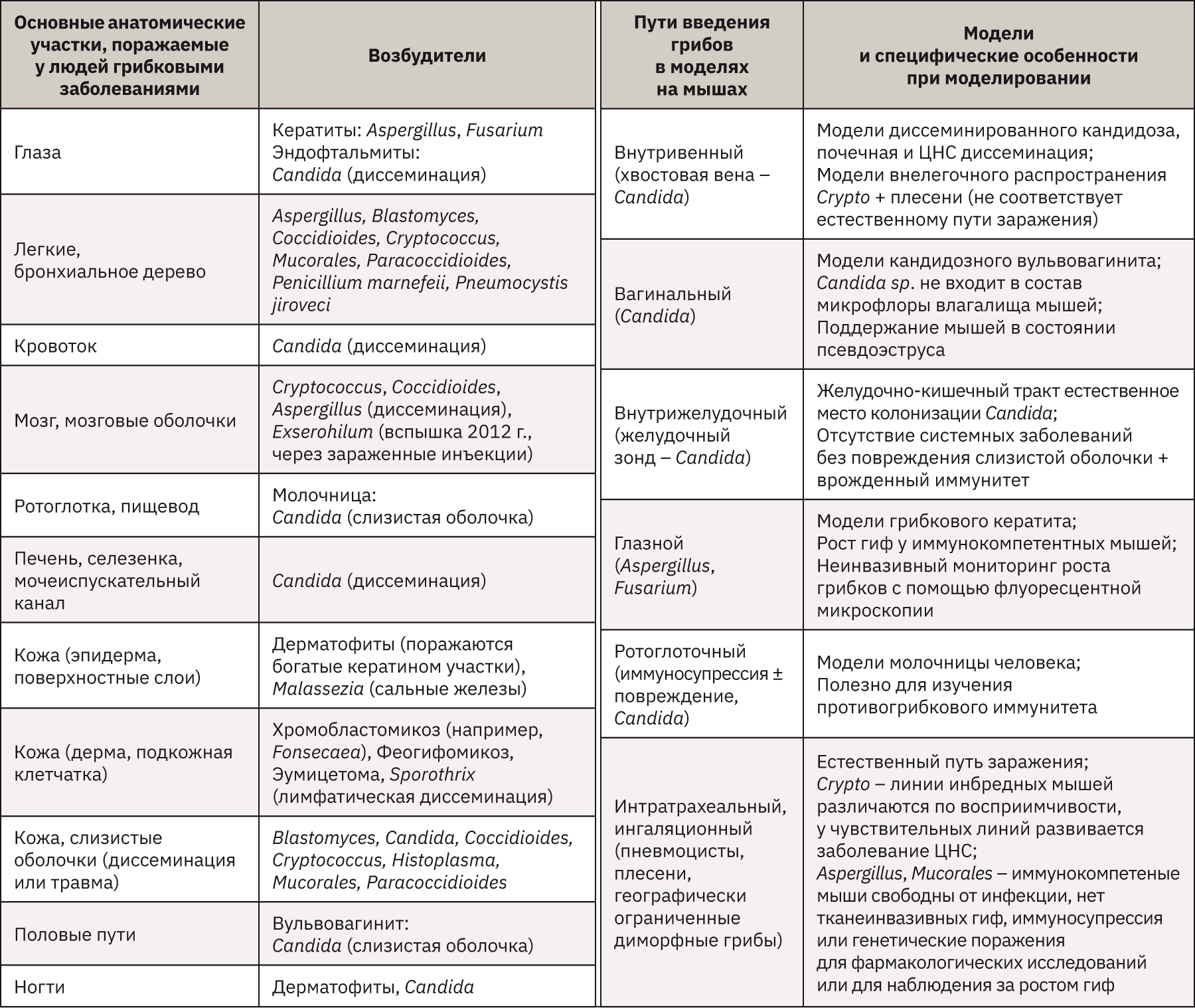
Однако по этическим и экономическим соображениям для некоторых целей можно использовать альтернативные модели беспозвоночных. Очень важно при выборе грибковой модели на животных максимально близко воспроизвести клиническое течение заболевания человека. Для подтверждения достоверности полученных данных необходимо, чтобы модель была высоковоспроизводимой, для этого необходимо стандартизировать используемые методы. Таким образом, для проведения исследования на животных необходимо тщательно определить модель и вид используемого животного.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
К.Е. Боровкова – идея, сбор данных литературных источников, сбор и анализ данных, написание и редактирование текста статьи
М.Н. Макарова – концепция и дизайн исследования, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
Л.Р. Никифорова – научное консультирование
Ю.В.Салмова – научное консультирование
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Климко Н.Н. Микозы - скрытая угроза // Медицина экстремальных ситуаций. – 2018. – №3. – С. 289-292. [Klimko N.N. Mikozy - skrytaya ugroza // Meditsina ekstremal'nykh situatsii. – 2018. – №3. – P. 289-292 (In Russ).].
- Kainz K., Bauer M.A., Madeo F., Carmona-Gutierrez D. Fungal infections in humans: the silent crisis // Microb Cell. – 2020. – Vol. 7(6). – P. 143-145. doi:10.15698/mic2020.06.718.
- Рамазанова Б.А., Батырбаева Д.Ж., Бекназарова А.Н. Различные виды грибковых инфекции у онкологических больных (обзор литературы) // Вестник КазНМУ. – 2015. – №3. – С.47-54. [Ramazanova B.A., Batyrbaeva D.Zh., Beknazarova A.N. Razlichnye vidy gribkovyh infekcii u onkologicheskih bol'nyh (obzor literatury) // Vestnik KazNMU. – 2015. – №3. – Р. 47-54 (In Russ).].
- Köhler J.R., Casadevall A., Perfect J. The spectrum of fungi that infects humans // Cold Spring Harb Perspect Med. – 2014. – Vol. 5(1). – P. 1-22. doi:10.1101/cshperspect.a019273.
- Janbon G., Quintin J., Lanternier F., d'Enfert C. Studying fungal pathogens of humans and fungal infections: fungal diversity and diversity of approaches // Microbes Infect. – 2019. – Vol. 21(5-6). – P. 237-245. doi: 10.1016/j.micinf.2019.06.011.
- McGinnis M.R., Tyring S.K. Introduction to Mycology. In: Baron S., ed. Medical Microbiology. 4th ed. Galveston (TX): University of Texas Medical Branch at Galveston. 1996.
- Fungal infections. [Электронный ресурс] URL: http://www.life-worldwide.org/fungal-diseases.
- Смирнова О., Литвак Н. Микозы кожи: «Перспективная» инфекция // Ремедиум. – 2015. – №6. – С.43-46. [Smirnova O., Litvak N. Mikozy kozhi: «Perspektivnaja» infekcija // Remedium. – 2015. – №6. – P.43-46 (In Russ).].
- Arenas R., Moreno-Coutiño G., Welsh O. Classification of subcutaneous and systemic mycoses // Clin Dermatol. – 2012. – Vol. 30(4). – P. 369-371. doi: 10.1016/j.clindermatol.2011.09.006.
- Воробьева А.А. и др. Атлас по медицинской микробиологии, вирусологии и иммунологии // под ред. А.А. Воробьева, А.С. Быкова. М.: Медицинское информационное агентство. 2003. 232 с. [Vorob'eva A.A. i dr. Atlas po medicinskoj mikrobiologii, virusologii i immunologii // pod red. A. A. Vorob'eva, A.S. Bykova. M.: Medicinskoe informacionnoe agentstvo. 2003. Р. 232 (In Russ).].
- Prasad N., Gupta A. Fungal Peritonitis in Peritoneal Dialysis Patients // Peritoneal Dialysis International. – 2005. – Vol. 25(3). – P. 207-222. doi:10.1177/089686080502500302.
- Москвитина Е.Н. и др. Атлас возбудителей грибковых инфекций // Е. Н. Москвитина [и др.]. М.: ГЭОТАР-Медиа. 2017. 208 с. [Moskvitina E.N. i dr. Atlas vozbuditelej gribkovyh infekcij // E. N. Moskvitina [i dr.]. M.: GJeOTAR-Media. 2017. Р. 208 (In Russ).].
- Shimamura T., Kubota N., Shibuya K. Animal model of dermatophytosis // J Biomed Biotechnol. – 2012. – Vol. 1. doi: 10.1155/2012/125384.
- Baltazar L.M., Santos D.A. Perspective on animal models of dermatophytosis caused by Trichophyton rubrum. // Virulence. – 2015. – Vol. 6(4). – P. 372-375. doi:10.1080/21505594.2015.1027480.
- Rashid A. Arthroconidia as vectors of dermatophytosis // Cutis. – 2001. –Vol. 67(5) – P. 23.
- Faway E., Lambert de R. C., Poumay Y. In vitro models of dermatophyte infection to investigate epidermal barrier alterations // Exp Dermatol. – 2018. – Vol. 27(8). – P. 915-922. doi: 10.1111/exd.13726.
- Hay R.J., Calderon R.A., Collins M.J. Experimental dermatophytosis: the clinical and histopathologic features of a mouse model using Trichophyton quinckeanum (mouse favus) // J Invest Dermatol. – 1983. – Vol. 81(3). – P. 270-274. doi: 10.1111/1523-1747.ep12518292.
- Sen S., Borah S.N., Kandimalla R., Bora A., Deka S. Efficacy of a rhamnolipid biosurfactant to inhibit Trichophyton rubrum in vitro and in a mice model of dermatophytosis // Exp Dermatol. – 2019. – Vol. 28(5). – P. 601-608. doi: 10.1111/exd.13921.
- Venturini J., Alvares A.M., Camargo M.R., Marchetti C.M., Fraga-Silva T.F., Luchini A.C., Arruda M.S. Dermatophyte–host relationship of a murine model of experimental invasive dermatophytosis // Microbes and Infection. – 2012. – Vol. 14(13). – P. 1144–1151. doi:10.1016/j.micinf.2012.07.014.
- Weber J., Balish E. Antifungal therapy of dermatophytosis in guinea pigs and congenitally athymic rats // Mycopathologia. – 2004. – Vol. 90. – P. 47-54.
- Kumar N., Shishu. D-optimal experimental approach for designing topical microemulsion of itraconazole: Characterization and evaluation of antifungal efficacy against a standardized Tinea pedis infection model in Wistar rats // Eur J Pharm Sci. – 2015. – Vol. 67. – P. 97-112. doi: 10.1016/j.ejps.2014.10.014.
- Saunte D.M., Simmel F., Frimodt-Moller N., Stolle L.B., Svejgaard E.L., Haedersdal M., Kloft C., Arendrup M.C. In vivo efficacy and pharmacokinetics of voriconazole in an animal model of dermatophytosis // Antimicrob Agents Chemother. – 2007. – Vol. 51(9). – P. 3317-3321. doi: 10.1128/AAC.01185-06.
- Baldo A., Mathy A., Tabart J., Camponova P., Vermout S., Massart L., Marеchal F., Galleni M., Mignon B. Secreted subtilisin Sub3 from Microsporum canis is required for adherence to but not for invasion of the epidermis // Br J Dermatol. – 2010. – Vol. 162(5). – P. 990-997. doi: 10.1111/j.1365-2133.2009.09608.x.
- Song X., Wei Y.X., Lai K.M., He Z.D., Zhang H.J. In vivo antifungal activity of dipyrithione against Trichophyton rubrum on guinea pig dermatophytosis models // Biomed Pharmacother. – 2018. – Vol. 108. – P. 558-564. doi: 10.1016/j.biopha.2018.09.045.
- Ghannoum M.A., Long L., Pfister W.R. Determination of the efficacy of terbinafine hydrochloride nail solution in the topical treatment of dermatophytosis in a guinea pig model // Mycoses. – 2009. – Vol. 52(1). – P. 35-43. doi: 10.1111/j.1439-0507.2008.01540.x.
- Van Cutsem J., Janssen P.A. Experimental systemic dermatophytosis // J Invest Dermatol. – 1984. – Vol. 83(1). – P. 26-31. doi: 10.1111/1523-1747.ep12261652.
- Arruda M.S., Gilioli S., Vilani-Moreno F.R. Experimental dermatophytosis in hamsters inoculated with Trichophyton mentagrophytes in the cheek pouch // Rev Inst Med Trop Sao Paulo. – 2001. – Vol. 43(1). – P.29-32. doi: 10.1590/s0036-46652001000100006.
- Oborilova E., Rybnikar A. Experimental dermatophytosis in calves caused by Trichophyton verrucosum culture // Mycoses. – 2005. – Vol. 48(3). – P. 187-91. doi: 10.1111/j.1439-0507.2005.01123.x.
- DeBoer D.J., Moriello K.A. Inability of two topical treatments to influence the course of experimentally induced dermatophytosis in cats // J Am Vet Med Assoc. – 1995. – Vol. 207(1) – P. 52-57.
- Cambier L., Heinen M.P., Mignon B. Relevant Animal Models in Dermatophyte Research // Mycopathologia. – 2017. – Vol. 182(1-2). – P. 229-240. doi: 10.1007/s11046-016-0079-3.
- Hanel H., Braun B., Löschhorn K. Experimental dermatophytosis in nude guinea pigs compared with infections in Pirbright White animals // Mycoses. – 1990. – Vol. 33(4). – P. 179-189. doi: 10.1111/myc.1990.33.4.179.
- Muzyka B.C., Epifanio R.N. Update on oral fungal infections // Dent Clin North Am. – 2013. – Vol. 57(4). – P. 561-581. doi: 10.1016/j.cden.2013.07.002.
- Tuite N.L., Lacey K. Overview of invasive fungal infections // Methods Mol Biol. – 2013. – Vol. 968. – P. 1-23. doi: 10.1007/978-1-62703-257-5_1.
- Semis R., Mendlovic S., Polacheck I., Segal E. Activity of an Intralipid formulation of nystatin in murine systemic candidiasis // Int J Antimicrob Agents. – 2011. – Vol. 38(4). – P. 336-340. doi: 10.1016/j.ijantimicag.2011.04.018.
- Frenkel M., Mandelblat M., Alastruey-Izquierdo A., Mendlovic S., Semis R., Segal E. Pathogenicity of Candida albicans isolates from bloodstream and mucosal candidiasis assessed in mice and Galleria mellonella // J Mycol Med. – 2016. – Vol. 26(1). – P. 1-8. doi: 10.1016/j.mycmed.2015.12.006.
- Sandovsky-Losica H., Barr-Nea L., Segal E. Fatal systemic candidiasis of gastrointestinal origin: an experimental model in mice compromised by anti-cancer treatment // J Med Vet Mycol. – 1992. – Vol. 30(3). – P. 219-231. doi: 10.1080/02681219280000281.
- Segal E., Gottfried L., Lehrer N. Candidal vaginitis in hormone-treated mice: prevention by a chitin extract // Mycopathologia. – 1988. – Vol. 102(3). – P. 157-163. doi: 10.1007/BF00437398.
- Clemons K.V., Gonzalez G.M., Singh G., et al. Development of an orogastrointestinal mucosal model of candidiasis with dissemination to visceral organs // Antimicrob Agents Chemother. – 2006. – Vol. 50(8). – P. 2650-2657. doi: 10.1128/AAC.00530-06.
- Conti H.R., Huppler A.R., Whibley N., Gaffen S.L. Animal models for candidiasis // Curr Protoc Immunol. – 2014. – Vol. 105. doi: 10.1002/0471142735.im1906s105.
- Algin C., Sahin A., Kiraz N., Sahintürk V., Ihtiyar E. Effectiveness of bombesin and Saccharomyces boulardii against the translocation of Candida albicans in the digestive tract in immunosuppressed rats // Surg Today. – 2005. – Vol. 35(10). – P. 869-873. doi: 10.1007/s00595-005-3049-9.
- Cassone A., Boccanera M., Adriani D., Santoni G., De Bernardis F. Rats clearing a vaginal infection by Candida albicans acquire specific, antibody-mediated resistance to vaginal reinfection // Infect Immun. – 1995. – Vol. 63(7). – P. 2619-2624. doi:10.1128/iai.63.7.2619-2624.1995.
- Fisker A.V., Schiott C.R., Philipsen H.P. Long-term oral candidosis in rats // Acta Pathol Microbiol Immunol Scand B. – 1982. – Vol. 90(3). – P. 221-227. doi: 10.1111/j.1699-0463.1982.tb00109.x.
- Junqueira J.C., Martins J.S., Faria R.L., Colombo C.E., Jorge A.O. Photodynamic therapy for the treatment of buccal candidiasis in rats // Lasers Med Sci. – 2009. – Vol. 24(6). – P. 877-884. doi: 10.1007/s10103-009-0673-4.
- Maebashi K., Itoyama T., Uchida K., Suegara N., Yamaguchi H. A novel model of cutaneous candidiasis produced in prednisolone-treated guinea-pigs // J Med Vet Mycol. – 1994. – Vol. 32(5). – P. 349-359. doi: 10.1080/02681219480000471.
- Odds F.C., Van Nuffel L., Gow N.A.R. Survival in experimental Candida albicans infections depends on inoculum growth conditions as well as animal host // Microbiology (Reading). – 2000. – Vol. 146(8). – P. 1881-1889. doi: 10.1099/00221287-146-8-1881.
- Lu G., Wang C., Wu C., Yan L., Tang J. Identification of early biomarkers in a rabbit model of primary Candida pneumonia // BMC Infect Dis. – 2019. – Vol. 19(1). – P. 698. doi: 10.1186/s12879-019-4320-9.
- Schinabeck M.K., Long L.A., Hossain M.A., Chandra J., Mukherjee P.K., Mohamed S., Ghannoum M.A. Rabbit model of Candida albicans biofilm infection: liposomal amphotericin B antifungal lock therapy // Antimicrob Agents Chemother. – 2004. – Vol. 48(5). – P. 1727-1732. doi: 10.1128/AAC.48.5.1727-1732.2004.
- Segal E., Frenkel M. Experimental in Vivo Models of Candidiasis // J Fungi (Basel). – 2018. – Vol. 4(1). – P. 21. doi:10.3390/jof4010021.
- Hirayama T., Miyazaki T., Ito Y. et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation // Sci Rep. – 2020. – Vol. 10(1). – P. 3814. doi:10.1038/s41598-020-60792-y.
- Hohl T.M. Overview of vertebrate animal models of fungal infection // J Immunol Methods. – 2014. – Vol. 410. – P. 100-112. doi: 10.1016/j.jim.2014.03.022.
- MacCallum D.M., Odds F.C. Influence of grapefruit juice on itraconazole plasma levels in mice and guinea pigs // J Antimicrob Chemother. – 2002. – Vol. 50(2). – P. 219-224. doi: 10.1093/jac/dkf103.
- Desoubeaux G., Cray C. Animal Models of Aspergillosis // Comp Med. –2018. – Vol. 68(2). – P. 109-123.
- Васильева Н.В., Босак И.А., Богомолова Т.С. и др. Разработка экспериментальной модели инвазивного аспергиллёза лёгких с использованием клинических изолятов Aspergillus fumigatus // Проблемы медицинской микологии. – 2016. – №4. – С 32-35. [Vasil'eva N.V., Bosak I.A., Bogomolova T.S. i dr. Razrabotka jeksperimental'noj modeli invazivnogo aspergilljoza ljogkih s ispol'zovaniem klinicheskih izoljatov Aspergillus fumigatus // Problemy medicinskoj mikologii. – 2016. – №4. – P. 32-35 (In Russ).].
- Shields B.E., Rosenbach M., Brown-Joel Z., Berger A.P., Ford B.A., Wanat K.A. Angioinvasive fungal infections impacting the skin: Background, epidemiology, and clinical presentation // J Am Acad Dermatol. – 2019. – Vol. 80(4). – P. 869-880. doi: 10.1016/j.jaad.2018.04.059.
- Paulussen C., Boulet G.A., Cos P., Delputte P., Maes L.J. Animal models of invasive aspergillosis for drug discovery // Drug Discov Today. – 2014. – Vol. 19(9). – P. 1380-1386. doi: 10.1016/j.drudis.2014.06.006.
- Ghori H.M., Edgar S.A. Comparative susceptibility of chickens, turkeys and Coturnix quail to aspergillosis // Poult Sci. – 1973. – Vol. 52(6). – P. 2311-2315. doi: 10.3382/ps.0522311.
- Melloul E., Thierry S., Durand B., Cordonnier N., Desoubeaux G., Chandenier J., Bostvironnois C., Botterel F., Chermette R., Guillot J., Arne P. Assessment of Aspergillus fumigatus burden in lungs of intratracheally-challenged turkeys (Meleagris gallopavo) by quantitative PCR, galactomannan enzyme immunoassay, and quantitative culture // Comp Immunol Microbiol Infect Dis. – 2014. – Vol. 37(5-6). – P. 271-279. doi: 10.1016/j.cimid.2014.07.005.
- Suleiman M.M., Duncan N., Eloff J.N. et al. A controlled study to determine the efficacy of Loxostylis alata (Anacardiaceae) in the treatment of aspergillus in a chicken (Gallus domesticus) model in comparison to ketoconazole // BMC Vet Res. – 2012. – Vol. 8. – P. 10. doi: 10.1186/1746-6148-8-210.
- Clemons K.V., Stevens D.A. The contribution of animal models of aspergillosis to understanding pathogenesis, therapy and virulence // Med Mycol. – 2005. – Vol. 43(l). – P. 101-110. doi: 10.1080/13693780500051919.
- Giudice P.L., Campo S., Verdoliva A., et al. Efficacy of PTX3 in a rat model of invasive aspergillosis // Antimicrob Agents Chemother. – 2010. – Vol. 54(10). – P. 4513-4515. doi:10.1128/AAC.00674-10.
- Zhang F., An Y., Li Z., Zhao C. A novel model of invasive fungal rhinosinusitis in rats // Am J Rhinol Allergy. – 2013. – Vol. 27(5). – P. 361-366. doi: 10.2500/ajra.2013.27.3953.
- Ahmad S., Al-Shaikh A.A., Khan Z. Development of a novel inhalational model of invasive pulmonary aspergillosis in rats and comparative evaluation of three biomarkers for its diagnosis // PLoS One. – 2014. – Vol. 9(6). doi: 10.1371/journal.pone.0100524.
- Becker M.J., De Marie S., Fens M.H., Haitsma J.J., Verbrugh H.A., Lachmann B., Bakker-Woudenberg I.A. Pathophysiology of unilateral pulmonary aspergillosis in an experimental rat model // Med Mycol. – 2006. – Vol. 44(2). – P. 133-139. doi: 10.1080/13693780500271749.
- Adamson T.W., Diaz-Arevalo D., Gonzalez T.M., Liu X., Kalkum M. Hypothermic endpoint for an intranasal invasive pulmonary aspergillosis mouse model // Comp Med. – 2013. – Vol. 63(6). – P. 477-81.
- Ben-Ami R., Lewis R.E., Leventakos K., Latge J.P., Kontoyiannis D.P. Cutaneous model of invasive aspergillosis //Antimicrob Agents Chemother. –2010. – Vol. 54(5). – P.1848-1854. doi:10.1128/AAC.01504-09.
- Chiang L.Y., Ejzykowicz D.E., Tian Z.Q., Katz L., Filler S.G. Efficacy of ambruticin analogs in a murine model of invasive pulmonary aspergillosis // Antimicrob Agents Chemother. – 2006. – Vol. 50(10). – P. 3464-3466. doi:10.1128/AAC.00558-06.
- Chiller T.M., Luque J.C., Sobel R.A., Farrokhshad K., Clemons K.V., Stevens D.A. Development of a murine model of cerebral aspergillosis // J Infect Dis. – 2002. – Vol. 186(4). – P. 574-7. doi: 10.1086/341567.
- Kirkpatrick W.R., McAtee R.K., Fothergill A.W., Rinaldi M.G., Patterson T.F. Efficacy of voriconazole in a guinea pig model of disseminated invasive aspergillosis // Antimicrob Agents Chemother. – 2000. – Vol. 44(10). – P. 2865-2868. doi: 10.1128/AAC.44.10.2865-2868.2000.
- Lengerova M., Kocmanova I., Racil Z., et al. Detection and measurement of fungal burden in a guinea pig model of invasive pulmonary aspergillosis by novel quantitative nested real-time PCR compared with galactomannan and (1,3)-β-D-glucan detection // J Clin Microbiol. – 2012. – Vol. 50(3). – P. 602-608. doi:10.1128/JCM.05356-11.
- Chandrasekar P.H., Cutright J.L., Manavathu E.K. Efficacy of voriconazole plus amphotericin B or micafungin in a guinea-pig model of invasive pulmonary aspergillosis // Clin Microbiol Infect. – 2004. – Vol. 10(10). – P. 925-928. doi: 10.1111/j.1469-0691.2004.00958.x.
- Kirkpatrick W.R., McAtee R.K., Fothergill A.W., Loebenberg D., Rinaldi M.G., Patterson T.F. Efficacy of SCH56592 in a rabbit model of invasive aspergillosis // Antimicrob Agents Chemother. – 2000. – Vol. 44(3). – P. 780-782. doi: 10.1128/AAC.44.3.780-782.2000.
- Petraitis V., Petraitiene R., Hope W.W., et al. Combination therapy in treatment of experimental pulmonary aspergillosis: in vitro and in vivo correlations of the concentration- and dose- dependent interactions between anidulafungin and voriconazole by Bliss independence drug interaction analysis // Antimicrob Agents Chemother. – 2009. – Vol. 53(6). – P. 2382-2391. doi:10.1128/AAC.00329-09.
- Игнатьева С. М., Спиридонова В.А., Богомолова Т. С. и др. Особенности определения галактоманнана в сыворотке крови и бронхоальвеолярном лаваже онкогематологических больных с инвазивным аспергиллезом. Собственные данные и обзор литературы // Проблемы медицинской микологии. – 2013. – Т. 15. – № 4. – С. 45-52. [Ignat'eva S. M., Spiridonova V.A., Bogomolova T.S. i dr. Osobennosti opredelenija galaktomannana v syvorotke krovi i bronhoal'veoljarnom lavazhe onkogematologicheskih bol'nyh s invazivnym aspergillezom. Sobstvennye dannye i obzor literatury // Problemy medicinskoj mikologii. – 2013. – T. 15. – № 4. – P. 45-52. (In Russ).].
- Madende M., Albertyn J., Sebolai O., Pohl C.H. Caenorhabditis elegans as a model animal for investigating fungal pathogenesis // Med Microbiol Immunol. – 2020. – Vol. 209(1). – P. 1-13. doi: 10.1007/s00430-019-00635-4.
- Koller B., Schramm C., Siebert S., et al. Dictyostelium discoideum as a Novel Host System to Study the Interaction between Phagocytes and Yeasts // Front Microbiol. – 2016. – Vol. 7. – P. 1665. doi: 10.3389/fmicb.2016.01665.
- Mylonakis E., Casadevall A., Ausubel F.M. Exploiting amoeboid and non-vertebrate animal model systems to study the virulence of human pathogenic fungi // PLoS Pathog. – 2007. – Vol. 3(7). – P. 101. doi: 10.1371/journal.ppat.0030101.
- Meng X., Zhu F., Chen K. Silkworm: A Promising Model Organism in Life Science // J Insect Sci. – 2017. – Vol. 17(5). – P. 97. doi: 10.1093/jisesa/iex064.
- Matsumoto Y., Sekimizu K. Silkworm as an experimental animal for research on fungal infections // Microbiol Immunol. – 2019. – Vol. 63(2). – P. 41-50. doi: 10.1111/1348-0421.12668.



