Поведенческие и репродуктивные характеристики гетерозиготных нокаутных мышей по гену TPH2
Кибиткина А.А., Василевская Е.Р. , Толмачева Г.С. , Федулова Л.В. Поведенческие и репродуктивные характеристики гетерозиготных нокаутных мышей по гену TPH2. Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-01
Резюме
Мутантные мыши с таргетированно удаленным геном ТРН2 – высокоточная модель для некоторых психических заболеваний, таких как аутизм, синдром дефицита внимания, обсессивно-компульсивные и депрессивные расстройства. Ген, кодирующий белок гидроксилазу триптофана-2 (TPH2), является одним из ключевых в серотонинергической нейромедиации, обеспечивая скорость и синтез серотонина из триптофана. Фенотипический профиль гомозиготных нокаутных мышей ТРН2 характеризуется импульсивностью, агрессией, а также нарушениями памяти, познания и обработки информации. В процессе развития и поддержания колонии нокаутных мышей путем гаремного спаривания гетерозиготных особей могут возникать эпизодические приступы агрессии у самок, сниженная репродуктивная активность, отсутствие нормального полового поведения по отношению к самцам. Однако подобные вопросы, касающиеся гетерозиготных мышей, нокаутных по гену TPH2, остаются малоизученными. Для определения факторов, потенциально влияющих на успешность разведения мышей TPH2, в эксперименте изучены эстральный цикл гетерозиготных самок с использованием визуальной оценки и цитологически – половые предпочтения сексуально наивных и опытных самок и самцов мышей в бинарном тесте с мочевой меткой, социальные взаимодействия с однополыми конспецификами в диадическом тесте резидент-интрудер. Выявлены нарушения в эстральном цикле гетерозиготных самок TPH2, в частности, более длительная стадия диэструса и как следствие – сокращение количества циклов. Влияние генного фактора не задействовано в определении сексуальных предпочтений на основе обонятельной информации, однако самцы и самки TPH2 Het (как наивные, так и опытные) проявили значительно больший интерес к наивным особям TPH2 Het и Wt. Самки TPH2 Het не проявляли агрессивного конкурирующего поведения при парном контакте с самками TPH2 Het и Wt, что свидетельствует о применимости стратегии гаремного разведения животных. Таким образом, изученные факторы должны учитываться при поддержании колонии мутантных мышей ТРН2 в период подготовки животных к циклу разведения.
Введение
Нокаутные мыши – уникальный модельный объект в доклинических испытаниях, поскольку представляют собой высокоточную модель, на которую можно экстраполировать многие болезни человека. Одним из ключевых факторов при использовании линии нокаутных мышей является стабильное поддержание племенной колонии животных. Зачастую испытатели используют стандартный протокол разведения для уникальных мутантных мышей, не учитывая при этом видовые фенотипические и физиологические особенности каждой линии [1].
Объектом исследования являлись мыши с нокаутом гена ТРН2 (триптофангидроксилаза-2), которые характеризуются прежде всего обсессивно-компульсивными и депрессивными расстройствами [2]. Поскольку кодируемый геном ТРН2 фермент обусловливает синтез серотонина (5-гидрокситриптамин; 5-НТ) в головном мозге, таргетирование данного гена приводит к нарушениям памяти, познания, обработки информации, импульсивности, агрессии, а также сниженной материнской заботе у грызунов [3–6]. Гетерозиготные особи с нокаутом гена ТРН2 проявляют смешанный фенотипический профиль, уровень серотонина в головном мозге у них колеблется в пределах 20–45% [7]. При поддержании колонии данных мышей мы столкнулись с низким показателем фертильности гетерозиготных особей. Данные о возможных факторах, влияющих на показатель фертильности у этой линии мышей, противоречивы, но в некоторых исследованиях также указывается на растормаживающий эффект репродуктивного опыта мышей c полным нокаутом гена TPH2 (TPH2 Ko) [8].
Исследование направлено на изучение эстрального цикла гетерозиготных самок TPH2, определение половых предпочтений для сексуально-наивных и опытных животных и оценку социальных взаимодействий животных для составления концепции успешного разведения с использованием мышей TPH2 и выявления потенциальных факторов, влияющих на успешность разведения.
Материал и методы
Эксперимент проводили на базе Экспериментальной клиники-лаборатории биологически активных веществ животного происхождения ФГБНУ «ФНЦ пищевых систем им. В.М. Горбатова» РАН с использованием мышей C57BL/6J TPH2 SPF-категории, полученных от базового поголовья мышей C57BL/6J TPH2hCMVcre из племенной колонии SPF-вивария Биоцентра ZEMM (Вюрцбург, Германия). В исследовании использовали половозрелых самок (F) и самцов (M): мышей дикого типа (Wt), гетерозиготных нокаутных по гену TPH2 особей (TPH2 Het), гомозиготных нокаутных по гену TPH2 особей (TPH2 Ко), возраст которых составлял 22–24 нед, сексуально наивных (S/N) и сексуально опытных (S/E).
Животных содержали и тестировали в условиях чистых помещений в индивидуально вентилируемых клетках Bio A.S. Vent II (EHRET, Германия) типа 2L (размер 350×200×140 мм). Самок содержали группами по 5–6 особей, самцов – индивидуально по причине их агрессивного поведения. Животные находились в контролируемых условиях окружающей среды: температура 20±3°С, влажность 35±2%, контроль входного и выходного потока воздуха в индивидуально вентилируемых клетках 95±5 м/ч, режим освещении день/ночь 6.00–18.00/18.00–6.00. В качестве наполнителя использовали кукурузный подстил GM 12 (TAPVEI, Эстония), частота смены подстилочного материала 1 раз в 7 дней. В качестве обогащения окружающей среды использовали цилиндры из ПВХ и бумажный материал для гнездостроения. Эксперимент и все манипуляции с животными проводили в соответствии с требованиями Директивы Европейского сообщества 86/609 EEC. Исследование одобрено биоэтической комиссией ФГБНУ «ФНЦ пищевых систем им. В.М. Горбатова» РАН (Протокол №11/2020 от 27 января 2021 г.).
На протяжении всего эксперимента животные потребляли гранулированный корм ad libitum для разведения лабораторных грызунов (Лабораторкорм, Россия). Воду животные получали на установке водоподготовки EMD Millipore RiOs™ 50 (Merc Millirore, Германия), минерализацию осуществляли путем добавления минеральных солей для получения физиологически полноценного минерального состава (минерализация – 314–382 мг/л: гидрокарбонаты – 144–180 мг/л, сульфаты <1 мг/л, хлориды – 60–76 мг/л, кальций – 6 мг/л, магний – 3 мг/л, натрий – 50–58 мг/л, калий – 50–58 мг/л).
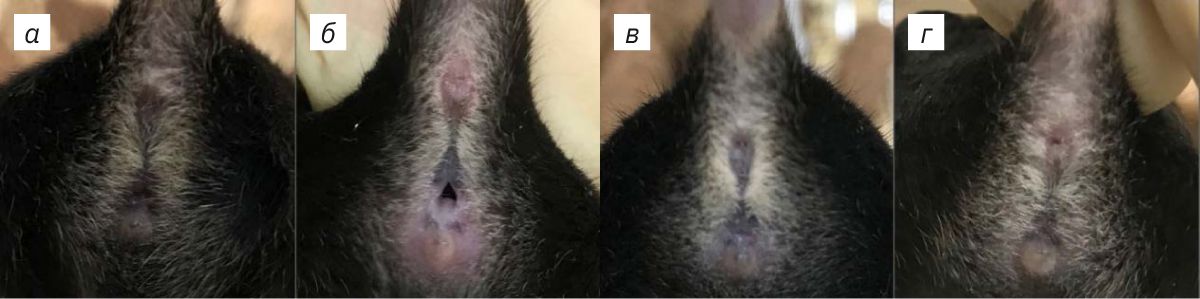
В ходе эксперимента у животных исследовали эстральный цикл и сексуальные предпочтения. Стадии эстрального цикла самок оценивали у Wt (n=8) и TPH2 Het (n=8): визуально осуществляли осмотр вульвы и цитологически проводили микроскопический анализ вагинальных мазков согласно методике, описанной в работе [9], на протяжении 21 сут. Наконечник автоматической пипетки (Thermo Fisher Scientific, США), заполненный физиологическим раствором в объеме 15 мкл, при температуре 22±3°С, помещали в вагинальное отверстие предварительно зафиксированной мыши. Промывание влагалища осуществляли 3–5 раз одним и тем же физиологическим раствором. Затем биоматериал помещали на предметное стекло и накрывали покровным стеклом. Неокрашенный материал просматривали под световым микроскопом Axio A1 (Carl Zeiss, Германия) при увеличении в 40 раз и ярком освещении поля. Стадии эстрального цикла определяли по наличию или отсутствию лейкоцитов, ороговевших эпителиоцитов и ядросодержащих эпителиоцитов [9]. Для визуальной оценки стадии эстрального цикла мышь фиксировали за хвост передними лапами, опирающимися на крышку клетки. Состояние внешней вульвы мышей оценивали следующим образом (рис. 1): в период проэструса выявлялась набухшая, влажная, розовая ткань, отверстие широкое; при эструсе влагалищное отверстие менее розовое, влажное и опухшее; во время метэструса влагалищное отверстие не открыто, ткань не набухшая; в диэструсе влагалищное отверстие закрыто, ткань не имеет отека [9].
Для проведения бинарного теста на сексуальные предпочтения [8] за 48 ч до тестирования собирали урину (с 11.00 до 12.00) у мышей Wt (S/N и S/E) и TPH2 Het (S/N и S/E). Использовали соответственно 7 и 6 самцов каждой категории, урину собирали в суммарном объеме 60 мкл с последующей заморозкой при -40±1°С. Перед тестированием на противоположных стенках клетки на высоте 15±2 мм над уровнем дна прикрепляли фильтровальную бумагу, пропитанную 15 мкл урины от мышей в следующих сочетаниях: (I) Wt S/N и TPH2 Het S/N; (II) Wt S/E и TPH2 Het S/E. Тестируемых животных самцов и самок Wt (S/N и S/E) и TPH2 Het (S/N и S/E) помещали по одной особи на 10 мин в центр клетки с сочетанием меток (I), затем (II) с интервалом 15 мин, перед пересадкой к носовому проходу каждого животного подносили спиртовой тампон для предотвращения искажения запахов. Мочевые метки обновляли после каждой сессии. Регистрировали время обнюхивания каждой мочевой метки с использованием видеокамеры DT5600 Kit (Nikon, Япония).
Для изучения социальных отношений доминирования и подчинения между однополыми животными различных генотипов проводили диадический тест [6] с оценкой взаимодействия мышей-резидентов (Wt, TPH2 Het) в нейтральной зоне с мышами-интрудерами (Wt, TPH2 Het, TPH2 Ko). В исследовании участвовали самцы Wt (n=6), самцы TPH2 Het (n=6), самцы TPH2 Ko (n=6), самки TPH2 Wt (n=6), самки TPH2 Het (n=6), самки TPH2 Ko (n=6). Исследуемую мышь помещали в центр клетки, после адаптации в течение 3 мин в центр клетки подсаживали мышей-интрудеров. В течение 10 мин регистрировали все виды поведенческих взаимодействий животных (обнюхивание, груминг, отталкивание, преследования и укусы) с использованием видеозаписывающего оборудования – камера Nikon DT5600 Kit (Nikon, Япония). Общая схема взаимодействия резидент*интрудер: Wt*Wt, Wt*Het, Wt*Ko; Het*Wt, Het*Het; Het*Ko.
Статистический анализ проводили с использованием пакета программ Statistica 10.0 (Statsoft, Tulsa, OK, СШA); для проверки различий между двумя выборками парных или независимых измерений по уровню количественного признака применяли критерий Уилкоксона. Результаты представлены в виде медианы (Ме) и межквартильного интервала (P25–P75).
Результаты
Во время исследования эстрального цикла была определена его средняя продолжительность, которая для самок WT и TPH2 Het (рис. 2, а) составила соответственно 4,8 (4,3–5,3) и 5,5 (4,5–5,7) сут, т.е. увеличивалась у последних в среднем на 1 сут (p=0,074). Микроскопическое изучение вагинальных мазков показало характерную морфологию каждой стадии, при этом достоверных изменений между образцами мышей различных типов не отмечено (рис. 3, а–з).
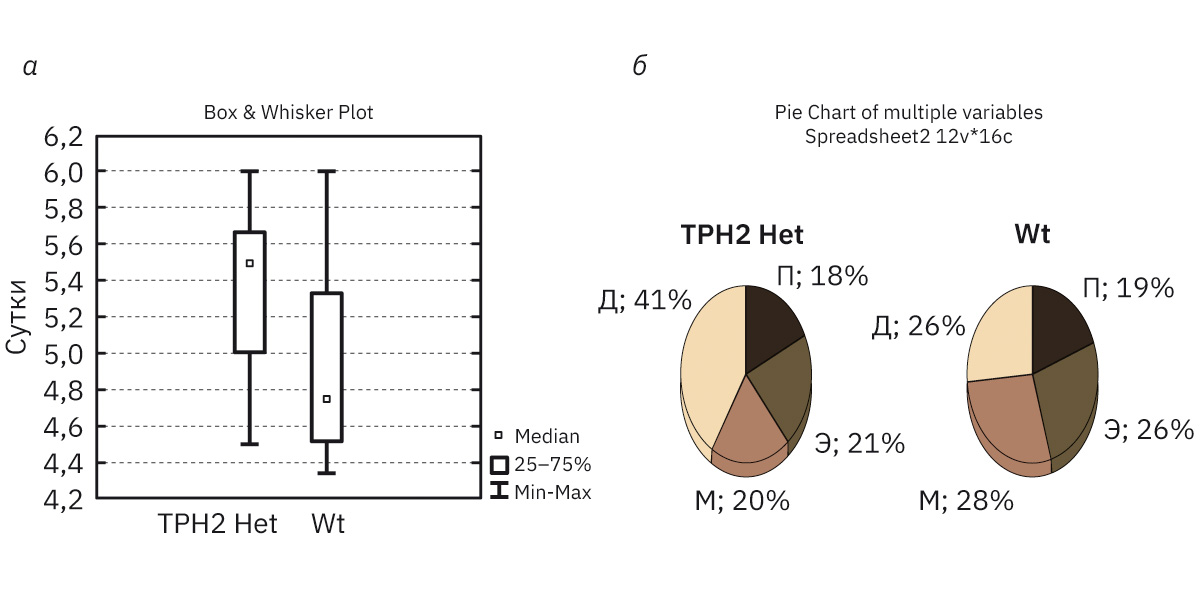
Визуальное наблюдение за эст-ральным циклом несколько не соответствует цитологическим дан-ным. Отмечено, что при визуальной оценке стадий эструса самок TPH2 Het не наблюдается продол-жительного диэструса (средняя длительность цикла составила 4,5 (3,8–4,9) сут, состояние внешних половых органов отчетливо харак-теризовало каждую стадию). Отличий в визуальной и цитологической оценке эстрального цикла самок Wt не наблюдалось: средняя продол-жительность при осмотре составила 4,0 (4,3–5,0) сут.
У самок TPH2 Het по сравнению с WT количество эстральных циклов за период наблюдения (21 сут) было сокращено на 30% (р=0,030), при этом у 71,4% мышей TPH2 Het отмечена увеличенная длительность стадии диэструса – 2,0 (2,0–3,5) сут по сравнению с мышами с WT – 1,0 (1,0–1,7) сут, что указывает на умеренное изменение цикличности (рис. 2, б).

В тесте бинарного выбора мочевых меток самки мышей Wt S/N и TPH2 Het S/E проявляли обонятельные предпочтения к метке самцов TPH2 Het S/N. В среднем самки Wt S/N проводили на 64,7% (p=0,043) больше времени у метки TPH2 Het S/N, чем у Wt S/E, и на 46% (p=0,046) и 30,8% (p=0,172) дольше, чем у меток Wt S/N и TPH2 Het S/E. Время обнюхивания самками TPH2 Het S/E мочевой метки TPH2 Het S/N было продолжительнее на 46% (p=0,248) и 53,1% (p=0,115), чем Wt S/E и TPH2 Het S/E, при этом время обнюхивания метки Wt S/N самцов увеличивалось на 28% (p=0,115). Самки Wt S/E проводили больше всего времени у мочевых меток самцов Wt S/N и TPH2 Het S/N, как видно из табл. 1, время между данными метками практически не отличалось (р>0,500).
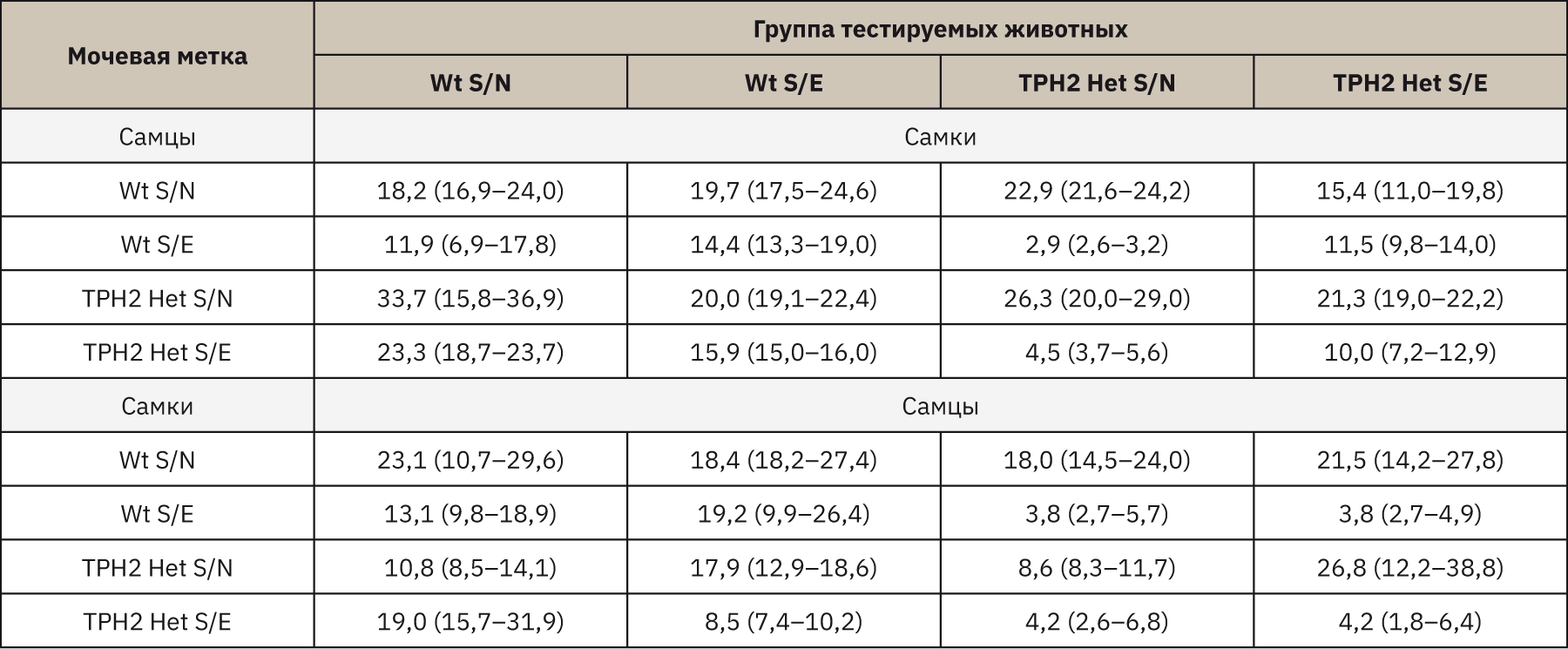
Тестирование самок TPH2 Het показало аналогичные результаты. Однако выявлено, что самки TPH2 Het S/N отдавали большее предпочтение мочевым меткам наивных самцов как Wt, так и TPH2 Het (разница продолжительности обнюхивания между метками Wt S/N и Wt S/E составила 87,3% (p=0,027), между метками TPH2 Het S/N и TPH2 Het S/E – 83% (p=0,027)). Самки мышей TPH2 Het S/E проявляли больший интерес к метке TPH2 Het S/N (время обнюхивания относительно метки TPH2 Het S/E увеличивалось на 53% (p=0,027) и относительно меток Wt S/N и Wt S/E – на 27,7% (p=0,115) и 46,0% (p=0,248) соответственно).
Самцы Wt S/N демонстрировали обонятельные предпочтения к меткам самок Wt S/N, разница относительно TPH2 Het S/N составляла 56,3% (p>0,500), относительно Wt S/E и TPH2 Het S/E – 53,2% (p=0,027) и 17,7% (p>0,500). Между тем самцы Wt S/E проводили больше всего времени у меток самок всех генотипов, за исключением меток TPH2 Het S/E (время обнюхивания сокращалось относительно показателей Wt S/N на 53,8% (p=0,753), относительно показателей Wt S/E на 55,7% (p=0,074) и показателей TPH2 Het S/N на 52,5% (p=0,248) соответственно). Результаты тестирования самцов TPH2 Het S/N и TPH2 Het S/E оказались аналогичными, оба генотипа предпочитали метки Wt S/N и TPH2 Het S/E. По результатам тестирования выявлено, что самцы TPH2 Het S/N больше предпочитали метки Wt S/N – время обнюхивания меток увеличивалось относительно меток Wt S/E на 78,9% (p=0,027), относительно меток TPH2 Het S/N на 52,2% (p=0,115) и меток TPH2 Het S/E на 76,7% (p=0,027). Разница во времени обнюхивания самцов TPH2 Het S/E между метками Wt S/N и Wt S/E составила 82,3% (p=0,027), между метками TPH2 Het S/N и TPH2 Het S/E – 84,3% (p=0,027).
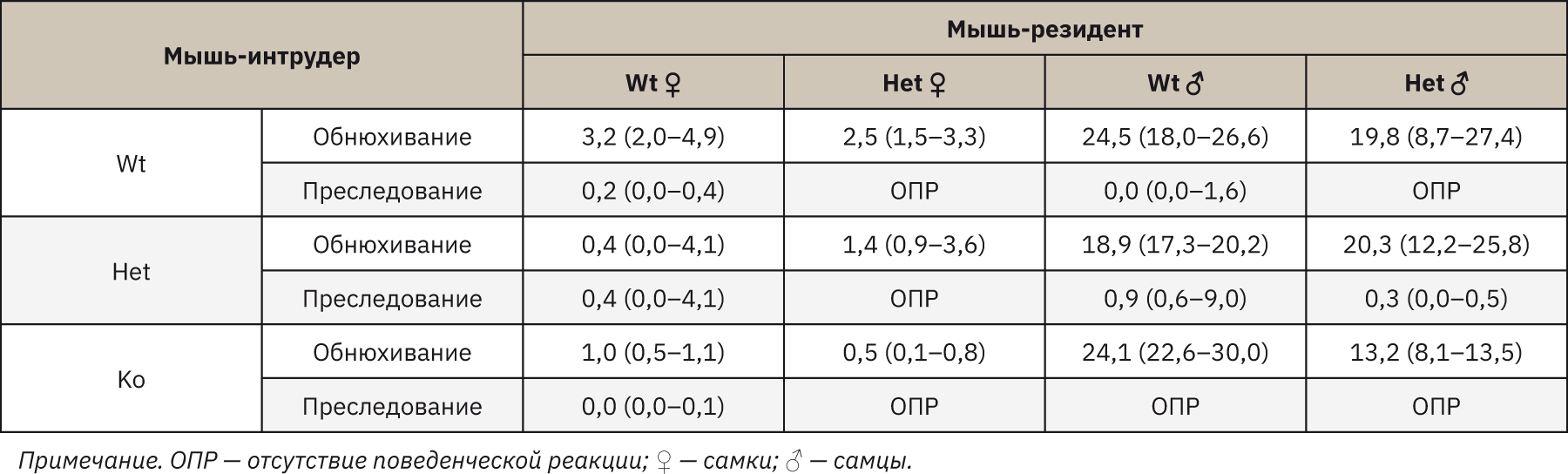
В диадическом тесте на определение социальных отношений взаимодействие самок Wt с интрудерами трех генотипов свидетельствовало о сниженном коммуникативном поведении, агрессивные атаки отсутствовали, время преследования и обнюхивания снижалось для самок Wt на 99,7% (p=0,095), для самок TPH2 Het и TPH2 Ko на 99,9% (p=0,025). Умеренный социальный контакт выявлен у самок TPH2 Het, агрессивных атак также не зафиксировано, наибольшее время социальных контактов зафиксировано в паре с самками Wt. Меньшая продолжительность взаимодействия отмечена при контакте с TPH2 Het (на 57,5%; p= 0,925) и с TPH2 Ko (на 35%; p=0,253). Кратковременное преследование наблюдалось только в паре с TPH2 Ko. Атакующее поведение среди самцов зафиксировано в одной паре Wt*TPH2 Ko (62,5 с), в остальных случаях агрессивной борьбы не наблюдалось. Как видно из табл. 2, поведение преследования было снижено среди обоих генотипов, за исключением пары TPH2 Het*TPH2 Ko (на 1,8% от общего времени экспозиции), однако обнюхивание аногенитальной области наблюдалось среди всех пар: разница между испытуемыми резидентами Wt и TPH2 Het значительно отличалась только в парах с TPH2 Ko (Wt* TPH2 Ko на 46,2% больше; p=0,374).
Обсуждение
Выявленные нарушения в эстральном цикле гетерозиготных самок TPH2, в частности более длительная стадия диэструса и как следствие сокращение циклов, могут быть обусловлены репродуктивной дисфункцией и повышением эндогенного гормона прогестерона, что было показано в других исследованиях [10–12]. В связи с выявленной особенностью для реализации более успешного разведения необходимо тщательно контролировать регулярность цикла цитологическим методом.
Использование ольфакторных сексуальных стимулов (запаха мочи) и пар между одиночными самцами и самками мышей показало, что влияние генного фактора не задействовано в определении сексуальных предпочтений, что также показано в других исследованиях [13, 14]. Выявлено, что самцы TPH2 Het (наивные и опытные) и опытные самцы Wt в бинарном тесте на сексуальные предпочтения в основанном только на обонятельной информации проявили значительно больший интерес к наивным самкам как TPH2 Het, так и Wt. Следует отметить значительные расхождения с источниками литературы в этом вопросе: большая часть публикаций основана на предпочтении испытуемыми самцами и самками опытных партнеров, у которых более высокая секреция половых гормонов, определяющих репродуктивное преимущество [8, 12–14]. Хотя данных о выборе сексуально неопытных животных недостаточно, можно предположить, что такая тенденция, возможно, связана c прямой корреляцией стероидных гормонов и центрального серотонина [11]. Полученные результаты еще требуют дальнейших исследований для объяснения выбора испытуемыми животными сексуально наивных партнеров.
При исследовании социальных взаимодействий самки TPH2 Het демонстрировали меньшие по количеству, но более продолжительные физические контакты без признаков агрессии по сравнению с самками дикого типа. Также самки TPH2 Het не проявляют агрессивного конкурирующего поведения при парном контакте с самками, что говорит о возможности гаремного разведения животных, где к одному самцу подсаживают двух самок и более. У самцов TPH2 Het зафиксированы единичные приступы агрессивных атак, также выявлены повышенный интерес и время обнюхивания по отношению к особям других генотипов как среди самцов TPH2 Het, так и среди самцов дикого типа, что также согласуется с другими исследованиями [8, 10, 12, 15].
Таким образом, можно предположить, что фенотип поведенческой расторможенности мышей TPH2 Het не влияет на половую активность и предпочтения.
Заключение
Показано социальное и сексуальное поведение гетерозиготных нокаутных мышей по гену TPH2. Таким образом, при подборе концепции успешного разведения в период до ссаживания мышей TPH2 Het выявлены следующие ключевые моменты: нерегулярный эстральный цикл самок TPH2, стадии которого необходимо оценивать цитологически; при формировании гаремных групп следует учитывать обонятельные предпочтения мышей.
Благодарности
Работа выполнена при поддержке исследовательского гранта Rus-LASA (№443, дата соглашения 04.03.2021). Project was supported by Russian Laboratory Animal Science Association research grant (# 443, date of Agreement 04.03.2021).
Вклад авторов
Е.Р. Василевская – концептуализация, анализ данных, редактирование текста.
А.А. Кибиткина – методология, исполнение, сбор и анализ данных, написание текста статьи.
Г.С. Толмачева – исполнение, сбор данных, редактирование текста статьи.
Л.В. Федулова – административное сопровождение проекта, просмотр и редактирование текста статьи.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- FELASA working group on revision of guidelines for health monitoring of rodents and rabbits, Mähler Convenor M., Berard M., Feinstein R., Gallagher A., Illgen-Wilcke B., Pritchett-Corning K., Raspa M. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units // Lab Anim. – 2014; 48(3): 178-192. doi:10.1177/0023677213516312
- Auth C.S., Weidner M.T., Popp S., Strekalova T., Schmitt-Böhrer A.G., van den Hove D., Lesch K.P., Waider J. Differential anxiety-related behaviours and brain activation in Tph2-deficient female mice exposed to adverse early environment // Eur Neuropsychopharmacol. – 2018; 28(11): 1270-1283. doi:10.1016/j.euroneuro.2018.07.103
- Zhang S., Liu Y., Rao Y. Serotonin signaling in the brain of adult female mice is required for sexual preference // Proc Natl Acad Sci U S A. – 2013; 110(24): 9968-9973. doi:10.1073/pnas.1220712110
- Gutknecht L., Waider J., Kraft S., Kriegebaum C., Holtmann B., Reif A., Schmitt A., Lesch, K.P. Deficiency of brain 5-HT synthesis but serotonergic neuron formation in Tph2 knockout mice // J Neural Transm (Vienna). – 2008; 115(8): 1127-1132. doi:10.1007/s00702-008-0096-6
- Alenina N., Kikic D., Todiras M., Mosienko V., Qadri F., Plehm R., Boyé P., Vilianovitch L., Sohr R., Tenner K., Hörtnagl H., Bader M. Growth retardation and altered autonomic control in mice lacking brain serotonin // Proc Natl Acad Sci U S A. – 2009; 106(25): 10332-10337. doi:10.1073/pnas.0810793106
- Mosienko V., Bert B., Beis D., Matthes S., Fink H., Bader M., Alenina N. Exaggerated aggression and decreased anxiety in mice deficient in brain serotonin // Transl Psychiatry. – 2012; 2(5): e122. doi:10.1038/tp.2012.44
- Pelosi B., Pratelli M., Migliarini S., Pacini G., Pasqualetti M. Generation of a Tph2 Conditional Knockout Mouse Line for Time- and Tissue-Specific Depletion of Brain Serotonin // PLoS One. – 2015; 10(8): e0136422. doi:10.1371/journal.pone.0136422
- Huo Y., Zhang Y., Guo H., Liu Y., Fang Q., Zhang, J. Correction: Tph2-/- female mice restore socio-sexual recognition through upregulating ERα and OTR genes in the amygdala // PLoS One. – 2018; 13(3): e0195245. doi:10.1371/journal.pone.0195245
- Caligioni C.S. Assessing reproductive status/stages in mice // Curr Protoc Neurosci. – 2009; Appendix 4: Appendix-4I. doi:10.1002/0471142301.nsa04is48
- Beis D., Holzwarth K., Flinders M., Bader M., Wöhr M., Alenina, N. Brain serotonin deficiency leads to social communication deficits in mice // Biol Lett. – 2015; 11(3): 20150057. doi:10.1098/rsbl.2015.0057
- Del Río J.P., Alliende M.I., Molina N., Serrano F.G., Molina S., Vigil P. Steroid Hormones and Their Action in Women's Brains: The Importance of Hormonal Balance // Front Public Health. – 2018; 6: 141. doi:10.3389/fpubh.2018.00141
- Barth C., Villringer A. Sacher J. Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods // Front Neurosci. – 2015; 9: 37. doi:10.3389/fnins.2015.00037
- Shulman L.M., Spritzer M.D. Changes in the sexual behavior and testosterone levels of male rats in response to daily interactions with estrus females // Physiol Behav. – 2014; 133: 8-13. doi:10.1016/j.physbeh.2014.05.001
- Giammanco M., Tabacchi G., Giammanco S., Di Majo D., La Guardia M. Testosterone and aggressiveness // Med Sci Monit. – 2005; 11(4): RA136-RA145.
- Kumar V., Vasudevan A., Soh L.J., Le Min C., Vyas A., Zewail-Foote M., Guarraci F.A. Sexual attractiveness in male rats is associated with greater concentration of major urinary proteins // Biol Reprod. – 2014; 91(6): 150. doi:10.1095/biolreprod.114.117903



