Методы визуализации и исследования кишечно-ассоциированной лимфоидной ткани лабораторных животных
Беляева Е.В., Гущин Я.А. Методы визуализации и исследования кишечно-ассоциированной лимфоидной ткани лабораторных животных. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-09
Резюме
Иммунная система играет огромную роль в жизнедеятельности животного организма, так как предотвращает попадание чужеродных тел и веществ или максимально быстро удаляет их. Ее элементы встречаются во всех системах органов в виде различных лимфоидных образований или отдельных клеток. Одной из важных составляющих органов иммунитета является лимфоидная ткань, ассоциированная со слизистыми оболочками. Самый крупный ее отдел – кишечно-ассоциированная лимфоидная ткань, ведь около 80% всех иммунокомпетентных клеток организма связывается со слизистой оболочкой кишечника. Любое токсическое воздействие на организм проявляется экспрессией или супрессией иммунных реакций организма, при этом не имеет клинических симптомов. В связи с этим тщательный анализ лимфоидной ткани чрезвычайно важен в доклинических исследованиях.
Цель данной работы – анализ существующих методов визуализации и исследования кишечно-ассоциированной лимфоидной ткани, а также выбор наиболее оптимальных методов для дальнейшего использования их в экспериментах. Рассмотрены некоторые макроскопические методы исследования, один из которых был осуществлен на практике. Для этого использовали органы самцов и самок крыс и кроликов. Ввиду того что поэтапного описания выбранного метода в источниках литературы не сохранилось, опытным путем был выявлен наиболее оптимальный способ окраски нативных препаратов кишечника для дальнейшего макроскопического исследования кишечно-ассоциированной лимфоидной ткани. Также был описан и показан наиболее информативный метод гистологического исследования не только лимфоидной ткани кишечника, но и его слизистой оболочки. В этом случае на изготовление гистологических срезов отбирали все отделы кишечника, благодаря чему в дальнейшем можно было изучить практически всю поверхность слизистой оболочки органа, а также подробно рассмотреть все лимфоидные образования кишечника микроскопически. Полученные результаты дают возможность расширить методы визуализации и исследования иммунотоксичности различных препаратов в доклинических исследованиях. Кроме того, их можно использовать при подробном изучении строения иммунной системы животного организма.
Введение
У млекопитающих одной из основных систем, осуществляющих защиту организма от патогенных воздействий, является иммунная система. [1]. Один из крупных периферических отделов – кишечно-ассоциированная лимфоидная ткань (The gut-associated lymphoid tissue – GALT). Около 80% всех иммунокомпетентных клеток организма ассоциировано со слизистой оболочкой кишечника [2]. GALT является важной частью лимфоидной ткани, ассоциированной со слизистыми оболочками (the mucosa-associated lymphoid tissue – MALT). Защита всех внутренних и наружных эпителиальных покровов организма осуществляется при помощи MALT, которая состоит из лимфоидных тканей и органов, расположенных непосредственно под эпителием слизистой оболочки [3, 4]. GALT играет огромную роль в деятельности желудочно-кишечного тракта, так как предотвращает попадание чужеродных агентов в организм, но в то же время позволяет проходить питательным веществам из просвета кишечника [5]. Также лимфатическая ткань кишечника выполняет жизненно важные функции в регуляции гомеостаза тканевой жидкости [6]. Среди лимфоидных образований кишечника выделяют групповые лимфоидные узелки (пейеровы бляшки). В настоящее время определены их существенная роль в формировании иммунного ответа, участие в лимфоцитопоэзе и рециркуляции лимфоцитов [7, 8]. Пейеровы бляшки представляют собой структурно организованные и оформленные скопления лимфоидных клеток в подслизистом слое кишечника. Помимо бляшек, в кишечно-ассоциированную лимфоидную ткань входят солитарные лимфоидные фолликулы, которые содержатся в слизистой оболочке и подслизистой основе кишечника, но не имеют тесной связи с эпителием [9]. Они представляют собой скопления диффузной лимфоидной ткани, образованы ретикулярной тканью и множеством средних и малых лимфоцитов, малодифференцированных клеток и макрофагов [10].
Основной задачей изучения влияния лекарственных средств на иммунную систему является доказательство или опровержение возможности развития иммунотоксического действия. Особенно это важно при тестировании новых фармакологических средств, а также уже известных средств, о которых отсутствуют данные относительно их иммунотоксичности. Исходя из вышесказанного, можно сделать вывод, что исследования иммунной системы, в том числе GALT, играют важную роль в доклинических исследованиях, так как позволяют изучить влияние потенциальных лекарственных средств на лимфоидную ткань. В связи с этим необходимо пользоваться наиболее эффективными и показательными методами обнаружения и исследования лимфоидной ткани и, если с основными органами иммунитета все достаточно просто – они легко обнаруживаются невооруженным глазом у всех видов лабораторных животных, то с GALT могут возникнуть трудности. В связи с этим мы изучили существующие методы визуализации кишечно-ассоциированной лимфоидной ткани и выбрали наиболее подходящий для нас.
Материал и методы
Апробация методов визуализации и исследования кишечно-ассоциированной лимфоидной ткани проводили в «НПО «Дом Фармации», в качестве биологических тест-систем использовали самцов и самок лабораторных крыс (n=10) и кроликов (n=2). Для исследования отбирали животных контрольных групп, подлежащих плановой эвтаназии в ходе текущих экспериментов, специально для отработки методик животных не использовали. Эвтаназию проводили, применяя СО2-камеры (крысы) и передозировку анестетиков (кролики) в соответствии с директивой 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.2010 г. по охране животных, используемых в научных целях [11, 12]. После установления факта смерти проводили некропсию с извлечением органов, при которой участки кишечника отбирали на апробацию окраски по Хелману [13] и проведение метода Swiss-roll [13], которые описаны далее.
Существующие модели
Один из самых простых методов – макроскопическое исследование пейеровых бляшек. Однако у него есть значительный минус – его эффективно использовать на крупных лабораторных животных, таких как кролики, хорьки, карликовые свиньи, так как у них бляшки хорошо визуализируются. Большими плюсами являются отсутствие необходимости использовать какие-либо дополнительные инструменты, приборы или красители, а также возможность экономии времени. В основе метода лежит макроскопическое исследование либо нативного препарат кишечника, либо зафиксированного в 10% забуференном растворе формалина. Для этого сразу после эвтаназии животного необходимо извлечь весь кишечник целиком, содержимое удалить и промыть орган водой или физиологическим раствором, сделать разрез кишечника по всей длине и исследовать поверхность слизистой оболочки. Пейровы бляшки обнаруживаются в виде выступающих над поверхностью овальных или круглых образований. Необходимо подсчитать их количество, измерить длину и ширину. То же самое можно проводить и с зафиксированным органом [1, 5].
В 2011 г. сотрудниками кафедры гистологии, цитологии и эмбриологии ЛугГМУ (Луганский государственный медицинский университет) был разработан экспресс-метод нативной окраски кишечника соком вишни и красной смородины для выявления пейеровых бляшек. Метод основывается на способности природных красителей, в данном случае флавоноидов, содержащихся в вишне и черной смородине, окрашивать ткани, окружающие иммунные органы, без изменения цвета последних, при этом результаты готовы уже через несколько минут. Для этого необходимо извлечь кишечник по стандартной методике, произвести разрез по всей его длине, поместить орган в сок вишни и черной смородины. В результате уже через 5 мин участок кишечника, за исключением лимфоидной ткани, равномерно окрашивается в ярко-розовый цвет. Через 10 мин неизмененные пейеровы бляшки контрастно выделяются на фоне малиново-розовой окраски. После этого необходимо поместить окрашенный орган в дистиллированную воду, после чего границы узелков визуализируются еще более отчетливо. Данный метод занимает незначительное количество времени, а также прост и экономичен в использовании [14].
Существует более сложный способ выявления лимфоидной ткани, при котором на одном биологическом объекте одновременно можно обнаружить и микроциркуляторное русло кишечника, а также установить их взаимоотношение. Для этого без извлечения кишечника из брюшной полости необходимо вначале провести промывку сосудов органа раствором глюкозы с гепарином, предварительно перевязав воротную вену, затем заполнить сосуды 0,15% раствором азотнокислого серебра через брюшную аорту. В течение всей наливки сосудов необходимо поместить кишечник в теплый физиологический раствор и воздействовать на него ультразвуком с частотой колебания 830 кГц с целью снятия спазма сосудов, предохранения от разрывов, а также для ускорения заполнения интерстиция и лимфатических сосудов. Далее кишечник надо отсечь и извлечь из брюшной полости, нитрат серебра восстановить на свету или с помощью кварцевой лампы до металлического серебра. Орган кратковременно обработать 1,5% раствором хлористого натрия, просветлить 1% раствором соляной кислоты в течение 1–2 сут, окрасить гематоксилином Гарриса не более 12 ч, повторно обработать 0,1% раствором соляной кислоты 1–2 ч для дифференцировки лимфоидной ткани. В результате окраски все звенья микроциркуляторного русла и лимфоидная ткань кишечника выявляются одновременно: микроциркуляторное русло хорошо визуализируется, лимфоидные узелки четко просматриваются на фоне неокрашенной окружающей ткани. Большое преимущество данного метода заключается в том, что сокращается время и количество лабораторных животных, используемых в экспериментах, за счет использования одного препарата для одновременного выявления микроциркуляторного русла и лимфоидной ткани кишечника. Однако весь процесс занимает достаточно большое количество времени, при этом требуется наличие дополнительного оборудования [15].
В наших условиях для макроанатомического исследования кишечно-ассоциированной лимфоидной ткани более удобен и информативен метод T. Hellman. Изучив литературу по похожим темам, установили, что данный метод интерпретируют по-разному. Исходя из этого, мы проверили сразу все найденные способы и определили самый эффективный из них.
Результаты и обсуждение
Мы проводили апробацию метода на кишечнике лабораторных крыс и кроликов. Вид животного в итоге не повлиял на этапы окраски препарата. Изначально брали нативные препараты тонкой и толстой кишки, разделяли на отдельные участки, разрезали каждый участок по брыжеечному краю. Расправленные участки при помощи швейных ниток прикрепляли к кусочкам картона слизистой оболочкой наверх. Далее помещали препараты в 3% уксусную кислоту, которую готовили из 70% путем добавления 22 частей воды к 1 части кислоты. В данном растворе кишечник находился 16 ч (некоторые источники литературы указывают, что в уксусной кислоте можно хранить препарат до 18 ч). Затем промывали орган в проточной воде в течение 2 ч, помещали в 1% раствор гематоксилина на 19–24 ч (во всех случаях окраска получалась качественная). Однопроцентный гематоксилин готовили в условиях лаборатории из гематоксилина Джила, при этом к 99 частям воды добавляли 1 часть красителя. В первоисточнике указано, что необходимо использовать гематоксилин Гарриса, но гематоксилин Джила также окрасил лимфоидную ткань. Далее снова промывали препарат в проточной воде в течение 2 ч и проводили макроанатомическое исследование. На препаратах кишечника на всем протяжении обнаруживали окрашенные в ярко-фиолетовый цвет округлые образования лимфоидной ткани на фоне слабоокрашенной в светло-фиолетовый цвет окружающей слизистой оболочки. Используя детальное исследование, при данном способе окраски можно определить синтопию, количество, измерить длину, ширину и толщину отдельных лимфоидных образований. После исследований при необходимости мы рекомендовали бы хранить препарат в 10% забуференном растворе формалина в течение нескольких недель, так как при длительном хранении краситель вымывается. При хранении препарата в 3% растворе уксусной кислоты более 3 сут происходит расплавление тканей и активное вымывание красителя [13, 16, 17].
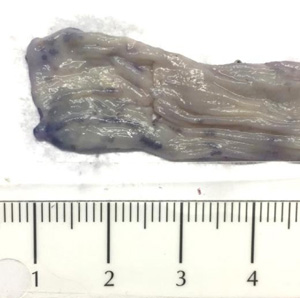
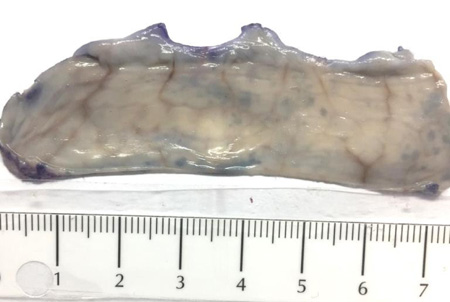
При макроскопическом исследовании окрашенных препаратов установлено, что лимфоидные образования в кишечнике крыс и кроликов имеют округлую или неправильную форму, окрашиваются в светло-фиолетовый цвет, размер у крыс 0,1–0,3 см, у кроликов 0,1–0,8 см, располагаются друг от друга на расстоянии от 0,1 до 1,5 см (рис. 1, 2). В изученной литературе не обнаружили подробного описания внешнего вида лимфоидных образований кишечника лабораторных крыс и кроликов при окрашивании нативных препаратов.
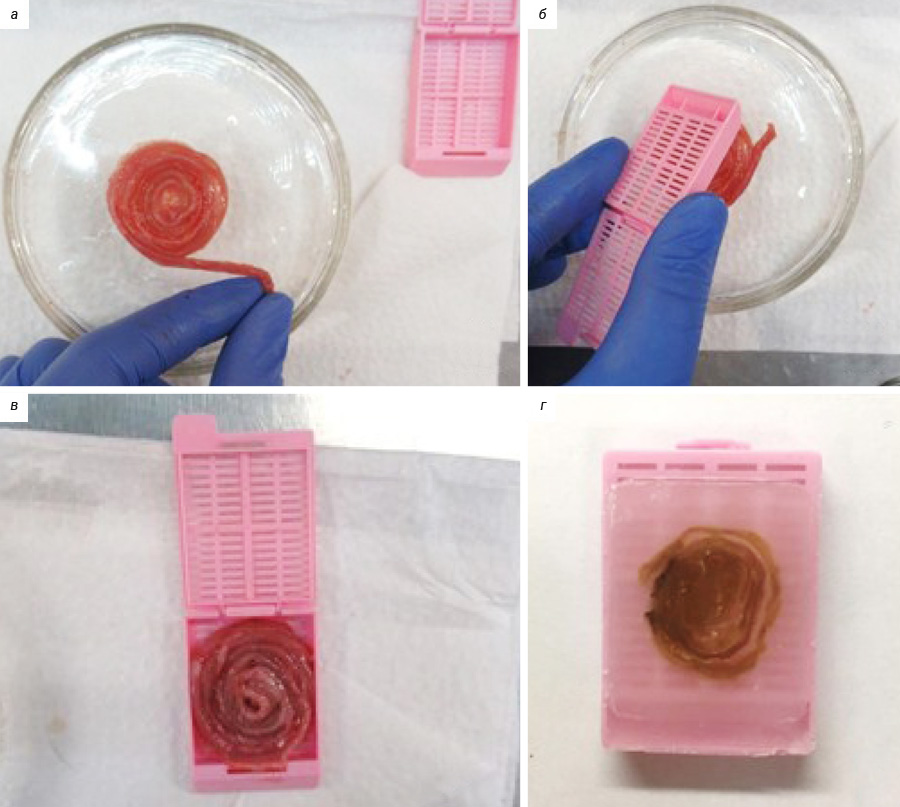
В случае необходимости тщательного гистологического исследования слизистой оболочки и лимфоидной ткани кишечника отбираем весь кишечник при помощи метода Swiss-roll. Для чего надо эвисцерировать все отделы кишечника, за исключением слепой кишки, если в этом нет такой необходимости. Это объясняется тем, что слепая кишка имеет достаточно большой диаметр просвета, что в дальнейшем может послужить возникновению артефактов, связанных с изготовлением срезов. Далее необходимо разделить оставшуюся длину кишечника на 3–4 части (в зависимости от длины), промыть фиксирующей жидкостью при помощи шприца и приступать к самому методу. Метод Swiss-roll используется для детального изучения слизистой оболочки и лимфоидной ткани микроскопически, при этом в срез попадают практически все лимфоидные образования кишечника. Метод основан на укладке значительного отрезка кишечника в виде тесной спирали и помещении его в гистологическую кассету. Изначально данная техника была подробно описана C. Moolenbeek, E.J. Ruitenberg в 1981 г., однако метод был не совсем удобным в использовании ввиду отсутствия в то время привычных гистологических методик [18]. В 2016 г. A.B. Bialkowska и соавт. модифицировали метод, в результате чего он позволяет своевременно и эффективно отбирать и подготавливать кишечный эпителий и лимфоидную ткань для дальнейших исследований. Сам процесс «скручивания» в источнике описан достаточно подробно: при помощи анатомического пинцета и зубочистки необходимо закрутить участок кишечника в «рулет» и поместить в гистологическую кассету [19]. На практике можно модернизировать метод и закручивать орган как удобно конкретному исследователю. Например, мы используем перевернутую вверх дном чашку Петри, слегка смачиваем поверхность физиологическим раствором воизбежание прилипания кишечника к поверхности, руками закручиваем участок кишечника в виде спирали (рис. 3,А), закрываем сверху орган гистологической кассетой (рис.3 Б) и аккуратно переносим орган в нее (рис. 3 В). Далее по стандартной методике помещаем кассету в 10% забуференный раствор формалина, фиксируем в течение 24 ч, после чего по общепринятой методике заливаем в парафин (рис. 3 Г), изготавливаем срезы толщиной 5–7 мкм, которые окрашиваем гематоксилином и эозином (рис. 4) и проводим анализ гистологических препаратов при помощи светооптического микроскопа (рис. 5) [20]. На протяжении всего кишечника определяются единичные и множественные пейеровы бляшки и солитарные фолликулы.
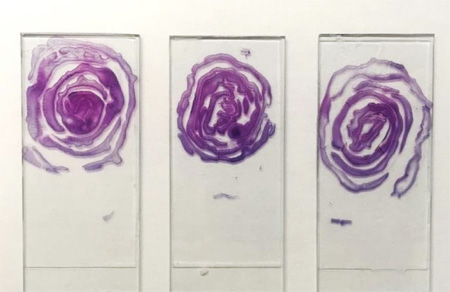
При гистологическом исследовании установлено, что лимфоидная ткань кишечника представлена одиночными или сгруппированными лимфоидными узелками, расположенными в подслизистом слое или в собственной пластинке слизистой оболочки. Основными клеточными элементами образований являются лимфоциты, которые имеют крупное, округлое ядро, цитоплазма слабобазофильная.
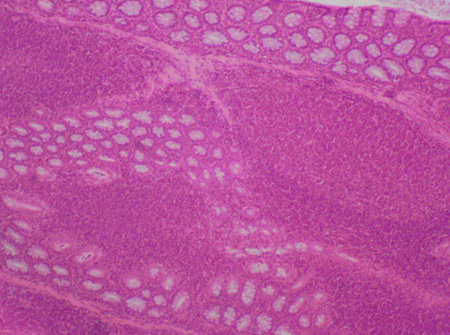
О методе Swiss-roll у разных исследователей существует разное мнение. Одни считают, что метод довольно информативный и его следует проводить в необходимых случаях. Другие говорят, что техника излишне сложная и может приводить к неудобствам в виде тангенциальных срезов, создающих неверное впечатление о структуре объектов при гистологическом исследовании [21]. Однако в нашей работе метод используется достаточно часто, так как на практике доказал свою эффективность и наглядность.
Заключение
На основании полученных данных можно констатировать, что все указанные методы визуализации и исследования кишечно-ассоциированной лимфоидной ткани имеют свои положительные и отрицательные стороны, которые по-разному интерпретируются при определенных условиях и задачах эксперимента. Однако всегда следует учитывать степень информативности способа, а также экономические затраты и потраченное время. В нашем случае наиболее оптимальными методами являются окраска нативных препаратов кишечника 1% раствором гематоксилина (T. Hellman), а также микроскопическое исследование гистологических срезов кишечника, изготовленных по способу Swiss-roll. Макроскопическое исследование окрашенной лимфоидной ткани позволяет определить синтопию, количество, измерить длину, ширину и толщину отдельных лимфоидных образований кишечника без затрат средств и времени на изготовление гистологических препаратов. При более доскональном исследовании необходимо использовать микроскопическое исследование одновременно всех отделов кишечника, которое позволяет выявить изменения, происходящие на клеточном уровне. Указанные методы дают возможность наиболее полно и эффективно получить данные о влиянии того или иного вещества на лимфоидную ткань кишечника.
Полученные результаты предоставляют возможность расширить методы исследования иммунотоксичности различных препаратов. Таким образом, их можно успешно использовать как учебный материал при изучении строения иммунной системы животного организма.
Вклад авторов
Беляева Е.Е. – сбор и систематизация материала, написание и редактирование текста статьи, подготовка фотоматериалов для статьи.
Гущин Я.А. – идея, концепция и дизайн исследования, написание и редактирование текста статьи
Список источников
- Морозова Е.Н., Морозов В.Н., Кузьмачук Д.О., Моргун Ю.А. Взгляд на морфогенез пейеровых бляшек тонкой кишки крыс// Вестник проблем биологии и медицины. Украина. 2013. №2, том 2 (101). С. 27-32 [Morozova E.N., Morozov V.N., Kuz'machuk D.O., Morgun Yu.A. Vzglyad na morfogenez peierovykh blyashek tonkoi kishki krys// Vestnik problem biologii i meditsiny. Ukraina. 2013. №2, tom 2 (101). S. 27-32 (In Russ)].
- Воронцова З.А., Никитюк Д.Б., Кудаева Э.Ф. Кишечно-ассоциированная лимфоидная ткань как информационно-корректирующая система экстремальных состояний// Вестник новых медицинских технологий, 2016. №4. 289-294. DOI: 10.12737-21854 [Vorontsova Z.A., Nikityuk D.B., Kudaeva Eh.F. Kishechno-assotsiirovannaya limfoidnaya tkan' kak informatsionno-korrektiruyushchaya sistema ehkstremal'nykh sostoyanii// Vestnik novykh meditsinskikh tekhnologii, 2016. №4. 289-294. DOI: 10.12737-21854 (In Russ)].
- Sminia T., Jeurissen S.H.M. Gut-Associated Lymphoid Tissue, Rodent, Normal Structure and Function. In: Jones T.C., Ward J.M., Mohr U., Hunt R.D. (eds). Hemopoietic System. Monographs on Pathology of Laboratory Animals. Springer. Berlin. Heidelberg. 1990 DOI: 10.1007/978-3-642-84110-1_48
- Stamvorth D. R Current concepts in hypersensitivity - – In: Immunotoxicology and Immunopharmacology /Eds. Dean J. H. et al. New York: Raven Press. 1985. P. 91-99.
- A. J. Awang-Hazmi, A. B. Z. Zuki, M. Zamri-Saad [et al.] The response of Gut Associated Lymphoid Tissues (GALT) following oral administration of P. Multocida B2 in rats // Priory Medical Journal. - – 2007. - – № 56. - – P. 1039-1045.
- Miller M.J., Newberry R.D. Microanatomy of the intestinal lymphatic system // NIH Public Access, 2011. – 1207(Suppl 1). – P. 21-28.
- Гусейнова С.Т. Морфологические изменения в лимфоидных узелках тонкой кишки при дегидратации // Морфология, 2010. №75. – С. 44-46 . [Guseinova S.T. Morfologicheskie izmeneniya v limfoidnykh uzelkakh tonkoi kishki pri degidratatsii // Morfologiya, 2010. №75. – S. 44-46 (In Russ)]
- Balmasova I. P., Sepiashvili R. I. Intestine infections, inflammation and autoimmunity. Lymphoid apparatus of intestine in interaction with intestine microflora // Zh Mikrobiol Epidemiol Immunobiol. – 2013. – № 1. – Р. 113-120.
- Норматов, Р. А., Марьяновская Ю. В. Лимфоидная ткань кишечника как основа иммунной системы пищеварительного тракта // Молодой ученый. — 2017. — № 20 (154). — С. 201-203 [Normatov, R. A., Mar'yanovskaya Yu. V. Limfoidnaya tkan' kishechnika kak osnova immunnoi sistemy pishchevaritel'nogo trakta // Molodoi uchenyi. — 2017. — № 20 (154). — S. 201-203 (In Russ)].
- Ленченко Е.М. Цитология, гистология и эмбриология // М.: «Юрайт», 2018. – 347 с [Lenchenko E.M. Tsitologiya, gistologiya i ehmbriologiya // M.: «YuraiT», 2018. – 347 s (In Russ)].
- Рыбакова А.В., Макарова М.Н. Методы эвтаназии лабораторных животных в соответствии с европейской директивой 2010/63 // Международный вестник ветеринарии. 2015. N2.С. 96-107 [Rybakova A.V., Makarova M.N. Metody ehvtanazii laboratornykh zhivotnykh v sootvetstvii s evropeiskoi direktivoi 2010/63 // Mezhdunarodnyi vestnik veterinarii. 2015. N2.S. 96-107 (In Russ)].
- Директива 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Гл. I, ст. 6 [Direktiva 2010/63/EU Evropeiskogo parlamenta i soveta Evropeiskogo soyuza ot 22.09.2010 po okhrane zhivotnykh, ispol'zuemykh v nauchnykh tselyakh. Gl. I, st. 6 (In Russ)].
- Hellman Т. Stadies uber der Lymphoide die Bedeutung der Sekundar-follikle // Beitr. z. Pathol. Anat. U. Aug. Path. 1921. – Bd. 68. 5. – P.335-365.
- Кащенко С.А. Выявление морфологических особенностей лимфоидных образований тонкой кишки при окраске нативного препарата / Мир медицины и биологии // Украина, 2011. – №1. – С. 27 – 29 [Kashchenko S.A. Vyyavlenie morfologicheskikh osobennostei limfoidnykh obrazovanii tonkoi kishki pri okraske nativnogo preparata / Mir meditsiny i biologii // Ukraina, 2011. – №1. – S. 27 – 29 (In Russ)].
- Оленева Е.В., Четверных В.А., Костицын А.С., Пономарева С.В., Мякишева Ю.В. Патент СССР №SU 1 680 088 A1, 1991.09.30. Способ выявления микроциркуляторного русла и лимфоидной ткани кишечника // 4461629, 1988.07.15 [Oleneva E.V., Chetvernykh V.A., Kostitsyn A.S., Ponomareva S.V., Myakisheva Yu.V. Patent SSSR №SU 1 680 088 A1, 1991.09.30. Sposob vyyavleniya mikrotsirkulyatornogo rusla i limfoidnoi tkani kishechnika // 4461629, 1988.07.15 (In Russ)]
- Жданова О.Б., Ашихмин С.П., Параманова А.Н. [и др.] Новые методологические решения в патоморфологии гельминтозов // Российский паразитологический журнал, 2010. – № 4. – С. 74–82 [Zhdanova O.B., Ashikhmin S.P., Paramanova A.N. [i dr.] Novye metodologicheskie resheniya v patomorfologii gel'mintozov // Rossiiskii parazitologicheskii zhurnal, 2010. – № 4. – S. 74–82 (In Russ)].
- Кокорина А.Е., Беспятых О.Ю. Макроанатомические изменения лимфоидной ткани тонкого кишечника лисицы и песца под влиянием янтарной кислоты // Аграрная наука Евро-Северо-Востока, 2011. – №5 (24). – С. 49-53 [Kokorina A.E., Bespyatykh O.Yu. Makroanatomicheskie izmeneniya limfoidnoi tkani tonkogo kishechnika lisitsy i pestsa pod vliyaniem yantarnoi kisloty // Agrarnaya nauka Evro-Severo-Vostoka, 2011. – №5 (24). – S. 49-53 (In Russ)].
- Moolenbeek C., Ruitenberg E.J. The «Swiss roll»: a simple technique for histological studies of the rodent intestine // Laboratory Animals, 1981. – №15. – P. 57-59.
- Bialkowska A. B., Nandan M., Ghaleb Amr. M., Yang V.W. Improved Swiss-rolling Technique for Intestinal Tissue Preparation for Immunohistochemical and Immunofluorescent Analyses // Journal of Visualized Experiments, 2016. – №113.
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных. // Международный вестник ветеринарии, 2014. – № 2. – С. 103-109 [Muzhikyan A.A., Makarova M.N., Gushchin Ya.A. Osobennosti gistologicheskoi obrabotki organov i tkanei laboratornykh zhivotnykh. // Mezhdunarodnyi vestnik veterinarii, 2014. – № 2. – S. 103-109 (In Russ)].
- Манских В.Н. Патоморфология лабораторной мыши: в 3-х т.; Т. 1. Технические аспекты. Общая и органная патология. – М.:ВАКО, 2016. – 208 с [Manskikh V.N. Patomorfologiya laboratornoi myshi: v 3-kh t.; T. 1. Tekhnicheskie aspekty. Obshchaya i organnaya patologiya. – M.:VAKO, 2016. – 208 s (In Russ)].



