Применение дополнительных гистологических методов окраски в доклинических исследованиях
Гущин Я.А. Применение дополнительных гистологических методов окраски в доклинических исследованиях. Лабораторные животные для научных исследований. 2019; 4. https://doi.org/10.29296/2618723X-2019-04-07
Резюме
В клинической практике и при фармакологических исследованиях микроскопический анализ является неотъемлемой частью изучения, как нормального строения тканей, так и патологически измененных органов. Один из основных этапов подготовки материала к гистологическому исследованию – визуализация, которая достигается окрашиванием структур тканей красителями. Чаще применяют обзорную окраску гематоксилином и эозином, которой недостаточно для раскрытия полной картины процесса. Поэтому необходимо использовать ряд дополнительных окрасок. Часть из них можно применять как обзорные и заменить ими классические гематоксилин и эозин, например окраски по Ван Гизону или трихром по Маллори. Большая часть окрасок более специфична, и они служат для выявления конкретных структур или химических соединений в клетках и тканях. Это позволяет получить значительный объем информации, что облегчает понимание течения как нормальных, так и патологических процессов. Методики выявления мукополисахаридов альциановым синим применяются при исследовании желудочно-кишечного тракта и дыхательной системы. ШИК-реакция необходима в диагностике болезней накопления, ряда онкологических процессов и грибковых инфекций. «Жировые красители», прежде всего судан III и шарлах красный, используются повсеместно при исследовании дистрофических заболеваний и атеросклероза. Краситель Oil Red O применим для макроскопической оценки площади атеросклеротического поражения аорты. Конго красный незаменим для обнаружения амилоида. Рассмриваются специализированные окраски, направленные на диагностику повреждений миокарда (ГОФП-методика и применение солей тетразолия) для визуализации площади поражения сердечной мышцы и головного мозга.
В данном обзоре рассматривается ряд гистологических окрасок, некоторые особенности их применения, а также механизмы взаимодействия краситель–субстрат в тканях. Данные методы можно, а часто и необходимо использовать при гистологической работе. Исследователям при планировании следует учитывать возможность их применения, что поможет выявлять, а также всесторонне изучать патологические процессы, моделируемые в доклинических исследованиях.
Введение
Неотъемлемая часть доклинических исследований – патоморфологическое изучение экспериментальных животных, сначала макроскопическое – органов и систем органов, а в последующем микроскопическое – отдельных органов и тканей. Именно гистологическое исследование позволяет более точно определить патологические процессы, выявить ткани-мишени, механизм и степень их повреждения. Основным этапом подготовки материала к гистологическому исследованию является визуализация, которая достигается окрашиванием структур тканей красителями. Цель окрашивания – более четкое выделение различных компонентов клеток и тканей [2].
Общие механизмы окрашивания тканей и клеточных структур
Существует много классификаций красителей; их делят в зависимости от их химической природы [3], в зависимости от реакции с субстратом на субстантивные (прямые) и адъективные (непрямые) [4, 5]. Однако чаще применяют деление на основные или базофильные (ядерные), кислые или ацидофильные (цитоплазматические), нейтральные и флюорохромы [2, 3]. По механизму действия красителя со структурами тканей и клеток выделяют ионное взаимодействие, слабые электрические взаимодействия, ковалентное связывание, взаимодействие с металлами и др.
Ионное взаимодействие – самое распространенное и сильное, но оно чувствительно к pH среды и концентрации солей. Так, например, катионные красители при pH 5 будут окрашивать почти все структуры, поскольку карбоксильные группы белков хорошо ионизированы, при pH 4 окрашиванию подвергаются ядра клеток и хрящевая ткань, а при pH 1 слабые фосфорно-кислые группы ДНК не ионизируются, и ядра будут плохо визуализированы. При увеличении концентрации солей в растворе, наблюдается конкуренция между ионами солей и ионами красителя за субстрат и окрашивание будет менее эффективно. Также при высоких концентрациях солей в растворе наблюдается агрегация частиц красителя в коллоидные частицы, что затрудняет их диффузию к субстрату и окрашивание также будет менее эффективно. Электронное взаимодействие слабее ионного, поэтому можно рассматривать 2 основных механизма – водородные связи, силы Ван дер Ваальса и гидрофобное связывание [6, 7].
Водородные связи обеспечивают прикрепление анионов красителей к незаряженным субстратам в тканях (например, целлюлоза с множеством ОН-групп и коллаген, богатый NH и NH2-групп). В водных растворах большая часть молекул кислорода и азота уже связаны с молекулами воды, и в данном случае взаимодействие обусловлено силами Ван дер Ваальса [6].
Гидрофобное окрашивание является следствием взаимодействия водородных связей молекул воды и агрегации гидрофобных участков молекул силами дисперсионного взаимодействия (силами Лондона), которые из области высокой концентрации (краситель) поступают в область низкой концентрации (клетки), где удерживаются слабыми силами Ван дер Ваальса [6, 7].
Хорошим примером ковалентных связей является реактив Шифа в реакциях PAS (Periodic acid – Schiff reaction), который взаимодействует с альдегидными группами, образуя окрашенный продукт [7]. Другой пример – образование ковалентных связей между органическими группировками и ионами металлов. Так, ализариновый красный образует в тканях хелатные комплексы с ионами кальция, а гематоксилин, являясь комплексом гематина с ионами алюминия, взаимодействует, вероятно, с амино- и гуанидино-группами ДНК в ядре, что и придает ему синий цвет [7].
Как видно существует много вариантов взаимодействия красителя с субстратом; они различаются специфичностью и условиями использования и служат для достижения своих, подчас узкоспециализированных, задач. Однако в рутинной гистологии главной и основной окраской остается методика с применением гематоксилина и эозина. Это простой, дешевый и повсеместно используемый метод, который имеет много модификаций и может применяться в большинстве случаев. Именно поэтому его еще называют обзорной окраской. Но подчас этого недостаточно и тогда необходимы дополнительные методы [8, 9], которые в значительной мере улучшат качество не только диагностики заболеваний, но и качество исследовательских работ с привлечением гистологических методов.
Рассмотрим ряд гистологических окрасок, некоторые особенности их применения, а также механизмы взаимодействия краситель-субстрат в тканях. Данные методики можно, а часто и необходимо, использовать при гистологической работе, а исследователям при планировании следует учитывать возможность их применения, что поможет выявлять, а также всесторонне изучать патологические процессы, моделируемые в доклинических исследованиях.
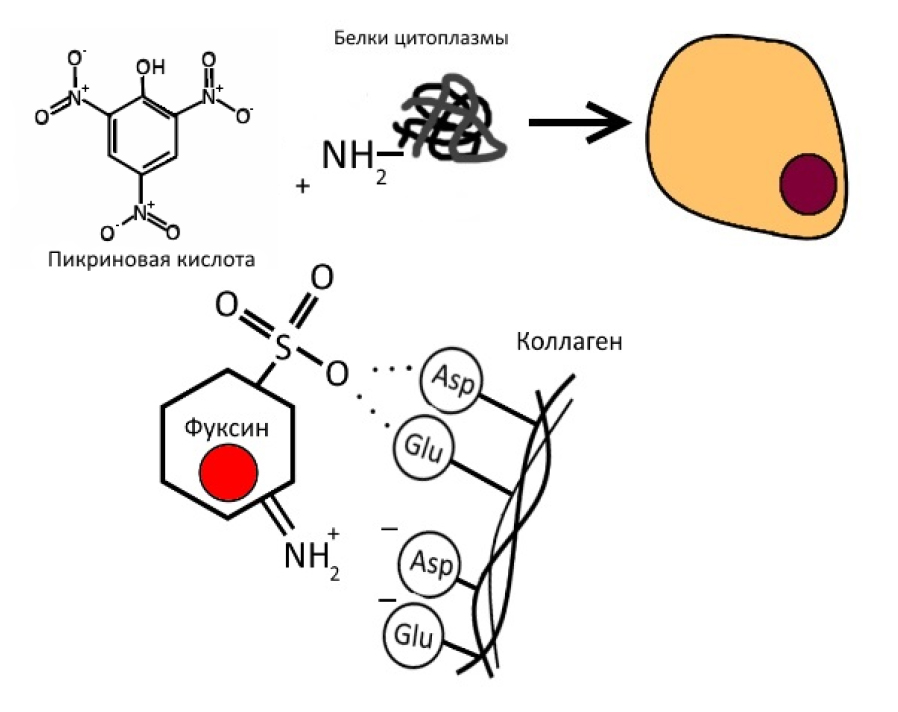
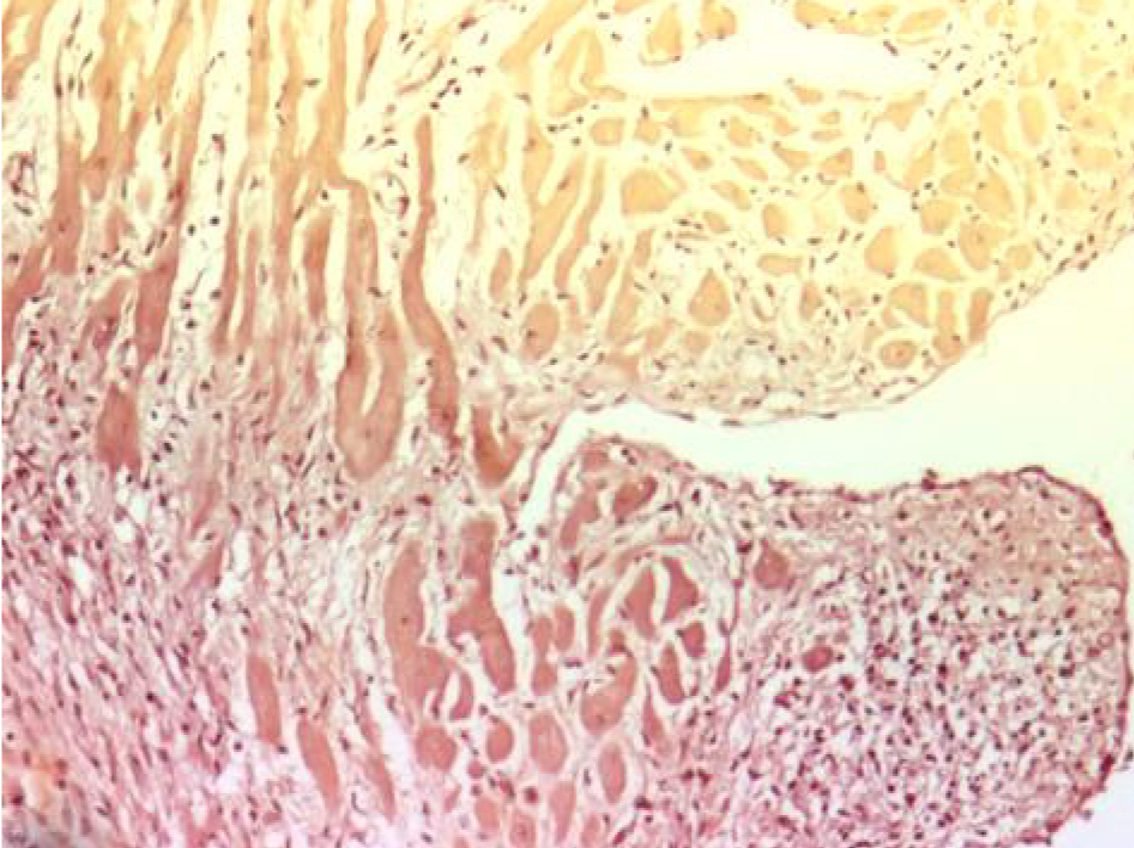
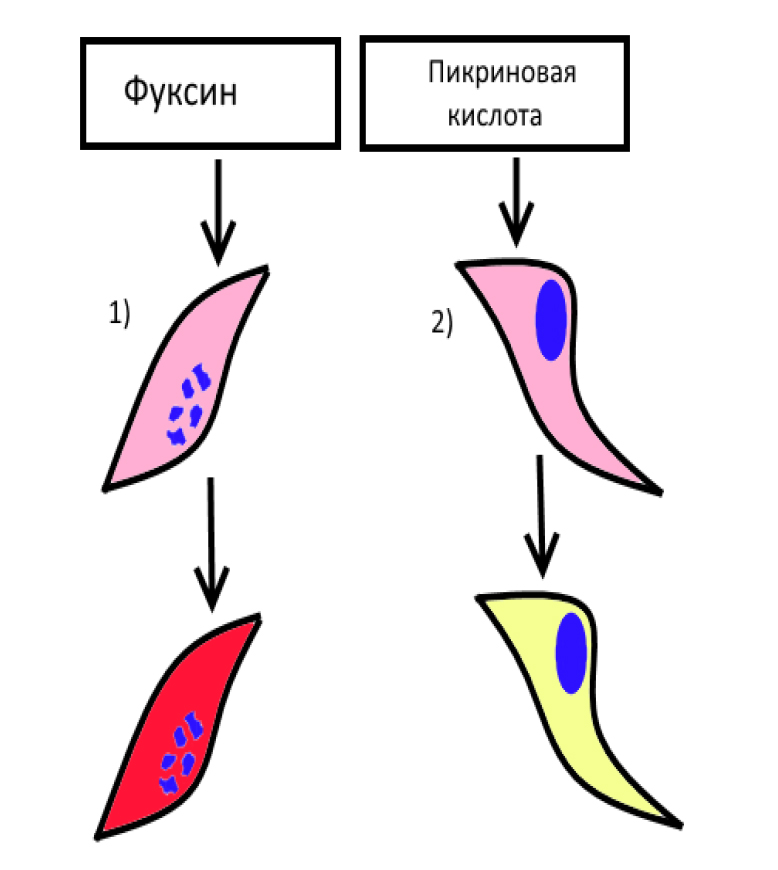
Окраска соединительной ткани. Окраска соединительной и мышечной тканей гематоксилин-пикрофуксином по методу Ван Гизона (рис. 1). Это второй наиболее часто используемый в гистологической практике метод. Им можно заменить окраску гематоксилин-эозином и применять как основной для получения обзорных препаратов, но все же чаще он дополняет исследование [10]. Этот метод имеет ряд преимуществ по сравнению с окраской гематоксилин-эозином, так как по-разному окрашивает различные ткани: соединительная ткань после окраски пикрофуксином имеет ярко-красный цвет, а все остальные ткани – буровато-желтый или желто-зеленый. Механизм действия основан на большем сродстве кислого фуксина к коллагену, что, с одной стороны, объясняется параллельной волокнистой организацией белка, открывающей большое количество пептидных групп, содержащих карбоксильные аминокислоты (аспарагиновую и глутаминовую), легко образовывающих водородные связи с красителем, а, с другой стороны, наличием ионных связей, которые могут быть нарушены обработкой ткани кислотами, т.е. дезаминированием белков. Цитоплазматическое окрашивание более характерно для пикриновой кислоты, поскольку она, за счет меньшего размера, имеет более высокую скорость диффузии в клетки, а также, являясь выраженным анионным красителем, проявляет более сильное ионное взаимодействие с положительно заряженными аминогруппами цитоплазматических белков [11] (рис. 2).
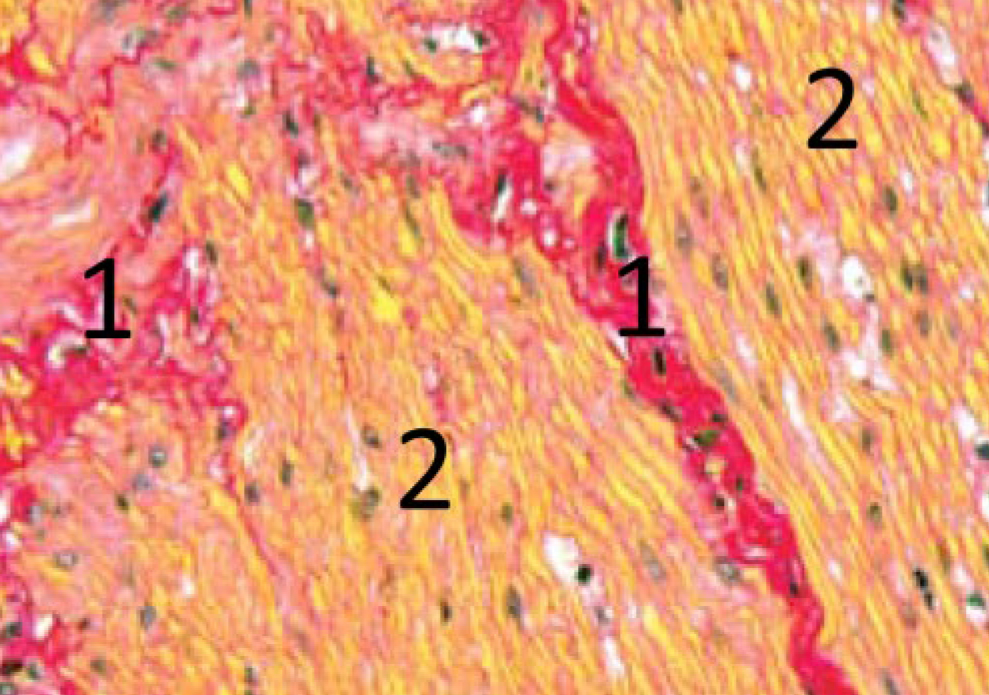
В качестве ядерной окраски можно использовать гематоксилин Майера, Эрлиха, но железный гематоксилин Вейгерта дает лучшую черную или буро-черную окраску ядер. Данный метод необходим при дифференцировке соединительной ткани от мышечной в случаях, когда их трудно различить на препаратах, окрашенных другими методами (например, при исследовании хронических заболеваний с развитием фиброза или при опухолевых процессах).
Некоторые особенности не позволили данному методу стать основным, например, необходимость контроля под микроскопом, поскольку пикрофуксин как дифференцирующее соединение, ослабляет интенсивность окраски гематоксилином, и если ядра приобретают бурый, а не черный цвет, то следует использовать более длительную экспозицию срезов в гематоксилине или меньшую в пикрофуксине [2]. Но более существенным недостатком является выцветание препаратов за счет потери окраски фуксинофильных коллагеновых волокон, а это значит, что препараты нельзя хранить длительное время [12].
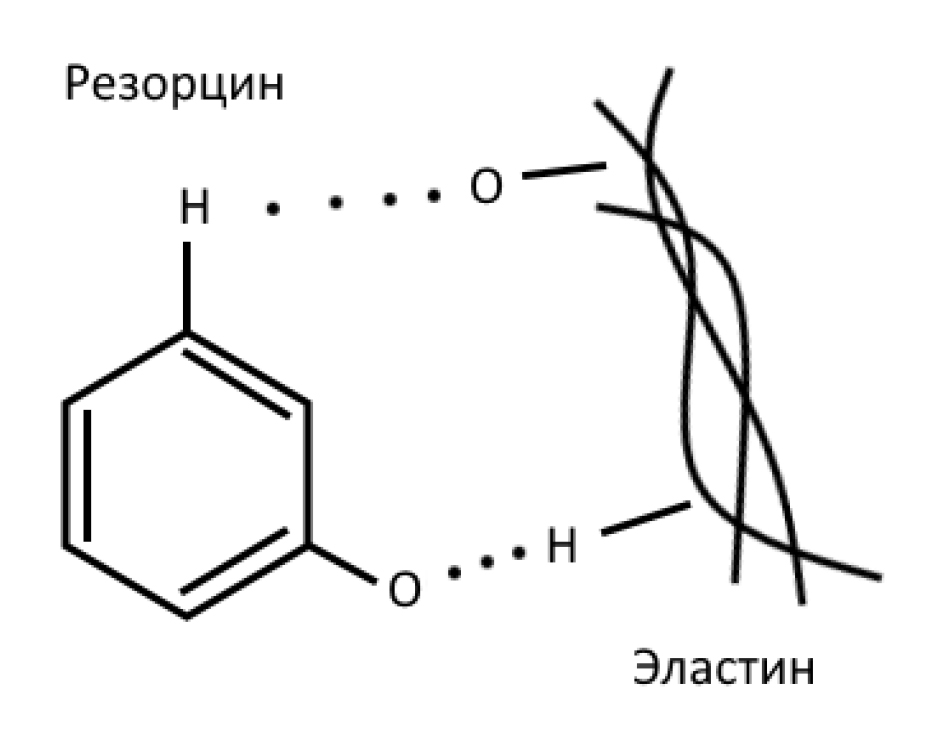
Окраска эластических волокон фуксин-резорцином по Вейгерту. Окраска (рис. 3) позволяет выявить эластические волокна в тканях, что полезно при изучении заболеваний и патологических процессов, поражающих сосуды или, например кожу. Взаимодействие между эластином и красителем осуществляется за счет сложных эфирных групп, а также путем образования водородных связей между фенольными гидроксильными группами красителя и эластином [14] (рис. 4). При этом хлорид железа, используемый при окраске, с одной стороны, взаимодействуя с резорцином, дает насыщенный синий цвет, а, с другой, увеличивая насыщенность раствора солями, препятствует окрашиванию таких базофильных структур, как хроматин и рибосомы цитоплазмы, а значит повышает селективность метода [15]. Но специфичность метода все равно остается низкой, причем возможно окрашивание и других структур коллагена, а также базальных мембран. Поэтому для лучшей визуализации эластических волокон необходимо проводить тщательное дифференцирование под микроскопом в процессе окраски [13].
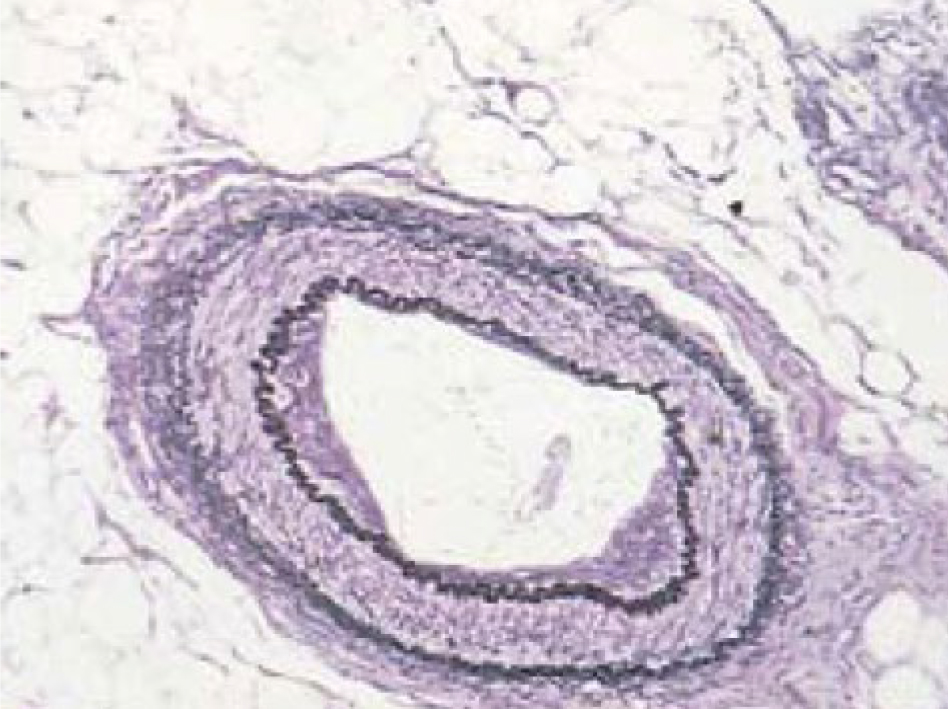
Есть возможность использовать данный метод в комбинации с окраской по Ван Гизону, что позволяет одновременно выявить также коллаген и окрашивать ядра. Тогда результатом будет следующая картина: ядра – черные, эластические волокна – от темно-синих до черного, коллагеновые волокна – оттенки красного, цитоплазма, гладкая и поперечнополосатая мышечная ткань, ороговевающий эпителий, нейроглия и эритроциты – желтые [2, 13].
Орсеин – еще один распространенный краситель, позволяющий выявить эластические волокна в тканях, прежде всего в сосудах (рис. 5, 6). Результат – эластические волокна – от темно-красных до коричневых [10, 11]. За счет окрашивания белков, связанных с медью, данная методика применяется для диагностики заболеваний накопления меди (болезнь Вильсона). Кроме того, связываясь с поверхностными антигенами вируса гепатита В, позволяет использовать краситель для визуализации пораженных клеток [16].
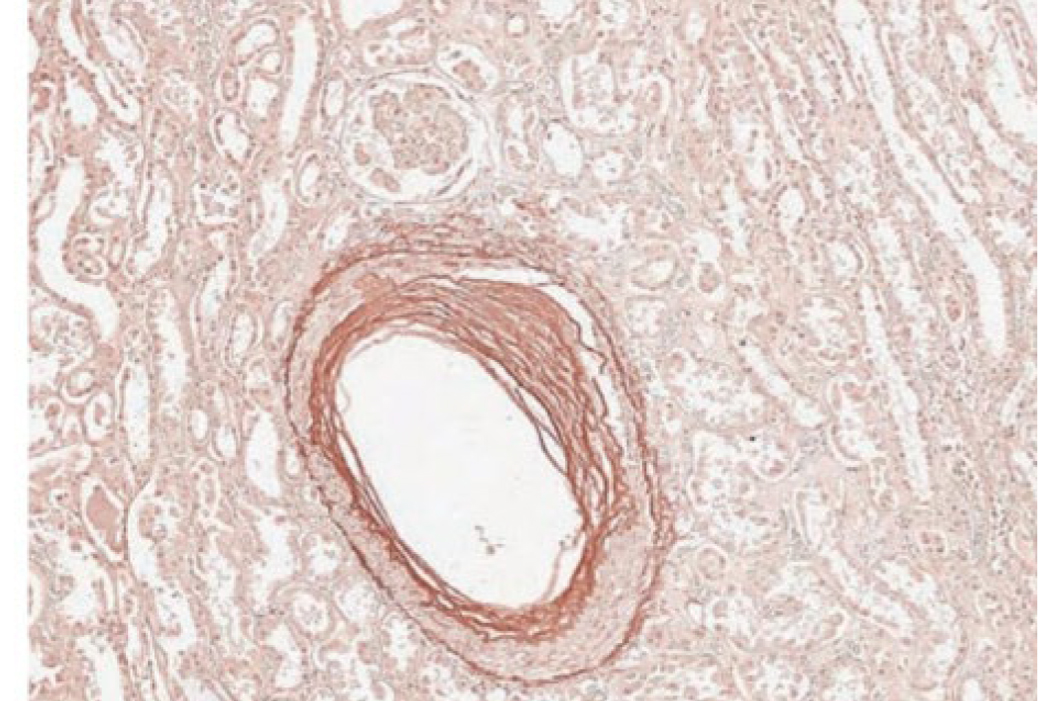
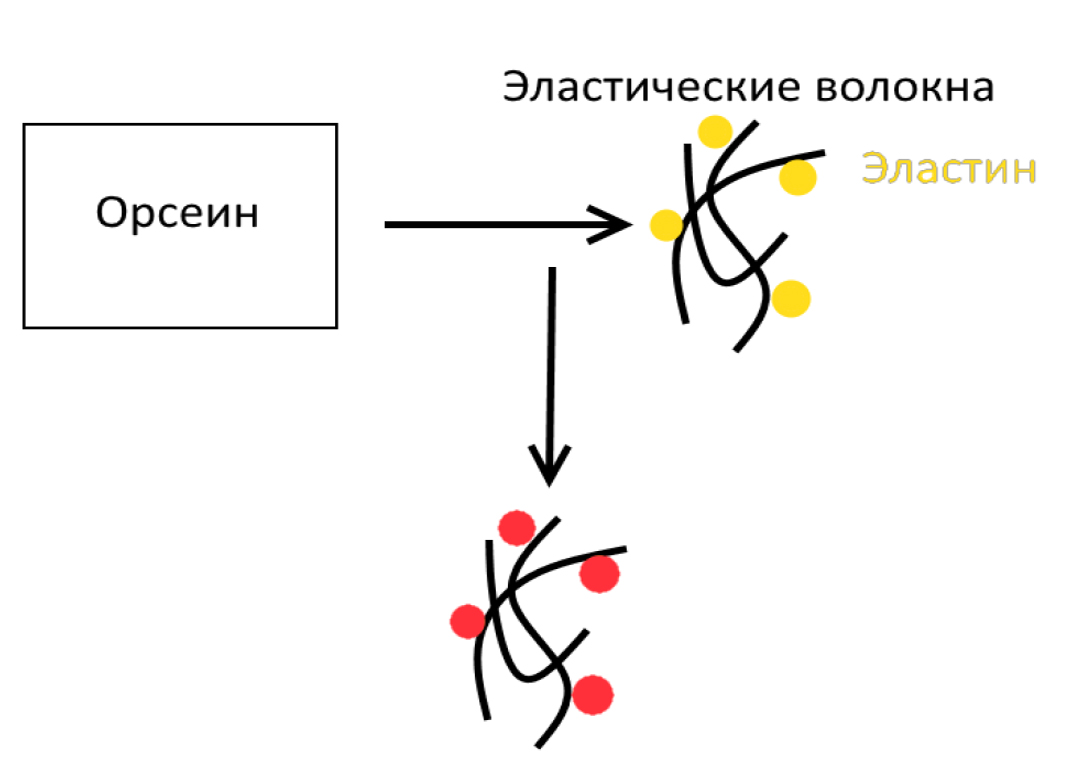
Механизм окрашивания до конца неясен. Возможно, краситель взаимодействует с эластином за счет образования в кислой среде водородных связей между фенольными группами орсеина, заряженными положительно, и отрицательно заряженными боковыми цепями белка, который отличается от коллагеновых волокон меньшим содержанием аргинина, гистидина и лизина и большим количеством нейтральных лейцина и валина. Кроме того, повышенное (до 90%) содержание неполярных аминокислот делает эластические волокна, в отличие от коллагеновых, малорастворимыми в большинстве органических и неорганических растворителей, что может быть применено для выделения компонентов ткани [17].
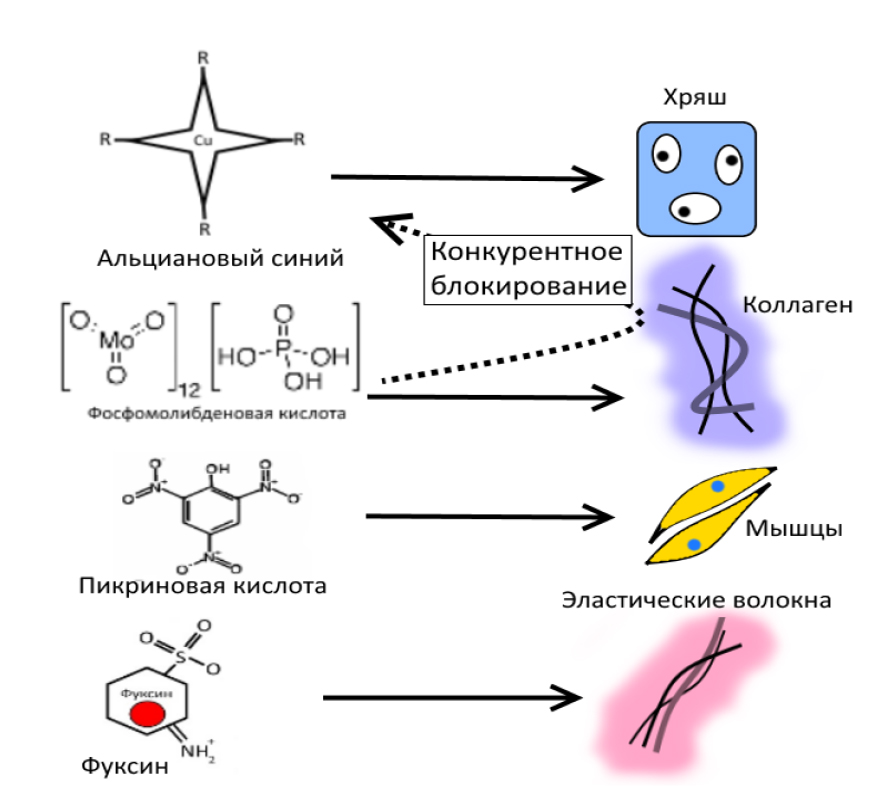
Трихром по Маллори. Дифференцировка коллагеновых волокон хорошо достигается при окраске по Ван Гизону, но другие компоненты ткани (фибрин, хрящевая и мышечная ткань, форменные элементы крови) окрашиваются хуже и не столь специфично, поэтому для более детальной одновременной визуализации можно использовать трихромные окраски, которые окрашивают компоненты тканей в 3 цвета (красный, желтый и синий) с их вариантами. Например, метод окрашивания по Маллори, включает в себя несколько компонентов: анилинового синего, фосфомолибденовую кислоту, пикриновую кислоту и фуксин [12] (рис. 7). Специфичность действия трихрома объясняется различной степенью сродства между его компонентами и макромолекулами соединительной ткани, которая из-за наличия большого числа основных групп ацидофильна и обладает высоким сродством к кислым красителям (пикриновая кислота и оранжевый G), но низким по отношению к слабым основным и амфотерным красителям (кислый фуксин и пунцовый фуксин). Фосфомолибденовая кислота как крупный гетерополианион легко и прочно связывается с катионными группами тканевых структур (волокна коллагена, клеточные мембраны), блокируя таким образом воздействие на них анилинового синего (основный краситель с частичными амфотерными свойствами) [10, 13, 16, 18] (рис. 8). Результат следующий: ядра – темно-коричневые; коллагеновые волокна – темно-синие; хрящ, кость, мукополисахариды, амилоид – оттенки синего; фиброглия, нейроглия, фибрин – красные; мышечная ткань, миелин и эритроциты – желтые; эластические волокна – розовые.
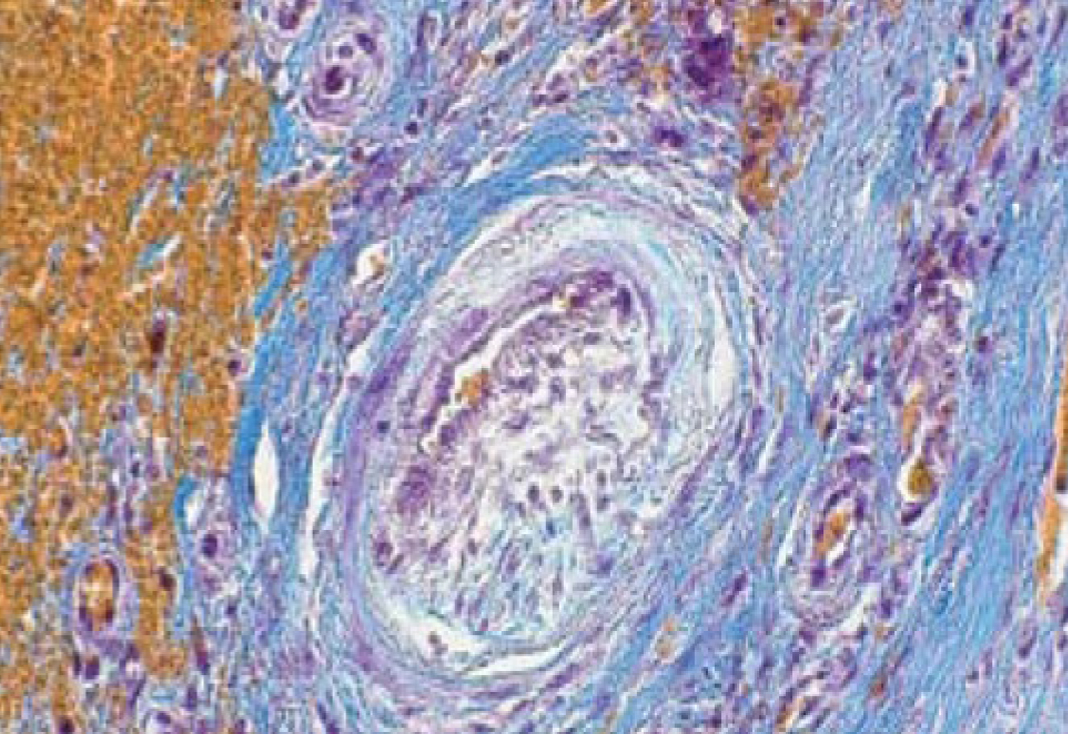
Данная окраска дает более яркие и выраженные результаты, если использовать для фиксации материала жидкость Ценкера, и перед окраской обработать срезы 3% раствором бихромата калия примерно в течение 20 мин [12].
Окраска мукоплисахаридов. Мукополисахариды – это полимерные углеводно-белковые комплексы, содержащиеся в соединительной ткани (хрящевой ткани, роговице) и в жидкостях (слизь, гепарин, синовиальная жидкость, стекловидное тело). В гистологии окраски на мукополисахариды применяются при изучении, прежде всего структур, выделяющих слизь – кишечника, бронхов, муцинозные опухоли, а также заболеваний хрящевой ткани.
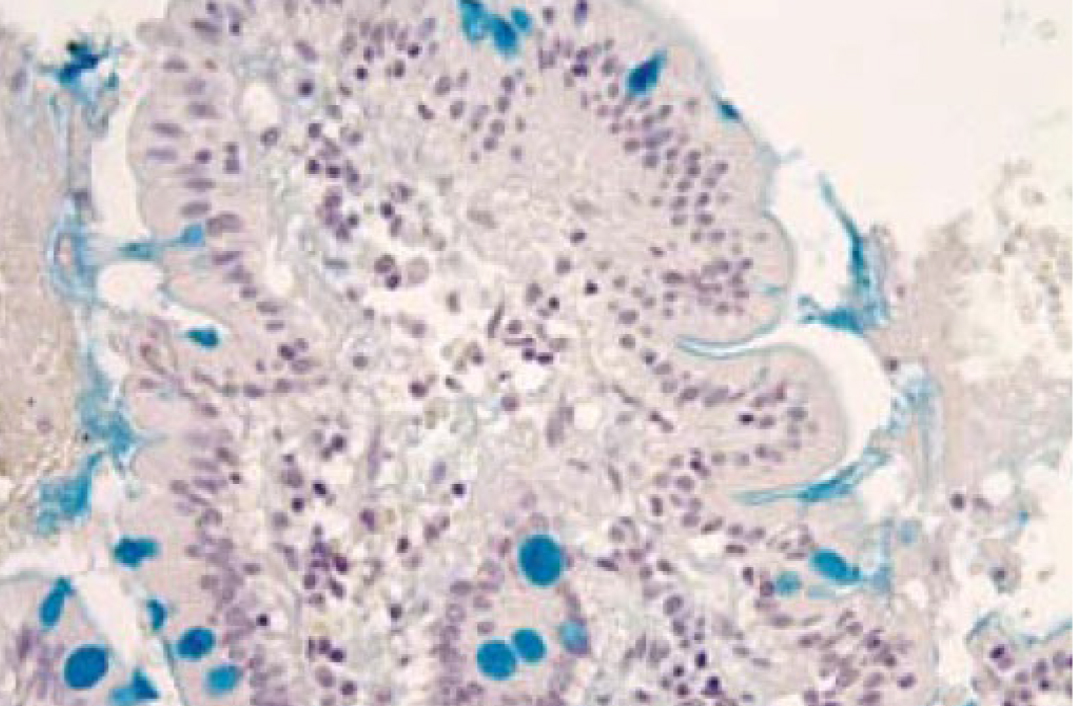
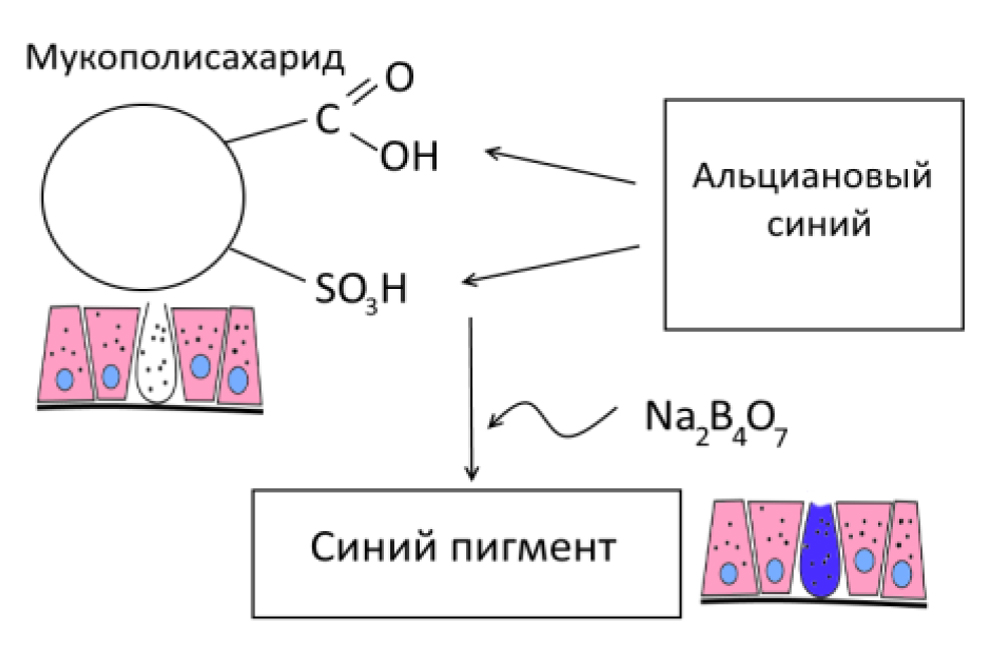
Альциановый синий (рис. 9) по химической структуре является медьсодержащим фталоцианином, который образует прочную связь с полианионами мукополисахаридов, избирательно взаимодействуя с их карбоксильными группами и сульфогруппами [пирс]. Краситель под воздействием тетрабората натрия становится плохо растворимым синим пигментом, который хорошо визуализируется. На реакцию значительно влияет кислотность раствора, так альциановый синий рН 1,0 образует связи с мукополисахаридами с большим содержанием сульфо-групп, а альциановый синий рН 2,5 способен к окрашиванию всех кислых мукополисахаридов [2,13,16] (рис. 10). Это позволяет добиться селективного окрашивания кислых сиаломуцинов и сульфомуцинов бокаловидных клеток толстой кишки, в то время как нейтральный муцин желудка или желез Бруннера не реагируют с альциановым синим при рН 2,5 [16].
Результат окрашивания будет следующим – кислые мукополисахариды – бирюзово-голубые, хрящевая ткань – от пурпурного до темно синего.
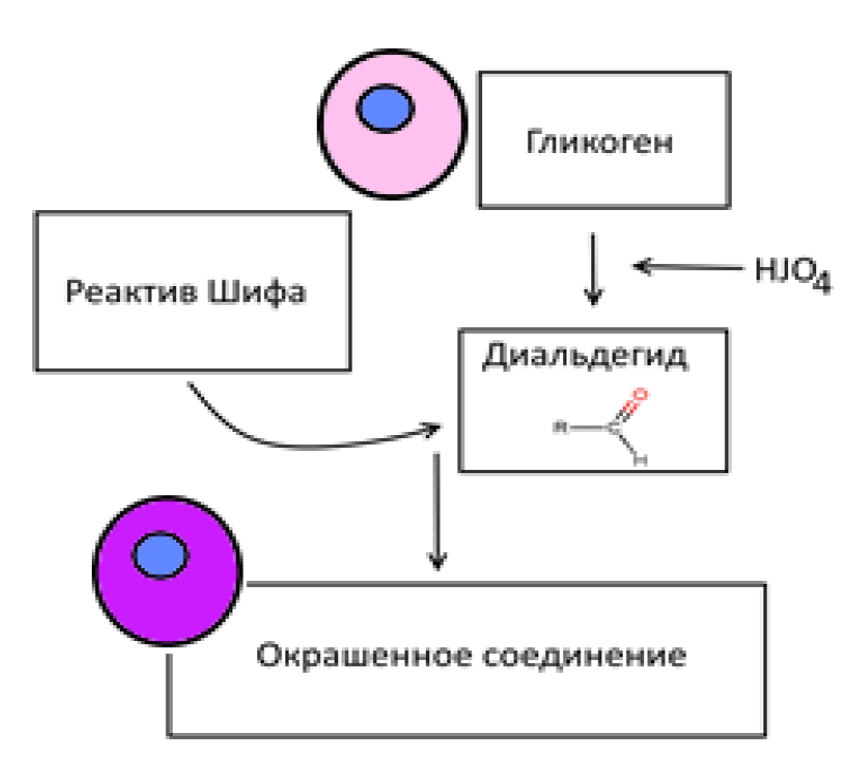
Для выявления гликогена в нормальных и патологически измененных тканях используют ШИК-реакцию (Шифф-йодная кислота) (рис. 11). В данном случае йодная кислота окисляет и разрывает связи в соединениях, содержащих 2 смежные гликолевые группы, образуя диальдегид. Последний образует с серосодержащим фуксином из реактива Шиффа нерастворимое окрашенное соединение, сходное с основным фуксином [13, 17] (рис. 12).
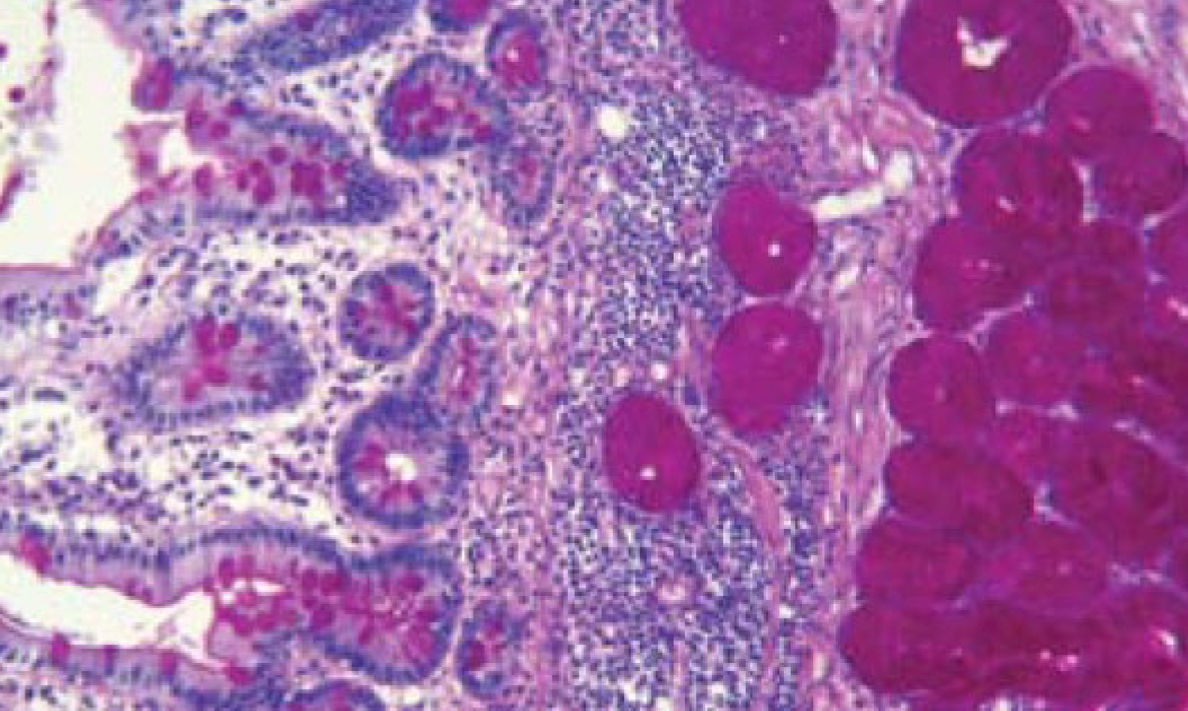
В результате гликоген окрашивается в красные цвета. Таким образом, этот метод широко используется при изучении болезней накопления гликогена, ряда опухолевых заболеваний при которых происходит накопление муцина, грибковых поражений для визуализации клеточной стенки, а также для изучения лимфопролиферативных заболеваний для детализации патологических клеток крови.
Окраска жиров. Обнаружение липидов в клетках и тканях осуществляется группой жировых красителей под общим названием «Суданы» (Судан черный, Судан III, Судан IV и др.), а также нильблаусульфатом и осмиевой кислотой. Эти жирорастворимые вещества легко проникают в липидсодержащие структуры, и не взаимодействует с гидротированными белками (рис. 13, 14). Таким образом, процесс окрашивания липидов представляет собой не гидрофобное взаимодействие, а имеет чисто физический характер, что не позволяет проводить избирательное окрашивание отдельных липидов разного химического состава. Для этой цели перед проведением гистохимической реакции необходимо использовать методы экстракции отдельных групп липидов разными системами растворителей [7, 19,].
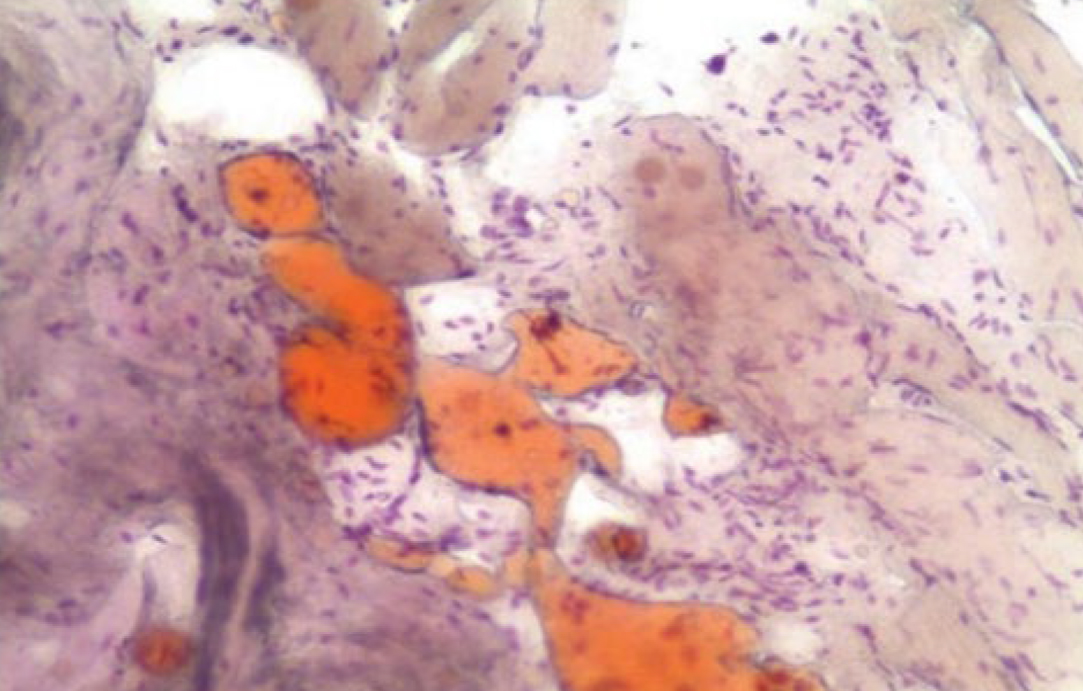
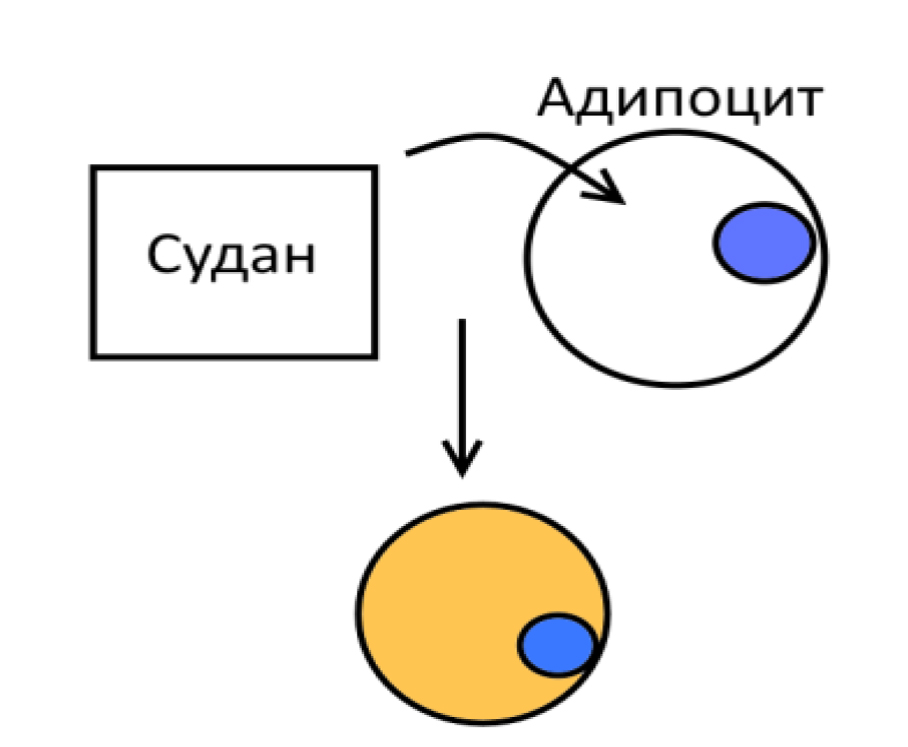
Наиболее часто применяют Судан III и шарлах красный. Они выявляют все жиры, липоиды и нейтральные жиры, интенсивно окрашивая их в оранжево-красный цвет. При этом следует помнить о существенных особенностях обработки материала. Прежде всего формалиновая фиксация не должна быть более 48 ч. После чего на замораживающем микротоме сразу изготавливают срезы, поскольку при обычной проводке эфир, ксилол и крепкие спирты растворяют и извлекают жиры из клеток в растворы, именно поэтому после окраски срезы нельзя обезвоживать и заключать обычным способом. Препараты заключают в глицерин или глицерин-желатин, которые не растворяют жиры и хорошо просветляют необезвоженный препарат, но при длительном хранении препаратов наблюдается выпадение Судана в осадок в виде красных кристаллов. Лучше использовать специальные монтирующие среды на водной основе [13, 20]. Несмотря на используемый метод заключения, краситель все равно быстро выцветает, поэтому желательно исследовать препараты вскоре после их изготовления [10, 20].
Стоит отметить метод окраски макропрепаратов при помощи Sudan Red 5B или масляный красный (Oil Red O), которые применяются для визуализации атеросклеротического повреждения сосудов. Oil Red O – это лизохромный диазокраситель, используемый для окрашивания нейтральных триглицеридов и липидов. Он окрашивает липиды в красный цвет с максимальным поглощением при 500–600 нм. На интиме аорты, после обработки красителем, можно обнаружить даже ранние стадии патологического процесса, поскольку жировые включения окрашиваются красным и хорошо визуализируются глазом [20] (рис. 15).

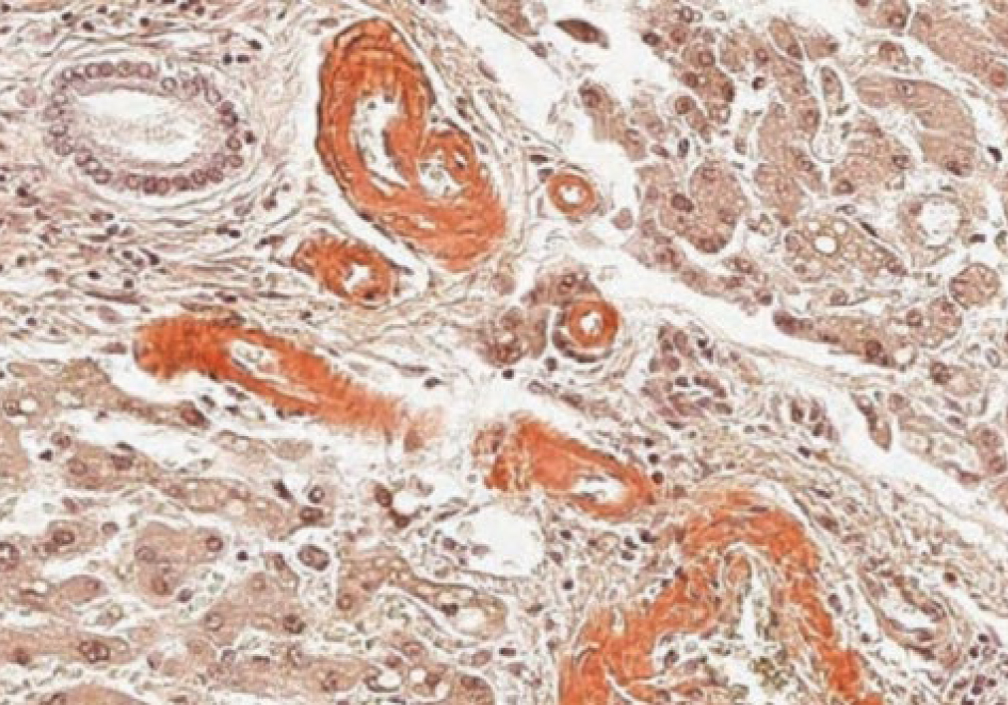
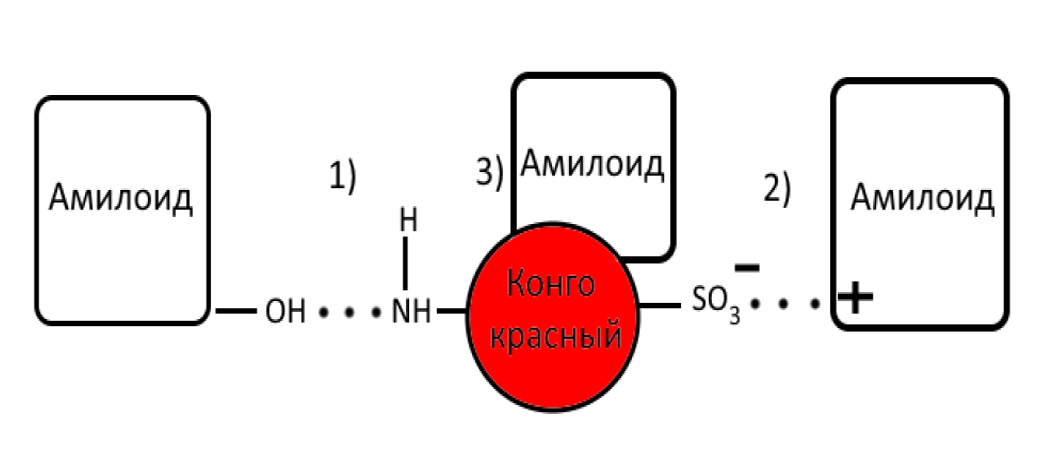
Окраска на амилоид. Для выявления скопления амилоида (патологический белково-полисахаридный комплекс, образующийся при хронических заболеваниях) в тканях наиболее простой и широко используемый краситель – конго красный (рис. 16). Данный краситель окрашивает белок в красный цвет. Кроме того, возможно изучение препаратов в поляризационном свете, при этом массы амилоида дают желто-зеленое свечение, однако рекомендуется заключение срезов в гуммиарабик для исключения свечения коллагеновых волокон [2, 21]. Прочное связывание амилоида с красителем не до конца изучено. Оно происходит таким образом: за счет водородных связей гидроксильных групп, с помощью положительно заряженных аминокислот и посредством полярных контактов [22] (рис. 17).
Специальные методы
Выявление повреждений миокарда по Ли (ГОФП-метод: гематоксилин – основной фуксин – пикриновая кислота). Liе и соавт. (1971) описали и дали название этому методу – «фуксиноррагический». Основной фуксин как катионный краситель взаимодействует с продуктами распада, высвобождаемых из саркоплазмы кардиомиоцитов (в частности с гликогеном), тем самым окрашивая их в красно- коричневый цвет. При этом интактные ткани остаются желто-коричневыми или бледно-зелеными, поскольку, как указано выше, хорошо воспринимают пикриновую кислоту (рис. 18, 19), тем самых создавая хороший контраст с поврежденными участками. ГОФП-метод эффективен для объективного выявления ишемизированных участков миокарда, причем при повреждении как коронарогенного, так и некоронарогенного генеза. Кроме того, опосредованно можно визуализировать соединительную ткань (например, рубцовая ткань после перенесенного инфаркта миокарда окрашивается в сиреневые оттенки, а эластические волокна становятся красными). Особенно эффективна методика на ранних этапах поражения сердечной мышцы, поскольку в поражённых кардиомиоцитах фуксинофильный субстрат появляется вначале вблизи ядра, затем распространяется по всей цитоплазме, а в дальнейшем и на большую часть мышечного волокна [12, 23]. Но впоследствии, когда мышечные волокна начинают разрушаться и рассасываться, фуксинофильный субстрат полностью исчезает, и окраска утрачивает свое значение [24].
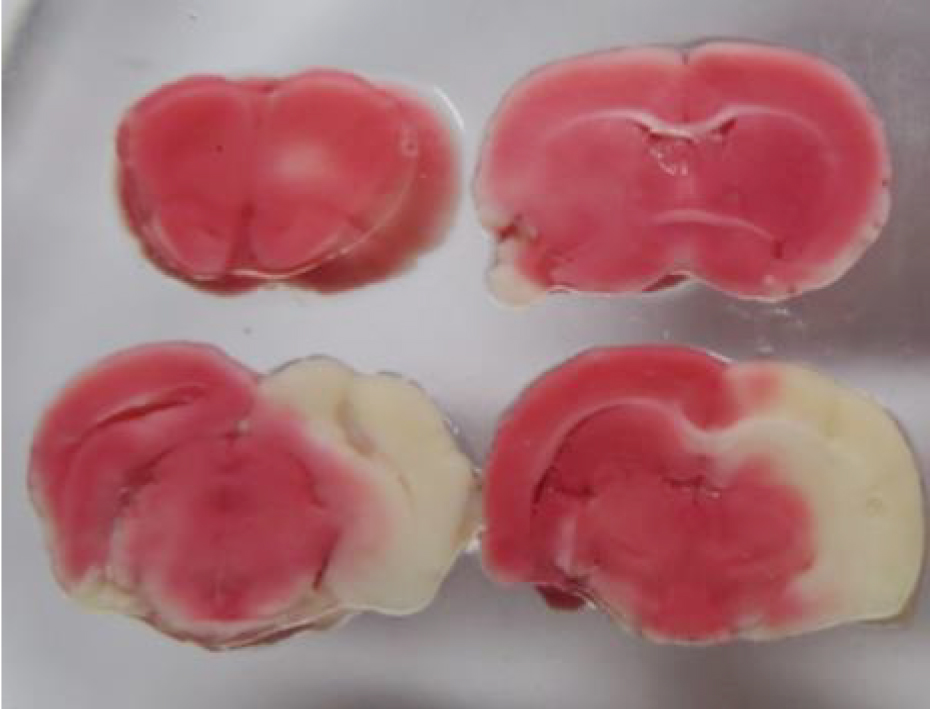
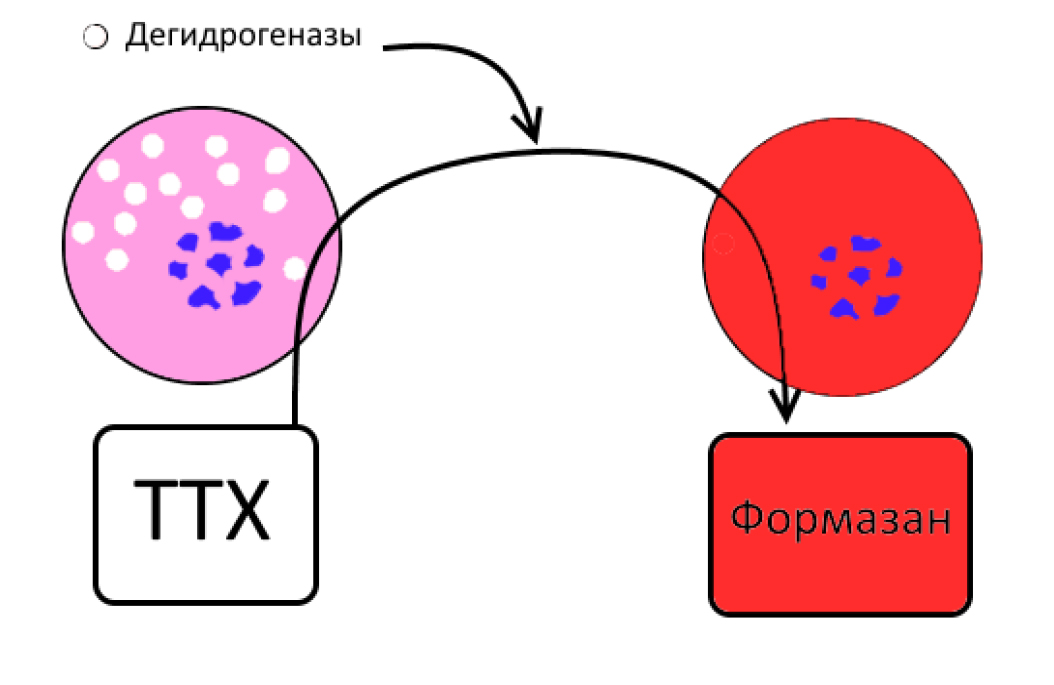
Для макроскопической оценки площади ишемического повреждения тканей, а особенно миокарда и головного мозга, можно использовать соли тетразолия, в частности трифенилтетразолия хлорид (ТТХ) (рис. 20). Соли тетразолия, реагируя с дегидрогеназами (группы ферментов катализирующих окислительно-восстановительные реакции) восстанавливаются до окрашенных соединений – формазанов. Таким образом, в очаге повреждения высвобождается большое количество дегидрогеназ, которые при взаимодействии с тетразолием дают хорошо видимый глазом красный цвет (рис. 21). Реакция позволяет выявить ишемические повреждения на ранних донекротических стадиях патологического процесса [25, 26].
Заключение
В клинической практике и при фармакологических исследованиях микроскопический анализ – неотъемлемая часть изучения нормального строения тканей, а также патологически измененных органов. Приготовление гистологических препаратов включает в себя 5 этапов, каждый из которых важен и может повлиять на полученные результаты. Последний этап является – окрашивание, который обычно ограничен применением стандартной – обзорной окраски гематоксилином и эозином. Но для раскрытия более полной картины процесса необходимы дополнительные окраски; их можно применять как обзорные и заменить ими классические гематоксилин и эозин, например окраски по Ван Гизону или трихром по Маллори. Однако эти методы имеют ряд ограничений или трудоемки в исполнении, поэтому не получили широкого распространения и используются как дополнительные окраски для более детального анализа, в частности для изучения соединительной ткани и патологических процессов, связанных с фиброзом.
Большая часть окрасок более специфична, и их применение служит для выявления конкретных структур или химических соединений в клетках и тканях. Это позволяет получить значительный объем информации, что облегчает как понимание течения нормальных, так и патологических процессов. Так методики выявления мукополисахаридов альциановым синим широко применимы при исследовании желудочно-кишечного тракта и дыхательной системы, а ШИК-реакция незаменима в диагностике болезней накопления, ряда онкологических процессов и грибковых инфекций. Жировые красители, прежде всего Судан III и шарлах красный, используются повсеместно при исследовании дистрофических заболеваний и не в последнюю очередь атеросклероза, а методика применения красителя Oil Red O применима для макроскопической оценки площади атеросклеротического поражения аорты. Конго красный незаменим для обнаружения патологического белка амилоида, который образуется в тканях при аутоимунных и хронических заболеваниях – ревматоидном артрите, туберкулезе или нефропатии.
Кроме того, применяются специализированные окраски, направленные на диагностику повреждений миокарда. Выявить наиболее ранние признаки повреждения кардиомиоцитов позволяет ГОФП-методика. А при помощи солей тетразолия легко макроскопически визуализировать площадь поражения в тканях (не только в сердечной мышце, но и, например, в головном мозге).
В данном обзоре была рассмотрена только незначительная часть гистологических окрасок, их механизмы действия, химические реакции, позволяющие визуализировать микроскопические структуры тканей. Многие из этих методик нашли свое применение в практической деятельности лабораторий, при изучении эффективности и токсичности лекарственных средств. Конечно, существует еще множество красителей, методов, а также их сочетания. Все они могут быть использованы сами по себе, но скорее необходимо применять целый комплекс окрасок. Данный материал будет полезен как специалистам по планированию и проведению доклинических исследований на этапе подготовки к экспериментам, так и врачам-гистологам для понимания процессов, происходящих в тканях в момент окрашивания структур, что позволит выявлять ошибки и получать более объективный конечный результат.
Список источников
- Black J. Microbiology: Principles and exploration (8th ed.). John Wiley & Sons, 2012: 68.
- Саркисов Д.С., Перов Ю.Л. Микроскопическая техника: Руководство для врачей и лаборантов. М.: Медицина, 1996: 542. [Sarkisov D.S., Perov Yu.L. Mikroskopicheskaya tekhnika: Rukovodstvo dlya vrachei i laborantov. M.: Meditsina, 1996: 542 (in Russ.)].
- Селиванов Е.В. Красители в биологии и медицине: Справочник. Барнаул: Азбука, 2003: 40 [Selivanov E.V. Krasiteli v biologii i meditsine: Spravochnik. – Barnaul: Azbuka, 2003: 40 (in Russ.)].
- Лилли Р. Патогистологическая техника и практическая гистохимия. М., 1969: 122 [Lilli R. Patogistologicheskaya tekhnika i prakticheskaya gistokhimiya. M., 1969: 122 (in Russ.)].
- Янин В.Л., Бондаренко О.М., Сазонова Н.А. Учебно-методическое пособие для аспирантов заочной формы обучения к практическим занятиям по дисциплине «Методы исследования в цитологии и гистологии». Учебно-методическое пособие. Ханты-Мансийск: БУ «Ханты-Мансийская государственная медицинская академия», 2015: 65. [Yanin V.L., Bondarenko O.M., Sazonova N.A. Uchebno-metodicheskoe posobie dlya aspirantov zaochnoi formy obucheniya k prakticheskim zanyatiyam po distsipline «Metody issledovaniya v tsitologii i gistologii». Uchebno-metodicheskoe posobie. Khanty-Mansiisk: BU «Khanty-Mansiiskaya gosudarstvennaya meditsinskaya akademiya», 2015: 65 (in Russ.)].
- Kiernan J.A. Dyes and other colorants in microtechnique and biomedical research. Coloration Technology 2006, 122 (1): 1–21. DOI: 10.1111/j.1478-4408.2006.00009.x
- Horobin R.W. Biological staining: mechanisms and theory. Biotech. Histochem, 2002; 77: 3–13. DOI: 10.1080/bih.77.1.3.13
- Alturkistani H.A., Tashkandi F.M., Mohammedsaleh Z.M. Histological stains: A literature review and case study. Global Journal of Health Science. 2016; 8(3): 72–9. DOI: 10.5539/gjhs.v8n3p72
- Коржевский Д.Э. Применение гематоксилина в гистологической технике. Морфология, 2007, Т. 132, вып. 6: 77–82. [Korzhevskii D.E. Primenenie gematoksilina v gistologicheskoi tekhnike. Morfologiya, 2007, T. 132, vyp. 6: 77-82 (in Russ)]
- Семченко В.В., Барашкова С.А., Ноздрин В.Н., Артемьев В.Н. Гистологическая техника: учебное пособие. 3-е изд., доп. и перераб. Омск-Орел: Омская областная типография, 2011: 290. [Semchenko V.V., Barashkova S.A., Nozdrin V.N., Artem'ev V.N. Gistologicheskaya tekhnika: uchebnoe posobie. 3-e izd., dop. i pererab. Omsk-Orel: Omskaya oblastnaya tipografiya, 2011: 290 (in Russ.)].
- Prentø P: Van Gieson's picrofuchsin. The staining mechanisms for collagen and cytoplasm, and an examination of the dye diffusion rate model of differential staining. Histochemistry. 1993; 99: 163–74. DOI: 10.1007/bf00571877
- Коржевский Д.Э. Гиляров А.В. Основы гистологической техники. СПБ.: Спец.Лит. 2010: 95. [Korzhevskii D.E. Gilyarov A.V. Osnovy gistologicheskoi tekhniki. SPB, Spets.Lit. 2010: 95 (in Russ.)].
- Методы гистологической окраски. Каталог ООО «Биовитрум». М., Биовитрум, 2009:66 [Metody gistologicheskoi okraski. Katalog OOO «Biovitrum». M., Biovitrum, 2009:66 (in Russ)]
- Thomas F. McDonald, A. Bleak1ey Chandler Connective tissues in arterial and pulmonary disease. Springer-Verlag New York, 1981: 355. DOI 10.1007/978-1-4612-5967-1
- Horobin R.W. Structure-staining relationships in histochemistry and biological staining. I. Theoretical background and a general account of correlation of histochemical staining with the chemical structure of the reagents used. J Microsc. 1980; 119(3): 345–55. DOI: 10.1111/j.1365-2818.1980.tb04106.x
- Suvarna S. Kim, Layton Christopher, Bancroft John D. Bancroft's theory and practice of histological techniques. 7th edition. Philadelphia: Churchill Livingstone. 2008: 557.
- Пирс Э. Гистохимия. Издательство иностранной литературы, 1962:962. [Pirs E. Gistokhimiya/ Izdatel'stvo inostrannoi literatury, 1962:962. (in Russ.)].
- Bulmer D. Observations on Histological Methods Involving the use of Phosphotungstic and Phosphomolybdic Acids, with Particular Reference to Staining with Phosphotungstic Acid. Haematoxylin Journal of Cell Science. 1962; s3-103: 311–23.
- Луппа X. Основы гистохимии. М.: Мир, 1980: 343. [Luppa X. Osnovy gistokhimii. M.: Mir, 1980: 343 (in Russ)]
- Домницкий И.Ю., Салаутин В.В., Терентьев А.А. Секционный курс и методы патогистологических исследований: метод. пособие по выполнению лабораторных работ. Саратов: «Саратовский ГАУ». 2017: 50. [Domnitskii I.Yu., Salautin V.V., Terent'ev A.A. Sektsionnyi kurs i metody patogistologicheskikh issledovanii: metod. posobie po vypolneniyu laboratornykh rabot. FGBOU VO «Saratovskii GAU». Saratov, 2017: 50 (in Russ.)].
- Гущин Я.А., Мужикян А.А., Селезнева А.И., Макарова М.Н. Комплексная морфологическая оценка атеросклеротического повреждения аорт кроликов в эксперименте // Атеросклероз и дислипидемии. 2017; 1 (26): 50–9. [Gushchin Ya.A., Muzhikyan A.A., Selezneva A.I., Makarova M.N. Kompleksnaya morfologicheskaya otsenka ateroskleroticheskogo povrezhdeniya aort krolikov v eksperimente//Ateroskleroz i dislipidemii. 2017; 1 (26): 50–9 (in Russ)]
- Yakupova E. I., Bobyleva L.G, Vikhlyantsev I.M., Bobylev A.G. Congo Red and amyloids: history and relationship. Bioscience reports. 2019; 1: 39.
- Коржевский Д.Э. Морфологическая диагностика. Подготовка материала для гистологического исследования и электронной микроскопии. СПб.: СпецЛит, 2013: 127. [Korzhevskii D.E. Morfologicheskaya diagnostika. Podgotovka materiala dlya gistologicheskogo issledovaniya i elektronnoi mikroskopii. SPb.: SpetsLit, 2013: 127 (in Russ.)].
- Сапожников А.Г., Доросевич А.Е. Гистологическая и микроскопическая техника. Смоленск, 2000: 151–3 [Sapozhnikov A.G. , Dorosevich A.E. Gistologicheskaya i mikroskopicheskaya tekhnika. Smolensk, 2000: 151–3 (in Russ.)].
- Hatfield R.H., Mendelow A.D., Perry R.H., Alvarez L.M., Modha P. Triphenyltetrazolium chloride (TTC) as a marker for ischaemic changes in rat brain following permanent middle cerebral artery occlusion. Neuropathol Appl Neurobiol. 1991; 17 (1): 61–70.
- Bambhaniya A.B., Upadhyay M.C., Trangadia M.M., Mehta R.A., Gupta B.D., Chaudhari K.R. Role of Triphenyl Tetrazolium Chloride to detect early myocardial ischemia in sudden death cases. Journal of Research in Medical and Dental Science. 2015; Vol. 3: 54–9. DOI: 10.5455/jrmds.20153112



