Частота дыхательных движений в доклинических исследованиях
Макарова М.Н., Шубин Д.В., Макаров В.Г. Частота дыхательных движений в доклинических исследованиях. Лабораторные животные для научных исследований. 2019; 3. https://doi.org/10.29296/2618723X-2019-03-03
Резюме
Исследование функции внешнего дыхания у лабораторных животных — частая задача при изучении токсичности лекарственных средств, для оценки фармакологической безопасности, при изучении фармакодинамики.
При этом неизбежно возникает вопрос о нормальных значениях частоты дыхательных движений (ЧДД) у здоровых животных. Цель данного исследования — оценка частоты дыхательных движений у таких популярных для доклинических исследований видов лабораторных животных, как мышь (n=10♀, n=10♂), крыса (n=20♀, n=20♂), морская свинка (n=20♀, n=20♂), кролик (n=20♀, n=20♂), и сравнение указанных показателей с данными литературы.
У всех животных сначала измеряли ЧДД без наркотизации, затем этим животным вводили наркоз и повторно проводили измерения.
В дополнительных группах животных также, было оценено влияние приучения кроликов к процедуре измерения (на протяжении 2 нед) (n=5♀, n=5♂) и определена ЧДД у молодых кроликов (n=5♀, n=5♂).
Показатели ЧДД у мышей совпали с указанными в литературе и составили 200–283 в минуту. При этом данные, полученные на ненаркотизированных животных, оказались статистически выше.
Показатели ЧДД у крыс в наркозе и без наркоза совпали с данным литературы и составили 91–106 в минуту. У самок ЧДД при использовании наркоза оказалось статистически значимо ниже, чем у самцов.
У морских свинок показатели ЧДД полностью совпали с данными литературы (89–120 в минуту), после наркоза и у самцов и у самок ЧДД урежалась. Среди изученных видов животных этот вид наиболее подходил для снятия показаний ЧДД без использования наркоза.
При анализе данных, полученных на кроликах, мы обратили внимание на крайне низкую величину ЧДД у кроликов в покое, описанную в справочной ветеринарной литературе и в ряде экспериментальных работ приводится значение 30–80 в минуту. ПО результатам других экспериментальных работ этот показатель у интактных самок кроликов составлял 120–200 в минуту. Нам удалось зарегистрировать относительно низкие значения ЧДД только у самцов кроликов в наркозе (79±9). У кроликов самцов без наркоза этот показатель составил 302±19 в минуту, у самок без наркоза было установлено ЧДД 441±13, а в наркозе ЧДД урежается до 233±29 в минуту.
Мы предположили, что кролики, перед проведением манипуляции нуждаются в приучении к процедуре измерения, и в течение 2 нед приучали их. Также проводилось измерение ЧДД у молодых кроликов.
В результате приучения животных к процедуре измерения ЧДД снижается у самцов кроликов в сознании до 224±17, у самок кроликов — до 163±9.
Регистрация ЧДД у более молодых животных, в возрасте 8–9 мес, также влияет на показатель ЧДД; он составил 157±23 и 114±11 у самцов и самок соответственно, и был ниже, чем у животных более взрослого возраста (12–14 нед).
Проведенное исследование позволило нам сформулировать некоторые практические рекомендации по измерению ЧДД у лабораторных животных.
Введение
Исследование функции внешнего дыхания у лабораторных животных – частая задача, как при изучении токсичности лекарственных средств, для оценки фармакологической безопасности, так и при изучении фармакодинамики. Оценка функции внешнего дыхания также очень важна при доклиническом изучении ингаляционных средств.
Оценка частоты дыхательных движений (ЧДД) позволяет дифференцировать сенсорные раздражители верхних дыхательных путей и «легочные» раздражители. Такие раздражители, как аммиак, хлор и формальдегид вызывают раздражение верхних дыхательных путей, а такие, как диоксид азота и озон, вызывают раздражение легких. Раздражители верхних дыхательных путей, как правило, вызывают замедление частоты дыхания, в то время как легочные раздражители обычно увеличивают частоту дыхания и уменьшают минутный объем, обеспечивая быстрое и неглубокое дыхание [1].
При этом неизбежно возникает вопрос: каковы нормальные значения показателей функции внешнего дыхания, в частности частоты дыхательных движений у здоровых животных? ЧДД – достаточно вариативный показатель, который зависит не только от вида, пола и возраста животного.
У здоровых животных на частоту дыхания оказывают влияние многие факторы: днем ЧДД больше, чем ночью в покое; молодые животные и животные небольшого размера дышат чаще взрослых и крупных. Учащение дыхания наблюдается во время движения, кормления, пересадки животных, при контакте с незнакомыми объектами, при изменении температуры воздуха в помещении, наличии каких-либо стрессогенных воздействий. Снижение частоты дыхательных движений чаще всего наблюдается под влиянием средств для наркоза, или других лекарственных средств, способных угнетать дыхательный центр, при некоторых заболеваниях головного мозга.
Нормальные показатели ЧДД, указанные в литературных источниках, крайне противоречивы, особенно это касается кроликов и морских свинок, которые реже, чем мыши и крысы, выступают в качестве тест-систем.
Цель данного исследования – оценка частоты дыхательных движений у наиболее часто используемых в доклинических исследованиях видов лабораторных животных (мышь, крыса, морская свинка, кролик).
Материал и методы
Эксперименты были выполнены на аутбредных мышах – 10 самцов и 10 самок (возраст 8–9 нед), аутбредных крысах – 20 самцов и 20 самок (возраст 10–11 нед), морских свинках – 20 самцов и 20 самок (возраст 9–10 нед), кроликах породы Новозеландские – 25 самцов и 25 самок (возраст 12–14 нед) и 5 самцов и 5 самок (возраст 8–9 нед). Все животные получены из питомника АО НПО «Дом Фармации», Россия). Животных содержали в условиях 24-часового фоторежима (12 ч день:12 ч ночь, включение света в 8:00), при контролируемой температуре (20±2ºC) и влажности (65±10%) воздуха и свободном доступе к очищенной воде и стандартному корму (гранулированный комбикорм).
Данная научно-исследовательская работа была рассмотрена на биоэтической комиссии НПО «Дом Фармации», одобрена для проведения (№БЭК 1.58/17 от 08 августа 2017 г.), и выполнена в соответствии с рекомендациями Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных и политикой национальных институтов здоровья США «Принципы лабораторного ухода за животными». Исследование соответствовало принципам 3 «R» (Reduction, Refinement and Replacement). Все усилия были направлены на минимизацию страданий животных и сокращение их числа для эксперимента. Эвтаназия животных дизайном исследования не была предусмотрена.
У всех животных сначала проводилось измерение ЧДД без наркотизации, в нескольких сериях, а затем эти же животные вводились в наркоз: крысы, морские свинки и кролики – Золетил 100/0,25 мл + Ксилазин/0,5 мл, мыши – Золетил 100/0,050 мл + Ксилазин/0,1 мл. После наркотизации повторно проводились измерения в нескольких сериях. После измерений животные возвращались в стоковую популяцию питомника. Кролики после измерений также возвращались в стоковую популяцию питомника и там, в комнате проживания, на протяжении 2 нед подвергались приучению к процедуре регистрации ЧДД: им навешивали датчик, помещали на рабочую поверхность и проводили регистрацию ЧДД без сохранения данных.
Для регистрации использовали регистратор PowerLab® 8/30 (ADINSTRUMENTS, Австралия) и пьезокерамический датчик для регистрации ЧДД с разъемом типа BNC для подключения к регистратору, эластичную манжету для фиксации датчика (разных типоразмеров в зависимости от вида животного). Для анализа данных использовали программное обеспечение LabChart.
Результаты и обсуждение
Полученные результаты представлены в табл. 1.
Таблица 1
Частота дыхательных движений у различных видов животных в сравнении с данными, указанными в литературе
|
Вид животного |
Пол |
Данные литературы |
Собственные данные, M±m |
|
|
в сознании |
в наркозе |
|||
|
Мышь |
Самец |
200–300 [2–5] |
283±23 n=10 |
204±16* n=10 |
|
Самка |
282±13 n=10 |
198±11* n=10 |
||
|
Крыса |
Самец |
58–324 [3, 6–12] |
102±4 n=20 |
106±3 n=20 |
|
Самка |
93±4 n=20 |
91±2** n=20 |
||
|
Морская свинка |
Самец |
40–150 [2] 42–104 [13] 80–130 [14] |
115±4 n=20 |
89±6* n=20 |
|
Самка |
120±3 n=20 |
97±3* n=20 |
||
|
Кролик |
Самец |
30–60 (40–300 у животных в стрессе) [2] 80±3 [15, 16] 150–200 [17] |
302±19 n=20 |
72±9* n=20 |
|
Самка |
441±13** n=20 |
233±29*** n=19 |
||
Примечание. * – статистически значимо при р<0,05 по сравнению с данными, полученными на животных в сознании; ** – статистически значимо при р<0,05 по сравнению с животными этого вида противоположного пола.
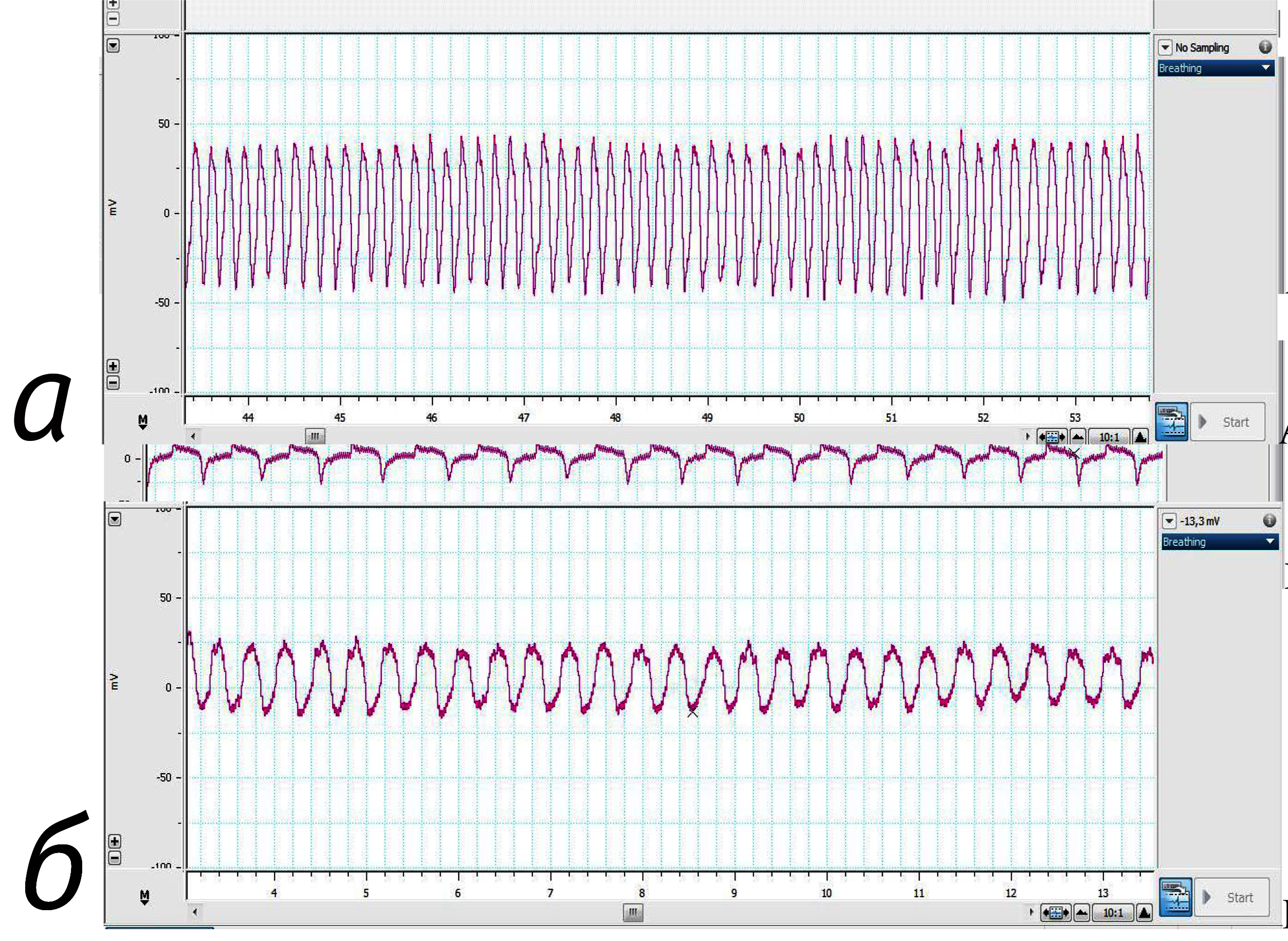
Значения ЧДД у мышей в наркозе совпали с таковыми в литературе. При этом данные, полученные на ненаркотизированных животных, оказались статистически значимо выше. Регистрация показателей у мышей в сознании была затруднена из-за больших размеров датчика относительно тела животных. Крепления датчика к телу возможно с помощью эластичного бинта, однако при измерении ЧДД на ненаркотизированных животных возникает большое число помех. Типичные кривые регистрации ЧДД у мышей и крыс представлены на рис. 1, 2.
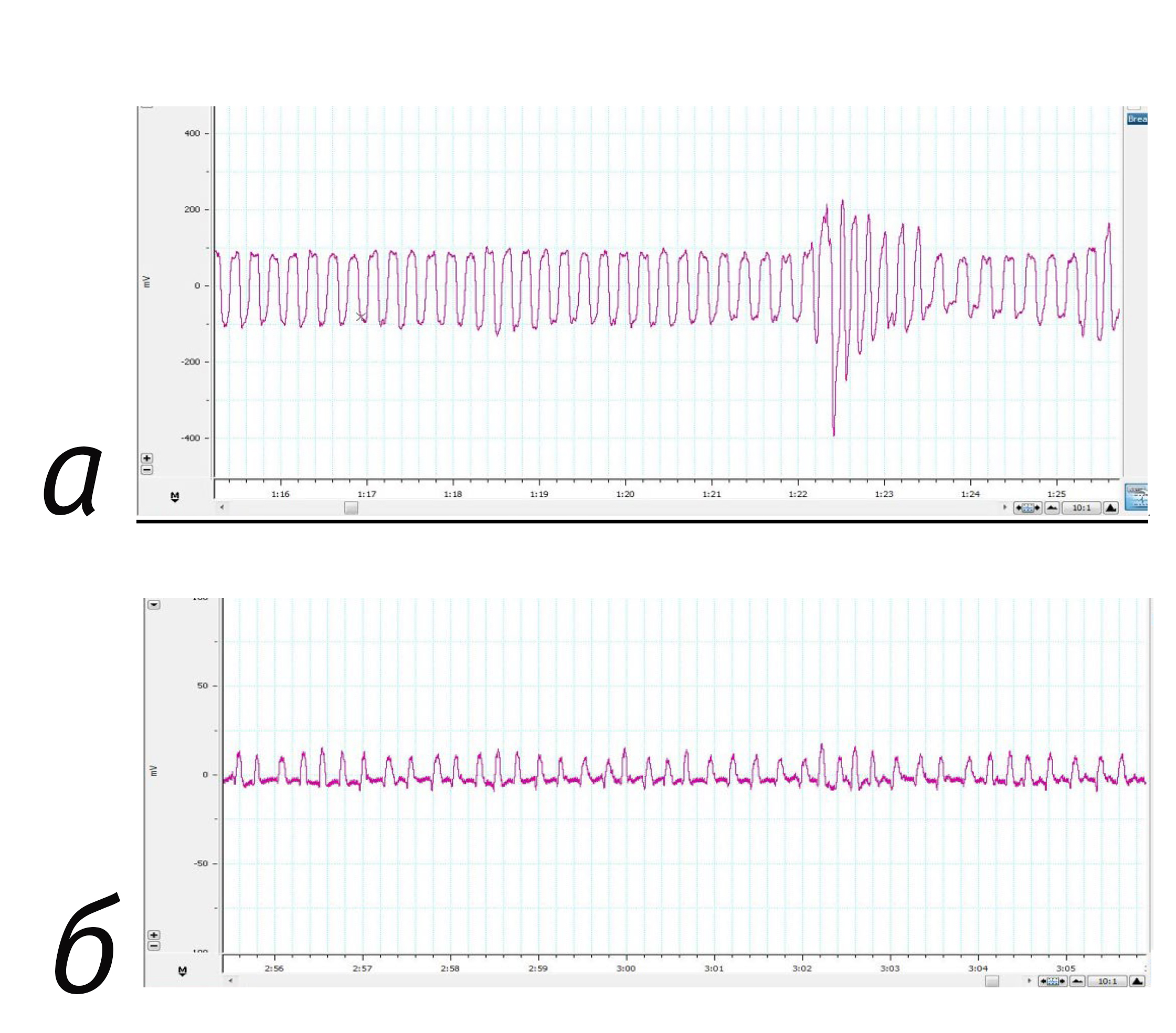
Значения ЧДД у крыс в наркозе и без наркоза совпали с таковыми в литературе. У наркотизированных самок ЧДД оказалось статистически значимо ниже, чем у самцов. По данным [18] С.В. Кузнецова и соавт. (2012), у крысят в 1-е сутки после рождения ЧДД составляет 68±5 в минуту.
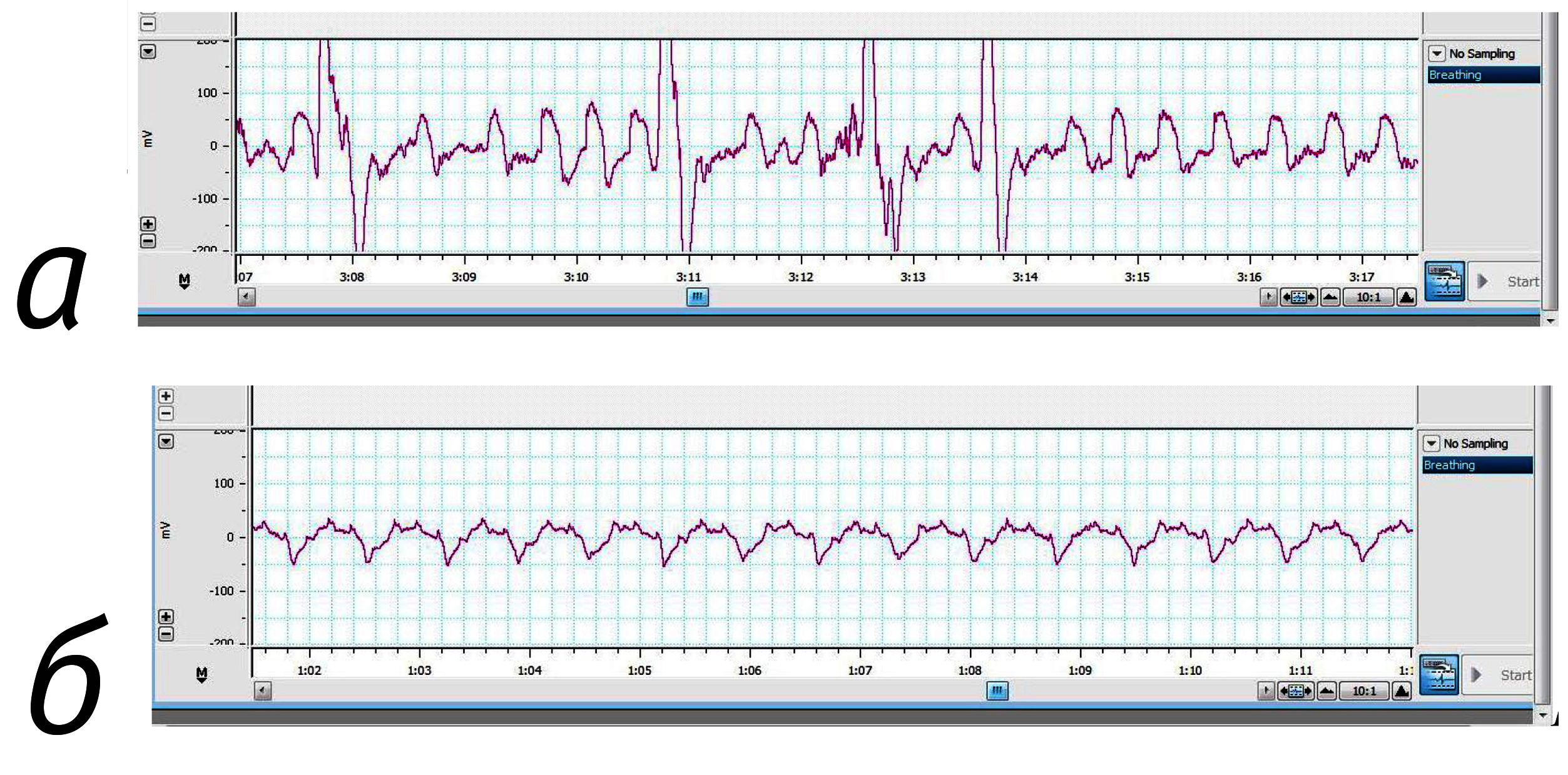
У морских свинок показатели ЧДД полностью совпали с данными литературы, при этом у наркотизированных самцов и у самок ЧДД урежалась. В целом снятие показателей ЧДД у морских свинок оказалось достаточно простой манипуляцией, получаемые кривые были высокого качества и их анализ был достаточно прост (рис. 3). Среди изученных видов животных этот вид наиболее подходил для снятия показаний ЧДД без использования наркоза.
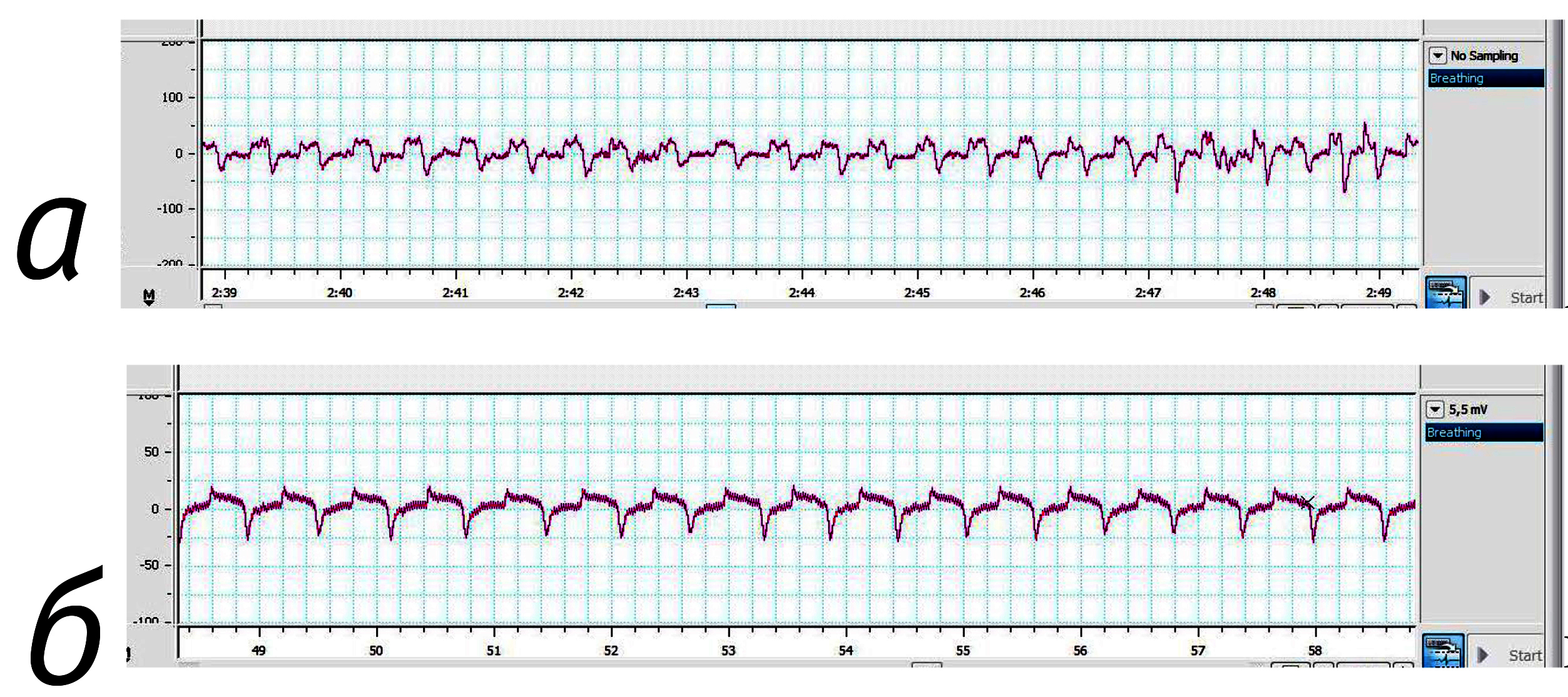
При анализе данных, полученных на кроликах, обращает на себя внимание крайне низкая величина ЧДД у кроликов в покое, в справочной ветеринарной литературе она равна 30–80 [2, 15, 16]. Нам такие значения удалось зарегистрировать только у самцов кроликов в наркозе. В экспериментальной работе C.A. Schroeder, L.J. Smith (2011) это показатель у интактных самок кроликов составил 150–200 движений в минуту [17]. А. Gonzalez-Gil et al. (2015) зарегистрировали у интактных самок кроликов около 120 движений в минуту [19].
Как оказалось, ЧДД у самок и самцов значительно различается как при использовании наркоза, так и без него, у самцов без наркоза ЧДД было ниже, чем у самок в 1,5 раза, при использовании наркоза в 3 раза.
У кроликов также наблюдалась существенная разница в ЧДД при использовании наркоза – у самцов снижение показателя в 4 раза, у самок – в 1,8 раза. На рис. 4 представлены типичные кривые ЧДД кроликов в наркозе и без него.
Мы предположили, что кролики перед проведением манипуляции нуждаются в приучении к процедуре измерения; в течение 2 нед мы приучали их, ежедневно присоединяя датчик без снятия показателей и с пищевым подкреплением. Кроме того, более молодые животные оказались более стрессоустойчивы, поэтому демонстрировали более низкие показатели ЧДД. Полученные данные представлены в табл. 2.
Таблица 2
ЧДД у кроликов после приучения их к манипуляции измерения, а также у более молодых животных
|
Вид животного, возраст |
Пол |
M±m |
|
|
в сознании |
в наркозе |
||
|
Кролик, 12–14 нед |
Самец |
224±17** n=10 |
101±16* n=5 |
|
Самка |
163±9** n=10 |
108±12*** n=5 |
|
|
Кролик, 8–9 нед |
Самец |
157±23× n=10 |
- |
|
Самка |
114±11× n=10 |
- |
|
Примечание. * – Статистически значимо при р<0,05 по сравнению с данными, полученными на животных в сознании; ** – статистически значимо при р<0,05 по сравнению с животными этого же вида и пола, без приучения; × – статистически значимо при р<0.05 по сравнению с более взрослым (12–14 нед) животными этого же вида и пола, без приучения.
Согласно полученным данным, приучение животных к процедуре измерения ЧДД влияет на снижение ЧДД у самцов кроликов в сознании, без статистически значимых изменений при введении их в наркоз. У самок кроликов также наблюдалось снижение ЧДД после приучения, при введении их в наркоз эффект усиливался.
Использование при регистрации ЧДД более молодых животных (8–9 мес) также влияло на показатель ЧДД, он был ниже, чем у животных более взрослого возраста (12–14 нед).
Проведенное исследование позволило нам сформулировать некоторые практические рекомендации по измерению ЧДД у лабораторных животных.
- Фиксировать датчик необходимо в месте максимальной дыхательной экскурсии (область груди или живота), где наиболее выражена подвижность поверхности тела, вызываемая дыхательной деятельностью. Место фиксации датчика вариативно, в зависимости от вида животного и условий эксперимента. Такие животные, как кролики, морские свинки, крысы, при соблюдении определенных мер предосторожности и проведении предварительного приучения позволяют проводить регистрацию ЧДД в свободном положении. Мышей перед регистрацией необходимо поместить в рестрейнер. Регистрировать ЧДД у животных можно как в сознании, так и в наркозе. Необходимо учитывать тот факт, что чувствительность датчика позволяет регистрировать различные механические воздействия. Поэтому располагать его нужно в удалении от источников «паразитных шумов» – сердца, брюшной аорты. Густой шерстный покров также может создавать дополнительные помехи, следовательно, для фиксации датчика необходимо выбирать место с наименьшим шерстным покровом. По возможности следует располагать датчик так, чтобы не было контакта рабочей поверхности датчика с костными образованиями – ребрами и костями таза. Это может вызвать появление артефактов при регистрации ЧДД, особенно у животных малого размера. При фиксации на мелких животных провисание провода датчика может создавать дополнительные помехи в результате колебаний провода (эти колебания также будут отображены на графической кривой – пневмограмме).
- Важно понимать, что животное в сознании производит различные движения, как произвольные, так и физиологические, связанные (принюхивания) и не связанные (аутогруминг, движения головы) с дыхательной деятельностью. Все эти движения, в той или иной степени, фиксируются датчиком и отображаются на экране компьютера в ходе рабочей сессии. Если животное в сознании, идеальную кривую ЧДД на протяжении всей рабочей сессии получить практически невозможно. Необходимо выбирать такие условия процедуры регистрации ЧДД, при которых четко визуализируются циклы «вдох-выдох» на достаточных временных отрезках, что в дальнейшем позволит исследователю корректно интерпретировать результат.
- В процессе интерпретации результатов исследователю необходимо соотносить результаты регистрации ЧДД, полученные от животных контрольной и экспериментальных групп, с данными из достоверных литературных источников, учитывая основные критерии (вид, пол, возраст тест-систем и т.п.). Ручной режим подсчета показателей у крыс и мышей в программе LabChart требует от исследователя аналитического подхода: необходимо уметь идентифицировать качественные дыхательные кривые на графике, подсчет проводить отрезками.
- Нормальные показатели ЧДД, указанные в литературных источниках, нельзя считать окончательно истинными. ЧДД – достаточно вариативный показатель, который зависит не только от вида, пола и возраста животного. Он также может изменяться под воздействием таких внешних факторов, как температура воздуха в помещении регистрации или наличия какого-либо стресса (например, от непривычной окружающей среды в помещении проведения процедуры регистрации).
Список источников
- Casarett and Doull's toxicology: the basic science of poisons (Editor Curtis D. Klaassen). Seventh Edition. The McGraw-Hill Companies, Inc., 2008. 1309.
- Бергхоф П.К. Мелкие домашние животные. Болезни и лечение. Пер. с нем. И. Кравец. Изд. 2 испр. и доп. М.: «АКВАРИУМ-ПРИНТ», 2004: 224 [Bergkhof P.K. Small pets. Disease and treatment. PeR. s neM. I. KraveTS. IzD. 2 ispR. i doP. M.: «AKVARIUM-PRINT», 2004. 224 (in Russ.)].
- Медетханов Ф.А, Корчемкин А.А., Ильин Г.Л. Острая токсичность препарата «Нормотрофин» при однократном внутрижелудочном введении. Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2011. Т. 205: 145–9. [Medetkhanov F.A, Korchemkin A.A., Il'in G.L. Acute toxicity of the drug "Normotrophin" with a single intragastric administration. Uchenye zapiski Kazanskoi gosudarstvennoi akademii veterinarnoi meditsiny iM. N.EH. BaumanA. 2011. T. 205: 145–9 (in Russ.)].
- Sanders C.J., Vogel P., McClaren J.L., Bajracharya R., Doherty P.C., Thomas P.G. Compromised respiratory function in lethal influenza infection is characterized by the depletion of type I alveolar epithelial cells beyond threshold levels. Am J Physiol Lung Cell Mol Physiol. 2013. 304: 481–8. DOI: 10.1152/ajplung.00343.2012.
- Леткин А.И., Зенкин А.С. Изучение острой токсичности препаратов ЦСП РМ, АУКД и ХЭД. Аграрный научный журнал. 2015; 7: 27–9. [Letkin A.I., Zenkin A.S. The study of acute toxicity of drugs CSP RM, AUKD and HED // Agrarnyi nauchnyi zhurnaL. 2015; 7: 27–9 (in Russ.)].
- Thomas T., Marshall J.M. The roles of adenosine in regulating the respiratory and cardiovascular systems in chronically hypoxic, adult rats. Journal of Physiology. 1997, 501.2: 439–47. DOI:10.1111/j.1469-7793.1997.439bn.x.
- Bania T.C., Chu J. Physostigmine Does Not Effect Arousal but Produces Toxicity in an Animal Model of Severe g-hydroxybutyrate Intoxication. ACAD EMERG MED. 2005; Vol. 12 (3): 185-9. DOI: 10.1197/j.aem.2004.09.020.
- Трутаев И.В. Синтетические олигопептиды: защитное действие при химических нагрузках и интоксикациях. Ветеринарная патология. 2009; 1: 30–6. [Trutaev I.V. Synthetic oligopeptides: protective effect during chemical stress and intoxication. Veterinarnaya patologiya. 2009; 1: 30–6 (in Russ)].
- Clougherty J. E., Rossi C.A., Lawrence J., Long M.S. et al. Chronic Social Stress and Susceptibility to Concentrated Ambient Fine Particles in Rats // Environmental Health Perspectives. 2010. Vol. 118 (6): 769–75. DOI: 10.1289/ehp.0901631.
- Лушникова О.В., Гиноян Р.В., Малиновский Д.С. Влияние гипер- и гипогепаринемии на показатели внешнего дыхания в условиях введения зоотоксинов и гипертермии. Вестник Нижегородского университета им. Лобачевского. 2012; 2 (3): 262–5. [Lushnikova O.V., Ginoyan R.V., Malinovskii D.S. The effect of hyper- and hypogeparinemia on external respiration in conditions of administration of zootoxins and hyperthermia // Vestnik Nizhegorodskogo universiteta im. Lobachevskogo. – 2012; 2 (3): 262–5 (in Russ)].
- Sengupta P. The laboratory rat: Relating its age with human’s // International Journal of Preventive Medicine. 2013; 4: 624–30.
- Зенкова Е.А., Вдовина Г.П., Бурлуцкая А.А., Данилова В.К. Исследование нового ненаркотического анальгетика, производного изохинолина – соединения Г.104 – на наличие сопутствующих и нежелательных эффектов, характерных для анальгетиков. Пермский медицинский журнал. 2016. – Т. 33; 1: 79–84. [Zenkova E.A., Vdovina G.P., Burlutskaya A.A., Danilova V.K. Investigation of a new non-narcotic analgesic derivative of isoquinoline – compound D.104 – for the presence of concomitant and undesirable effects characteristic of analgesics // Permskii meditsinskii zhurnaL. – 2016. – Vol. 33, 1: 79–84 (in Russ)].
- Noonan D. Guinea pigs (Cavia porcellus). Anzccart News. 1994. Vol. 7, 3: 1–8.
- Давидянц Э.А. Физиологические особенности морских свинок. В сборнике: Студенческая наука – агропромышленному комплексу. Научные труды студентов Горского государственного аграрного университета. 2018: 165–7. [Davidyants Eh.A. Physiological features of guinea pigs. V sbornikE: Studencheskaya nauka – agropromyshlennomu kompleksU. Nauchnye trudy studentov Gorskogo Gosudarstvennogo agrarnogo universitetA. 2018: 165–7 (in Russ)].
- Покровский М.В., Бубенчиков Р.А. Фармакотерапевтическая эффективность растений рода фиалка при стафилококковой пневмонии. Научные ведомости. Серия Медицина. Фармация. 2010; 22 (93). Выпуск 12/2. –19–22. [Pokrovskii M.V., Bubenchikov R.A. Pharmacotherapeutic efficacy of violet plants in staphylococcal pneumonia // Nauchnye vedomostI. Seriya Meditsina. Farmatsiya. 2010. № 22 (93). Supplement 12/2: 19–22 (In Russ.)].
- Гуз А.С. Влияние острой задержки мочеиспускания на клиническое состояние кроликов. Омский научный вестник. 2015; 2 (144): 202–04. [Guz A.S. The effect of acute urinary retention on the clinical condition of rabbits // Omskii nauchnyi vestniK. – 2015, № 2 (144). – S. 202-204. (In Russ.)].
- Schroeder C.A., Smith L.J. Respiratory rates and arterial blood-gas tensions in healthy rabbits given buprenorphine, butorphanol, midazolam, or their combinations. Journal of the American Association for Laboratory Animal Science. 2011. Mar; 50, 2: 205–211.
- Кузнецов С.В., Дмитриева Л.Е., Сизонов В.А. Сердечная, дахательная и мотрная дейятельность в норме и после активации катехоаминергических систем у новорожденных крысят. Журнал эволюционной биохимии и физиологии. 2012. . 48; 4: 367–9. [Kuznetsov S.V., Dmitrieva L.E., Sizonov V.A. Cardiac, respiratory and motric activity is normal and after activation of catechoaminergic systems in newborn rat pups. Zhurnal ehvolyutsionnoi biokhimii i fiziologiI. 2012. 48; 4: 367–9 (in Russ)].
- Кузнецов С.В., Дмитриева Л.Е., Сизонов В.А. Сердечная, дахательная и мотрная дейятельность в норме и после активации катехоаминергических систем у новорожденных крысят. Журнал эволюционной биохимии и физиологии. 2012. . 48; 4: 367–9. [Kuznetsov S.V., Dmitrieva L.E., Sizonov V.A. Cardiac, respiratory and motric activity is normal and after activation of catechoaminergic systems in newborn rat pups. Zhurnal ehvolyutsionnoi biokhimii i fiziologiI. 2012. 48; 4: 367–9 (in Russ)].



