Интраназальное введение лекарственных средств лабораторным животным
Кательникова А.Е., Крышень К.Л., Зуева А.А., Макарова М.Н. Интраназальное введение лекарственных средств лабораторным животным. Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-09
Резюме
За последние десятилетия интраназальная доставка лекарственных средств (ЛС) приобретает особую актуальность не только для лечения острых и хронических заболеваний полости носа, а главным образом для доставки лекарственных веществ в центральную нервную систему (ЦНС) и/или системный кровоток. Высокая проницаемость и васкуляризация слизистой оболочки носа в сочетании с предотвращением эффекта первого прохождения действующего вещества через печеночный барьер и/или разрушения его в желудочно-кишечном тракте (ЖКТ) обеспечивают высокое системное всасывание тестируемого объекта, чем при пероральной доставке. Поэтому такая доставка дает более эффективное всасывание лекарственного вещества, чем при пероральном введении. Использование интраназального введения для более крупных молекул, не абсорбирующихся при пероральном введении, таких как пептидно-белковые ЛС и вакцины, также стало реальностью, даже несмотря что назальная абсорбция этих соединений уменьшается с увеличением их молекулярной массы. По мере того, как растет спрос на ЛС с интраназальным способом введения, увеличивается потребность в проведении их фармакодинамической и токсикологической оценки при выводе на фармацевтический рынок. Представлен обзор литературы по интраназальному способу введения ЛС лабораторным животным. Для оптимизации доставки вещества животному и минимизации неблагоприятных последствий этой процедуры требуются тщательное рассмотрение и планирование введения веществ лабораторным животным. В обзоре рассматриваются объемы введения, устройства для введения, а также межвидовые различия в строении носа, площади поверхности и физиологии носовых ходов, которые необходимо учитывать при планировании эксперимента. Для достижения необходимой мишени действующего вещества тестируемого объекта можно манипулировать такими переменными, как устройство для введения, объем и форма лекарства (жидкость, газ, пар, порошок), размер частиц, химические свойства и состав. При разработке протокола исследования на лабораторных животных с интраназальным способом введения необходимо учитывать 2 важных фактора, которые влияют на эффективность доставки: объем введения и использование анестезии при проведении манипуляции. От них будет зависеть относительное распределение действующего вещества в верхних и нижних дыхательных путях, а также попадание его в ЖКТ.
Введение
При разработке программы доклинических исследований важным компонентом дизайна эксперимента является способ введения тестируемого объекта (ТО) лабораторным животным. Поскольку в рамках одного эксперимента введение может быть повторным, дробным или многократным, причинять животным страдания, или даже привести к гибели, то это один из критических компонентов в протоколе исследования для этического комитета по соблюдению норм обращения с животными.
За последние 10 лет интраназальная доставка ЛС приобретает особую актуальность и практическую необходимость. Интраназальное введение представляет собой неинвазивный метод, который используется не только для местного воздействия ЛС, и системного за счет высокой васкуляризации слизистой оболочки носа, обеспечивающей поступление веществ в мозговой, а затем в системный кровоток, довольно большой по площади абсорбции, пористой и тонкой базальной мембраны эпителия носа [1–3]. Несмотря что пероральная доставка – широко применяемый метод, обеспечивающий системное действие лекарственных веществ, характеризующийся низкой биодоступностью; однако метод неприемлем в случае, когда действующее вещество разрушается в желудочно-кишечном тракте (ЖКТ) не проходит гематоэнцефалический барьер. В связи с этим необходим поиск альтернативных путей введения [4, 5]. Альтернативным пероральному способу доставки лекарственных веществ может быть такой способ, при котором: наступает быстрое развитие терапевтического эффекта; отсутствует эффект первого прохождения веществ через печеночный барьер (эффект «первого прохождения»); возможна доставка лекарственных веществ напрямую в ЦНС; существует высокая биодоступность, а также удобство и простота применения [5]. Благодаря вышеперечисленным преимуществам, к интраназальному способу введения появился интерес с точки зрения достижения при данном пути доставки системного действия препарата, не только его эффекта для лечения местных заболеваний носа и околоносовых пазух. Интраназальный способ доставки безопасен не требует соблюдения стерильных условий, может легко и быстро контролироваться самими пациентами.
Действительно, сегодня интраназальное введение (ИНВ) рассматривается как потенциальный альтернативный путь для системной доставки «небольших» лекарств, которые обычно вводятся парентерально или подвергаются разрушению при приеме перорально [6, 7]. Однако использование ИНВ более крупных молекул, не абсорбирующихся при пероральном введении, таких как пептидно-белковые ЛС и вакцины, также стало реальностью, даже несмотря что назальная абсорбция этих соединений уменьшается с увеличением их молекулярной массы [8]. Эпителиальный барьер слизистой носовых путей является препятствием для соединений, превышающих молекулярную массу 1000 Да [7]. В настоящее время на рынке продаются несколько пептидных и низкомолекулярных лекарств с интраназальным способом введения, в которых целью доставки является системное кровообращение (кальцитонин лосося и окситоцин) или ЦНС (суматриптан и золмитриптан) [9].
По мере того, как потребность в ЛС с интраназальным способом введения возрастает, возрастает и потребность в проведении их фармакодинамической и токсикологической оценки при выводе на фармацевтический рынок. Изучение ИНВ у лабораторных животных важно не только с точки зрения оценки безопасности при непосредственном введении, и использование данного пути для индукции патологий, например моделирование инфекции верхних или нижних дыхательных путей [10–14].
В настоящем обзоре по интраназальному способу введения лабораторным животным рассматриваются объемы введения, устройства для введения, а также межвидовые различия в строении носа, площади поверхности и физиологии носовых ходов, которые необходимо учитывать при планировании эксперимента.
Сравнительная анатомия
Хотя анатомия и физиология носа у разных видов млекопитающих в основном схожи, имеются также и существенные различия, которые необходимо учитывать при ИНВ и интерпретации результатов исследований. Например, человек и нечеловекообразные приматы имеют простую структуру внутренней части носовых ходов, то время как мыши, крысы, кролики и собаки – сложную [9]. Форма внутренней части носа, или «турбинаты», влияет на воздушный поток, в свою очередь действует на абсорбцию ТО. «Турбинатная» структура может также формировать большую площадь поверхности, которая влияет на поглощение ЛС [15].
В табл. 1 представлены относительный объем, площадь поверхности и сложность внутренней части носа у различных видов. Данные параметры важны для выбора доз в экспериментах при ИНВ, аналогично использованию массы или площади поверхности тела животного при расчете доз для ЛС, вводимых другими путями.
Таблица 1
Межвидовое сравнение объема, площади поверхности и сложности носовых ходов
|
Вид |
Объем, мл |
Общая площадь поверхности, см2 |
Сложность внутренней части носа |
Источник |
|
Человек |
19 |
180–181 |
Простая |
[16–20] |
|
Собака |
20 |
221 |
Очень сложная, мембранная |
[16–19] |
|
Обезьяна |
8 |
62 |
Простая |
[16–19] |
|
Кролик |
6 |
60–61 |
Сложная, мембранная |
[16–21] |
|
Крыса |
0,4 |
20 (10,4 для крысы массой тела до 250 г) |
Сложная |
[16–19 (20)] |
|
Мышь |
0,03 |
2,8 |
Сложная |
[16–19] |
Объемы введения, устройства для введения
Устройства для интраназальной доставки веществ обычно просты. Так, для мелких грызунов (крысы и мыши) используют пипетки или механические одноканальные дозаторы [9, 22] (рис. 1, а). В нашей организации дополнительно апробированы и применяются в качестве устройств для ИНВ внутривенный катетер без иглы и шприц Гамильтона (рис. 1, б, в).
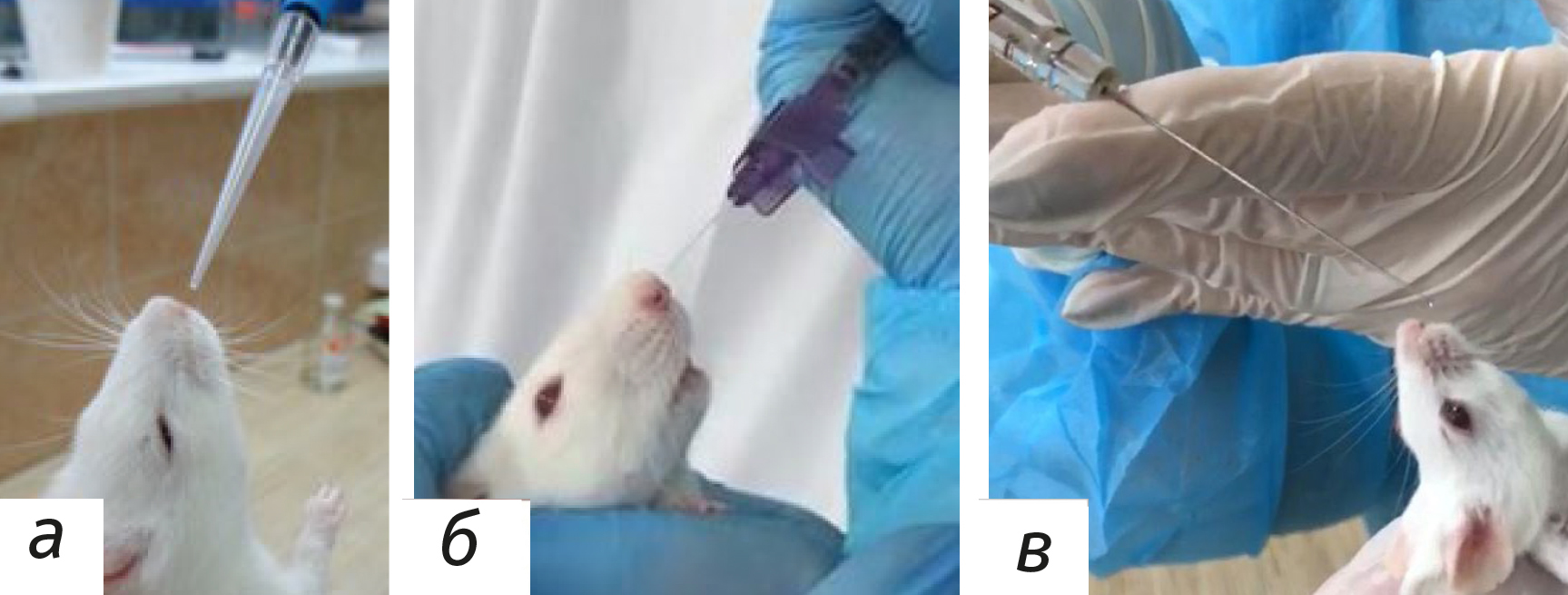
Подобное оборудование для ИНВ, а также введение с помощью шприца без иглы может использоваться не только у грызунов. Для крупных животных (обезьяны и собаки) можно применять устройства, планируемые в клинике у человека, включая спреи [9, 23]. Обратите внимание, что использование устройства, предназначенного для введения человеку, не требуется в доклинических исследованиях на животных, но может предоставить дополнительную информацию.
Перед процедурой ИНВ, если необходимо, животному выполняют общую анестезию и фиксируют в определенном положении. При проведении манипуляции наконечник устройства подносят на расстояние 1–2 мм от носового хода, выдавливают каплю, далее капля под своей тяжестью капает в носовой ход [22]. Важно учитывать, что после введения 1 капли перед следующей нужно делать паузу на 2–5 для предотвращения накапливания жидкости и ее проглатывания. В литературе рекомендовано вводить мелким грызунам на вдохе, позволяя капиллярному действию втягивать раствор в носовой ход [9]. Однако на практике это достаточно сложно осуществить, поскольку, например, частота дыхательных движений у крыс составляет 60–90 (внутрилабораторные нормы). Вставлять наконечник устройства в носовой ход животного или подносить слишком близко нельзя из-за возможной травматизации ходов, особенно при повторных введениях.
Основной проблемой ИНВ у мелких грызунов являются объемы препарата. Индивидуальные объемы для закапывания в носовой ход малы по сравнению с другими путями введения и ограничены, чтобы предупредить попадание жидкости в ЖКТ и минимизировать вероятность удушья и смерти животного [12, 23, 24]. Однако большие объемы могут быть введены животному путем деления общего объема на части с увеличением кратности введения. В случае, если животное не втягивает вводимую каплю или чихает при введении, это должно быть зафиксировано в первичных картах. Обычно интраназальное введение хорошо переносится у грызунов, в долгосрочных экспериментах с введением чаще, чем 3 раза в сутки, возможно снижение массы тела и раздражение слизистой носа [9].
Интраназальный способ доставки ТО хорошо переносится у собак. При введении собаке участвуют 2 лаборанта-исследователя, один держит животное в сидячем положении, второй немного наклоняет голову животного (примерно на 30°) в сторону. Устройство для введения вводят на 2–3 мм внутрь носового хода, не касаясь слизистой оболочки. После введения голову собаки немного приподнимают на 30 с, чтобы не вытекал из носа [9, 22]. У обезьян можно использовать ИНВ только в том случае, если это оправдано, так как данная процедура считается стрессовой для этого вида животных, поэтому рекомендуется ограничить объем и количество введений в день (табл. 2).
Таблица 2
Рекомендуемые объемы и дозы в день для интраназального введения у разных видов животных
|
Вид |
Устройство для введения |
Объем на 1 носовой ход, мкл |
Общий объем, мкл |
Кратность введения в день |
Источник |
|
Мышь |
Механический дозатор (внутривенный катетер без иглы, шприц Гамильтон)# |
5 |
30 |
3 |
[16–19] |
|
Крыса |
50 |
300 |
3 |
[16–19, 25] |
|
|
Обезьяна* |
Шприц без иглы, устройство для введения у человека |
500 |
3 000 |
3 |
[16–19, 25] |
|
Собака* |
500 |
6 000 |
6 |
[16–19, 25] |
|
|
Кролик* |
Механический дозатор, шприц без иглы |
300 |
1 800 |
3 |
[25] |
|
200 |
1 200 |
3 |
[26] |
Примечание: # – применяется в ООО «Институт доклинических исследований»; * – обезьянам, собакам, кошкам и кроликам возможно введение от 200 до 500 мкл на 1 животное от 100 до 250 в 1 носовой ход [22, 25, 27].
Несмотря на приведенные в табл. 2 данные по мышам, в опубликованных исследованиях объемы для однократного введения варьируют от 5 до 100 мкл [12, 24, 28, 29]. Как оказалось, выбор объема введения вещества, мишенью которого является дыхательная система, очень важен. Считается, что объем введения влияет на относительное распределение действующего вещества в верхних дыхательных путях (ВДП), нижних дыхательных путях (НДП) и попадание в ЖКТ. Однако по данному вопросу опубликовано мало работ, и все они посвящены изучению объемов при ИНВ мышам [9, 12, 24, 30–33].
Исследования Tsuyuki et al. [30] показали, что 75% от 50 мкл интраназально введенного синего красителя Эванса откладывалось в НДП, при этом краситель не обнаруживался в пищеводе или желудке. Eyles et al. [31] сообщили, что 48% от объема 50 мкл интраназально введенных 46Sc-меченых микросфер стирола и дивинилбензола обнаруживалось в НДП через 15 мин после введения, то время как Takafuji et al. [32] то же время обнаружили, что только 19% из 25 мкл объема 125I-меченного овальбумина обнаруживалось в НДП. Southam at al. [24] в экспериментах с меченным 99mTc-SC коллоида сульфидом расширили наблюдения Eyles et al. [31], придя к выводу, для оптимальной доставки лекарства в НДП наркотизированным мышам, объем введения должен составлять 35 мкл. Относительное распределение действующего вещества по ВДП лучше всего достигается при ИНВ наркотизированным мышам 5 мкл.
Аналогичные результаты были получены для мышей в эксперименте с использованием ИНВ бактерий, несущих люминисцентный репортерный вектор [12]. Через 24 ч после заражения каждую мышь сканировали с помощью системы визуализации IVIS Spectrum (рис. 2, а). Визуальные исследования выявили явное отличие люминесцентного сигнала в ВДП от такового в легких, которое коррелировало с объемом введения. Регистрировали очень слабое свечение от легких мышей, зараженных с использованием объемов 10 или 20 мкл, и выраженное свечение в легких у мышей, которым вводили большие объемы (50 мкл или 100 мкл). Таким образом, при введении больших объемов большая часть люминофора попадала в легкие, в ВДП. Эти результаты были подтверждены после эвтаназии мышей, выполненной сразу после завершения визуализации, путем определения бактериальной нагрузки в легких (рис. 2, б).
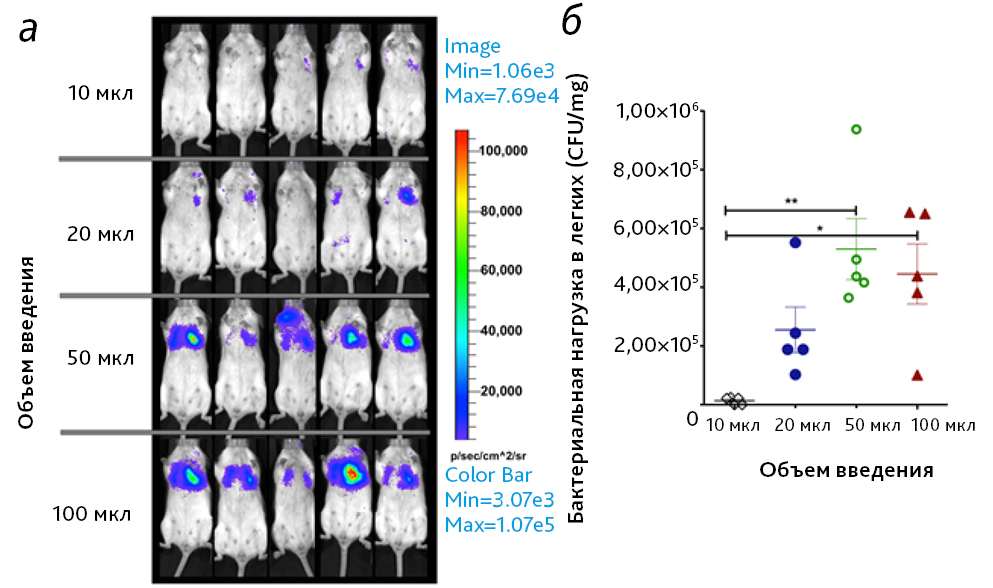
Авторы данного исследования пришли к выводу, что закапывание в небольших объемах (10 мкл) приводит к осаждению возбудителя в ВДП (в основном в носу), тогда как введение в больших объемах (50–100 мкл) приводит к доставке вещества в легкие.
Анестезия. Положение животного при введении
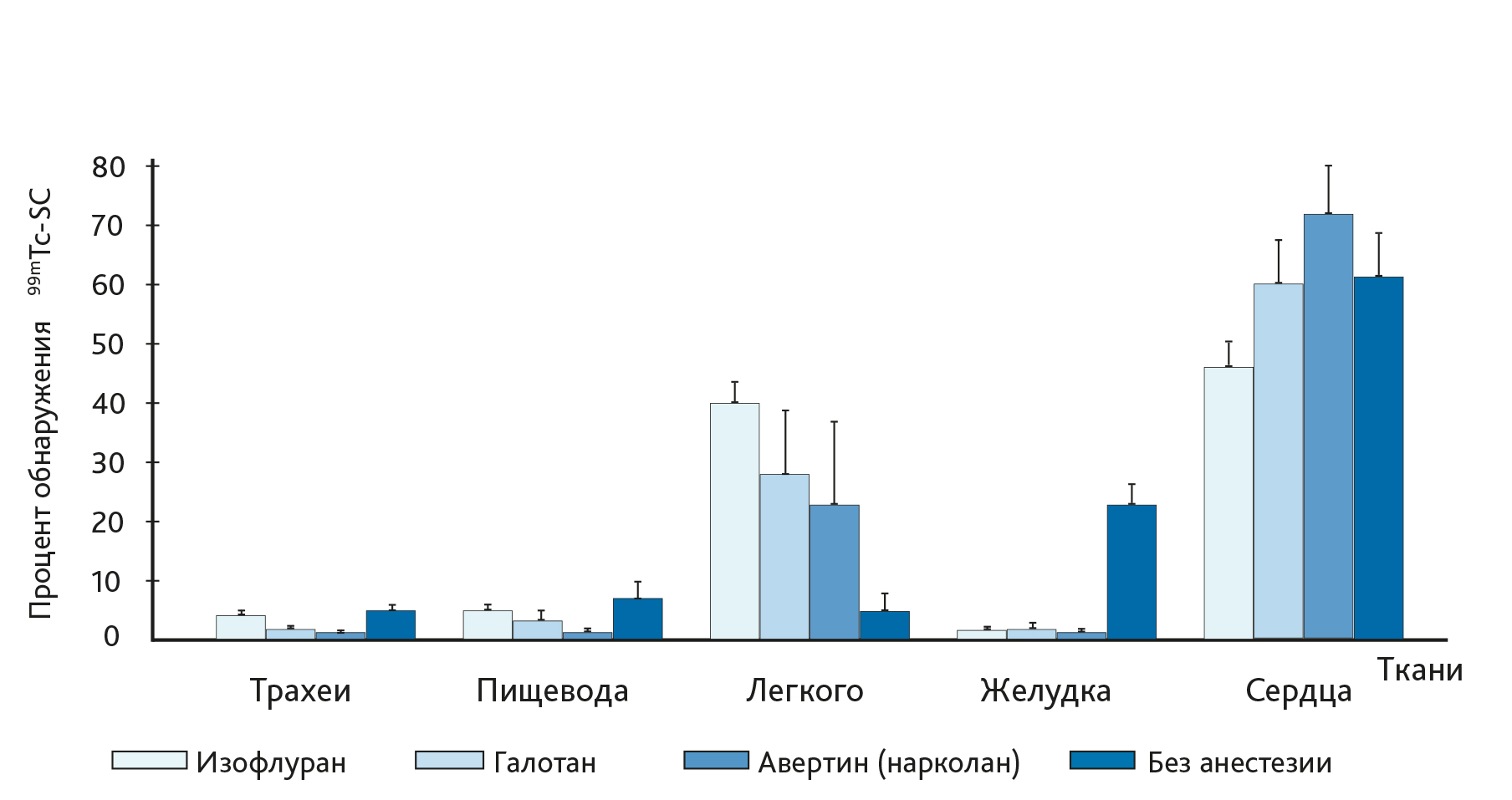
Анестезия во время ИНВ – еще один фактор, который может оказать существенное влияние на эффективность доставки действующего вещества в ВДП или НДП. В экспериментальных исследованиях с использованием ИНВ авторы подчеркивают, что объем введения для достижения распределения ЛС в НДП может быть увеличен, если его вводить бодрствующему животному [24, 33, 34]. Фактически, согласно данным исследования, когда ИНВ проводилось на активных мышах, большая часть вводимой жидкости попала в ЖКТ, что указывает что активные животные способны проглатывать значительную часть вводимого объема [26, 33]. С учетом этих результатов и, вероятно, из-за того, что ИНВ технически легче выполнить на наркотизированных животных, большинство исследователей перед процедурой используют легкий наркоз. Southam et al. [24] изучали влияние на доставку веществ разных видов анестезии (парентеральной и ингаляционной). Авторы пришли к выводу, что наличие, не вид анестезии, влияет на распределение вещества в дыхательной системе (рис. 3). У бодрствующих мышей увеличена радиоактивность (накопление 99mTc-SC) в тканях пищевода и желудка по сравнению с наркотизированными животными (см. рис. 3). Это подтверждает результаты ранних исследований в пользу проглатывания жидкости активными животными при ИНВ [26, 33]. Кроме того, в данной работе оценено влияние положения животного во время интраназального введения на распределение действующего вещества (рис. 4).
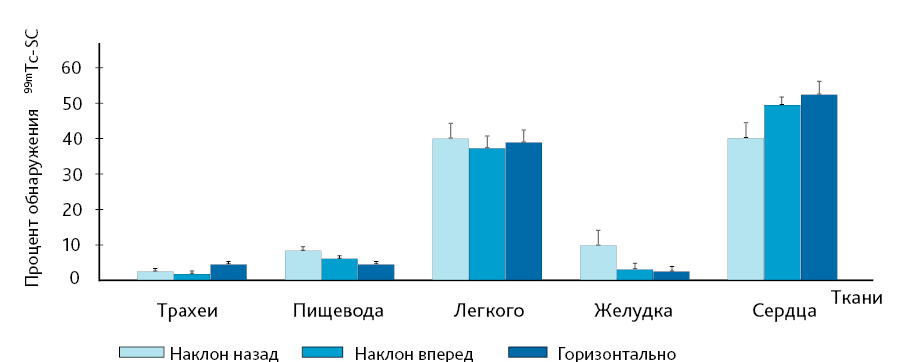
Положение мышей во время введения не влияет на относительное распределение радиоактивности в тканях, хотя при наклоне животного назад, имеется тенденция к накоплению вещества в желудке (см. рис. 4). Общепринято мелких лабораторных животных (крысы и мыши) при ИНВ держать так, чтобы носовые ходы были направлены вверх |22| (см. рис. 1), хотя некоторые авторы настаивают на положении животного на спине для обеспечения полного попадания ТО [26].
Дизайн и оценка токсичности при интраназальном введении
Дизайн исследования при изучении токсичности ЛС путем ИНВ не отличается от таковой с другими способами введения [35, 36, 37]. Как правило, предполагается использование одного и того же пути введения, концентрации препарата и режима дозирования (длительности и частоты), аналогичный или превышающий предполагаемый курс при клиническом применении. Тем не менее для препаратов с ИНВ достижение кратных доз и/или аналогичной частоты введения относительно доз, используемых в клинических испытаниях, затруднительно с точки зрения соблюдения принципов гуманности при обращении с животными. Кратность доз, превышающая в 10–20 раз терапевтические, может быть достигнута на основе различий в общей площади поверхности носовых ходов между человеком и лабораторными животными (см. табл. 1). В некоторых случаях частота введения может увеличиваться для увеличения общей суточной дозы ТО.
Программа оценки безопасности, как правило, должна включать исследования на 2 видах животных (грызуны не грызуны). в любом токсикологическом исследовании, вид грызунов и/или не грызунов должен быть обоснован.
Что касается количества животных в группе, то отдельных требований к изучению токсичности с ИНВ нет. В эксперименте, как правило, контрольной группе животных вводят носитель, но если в составе ТО присутствуют новые или ранее неиспользованные вспомогательные компоненты, рекомендуется введение дополнительной группы животных, которая будет получать физиологический раствор.
В дополнение ко всем стандартным показателям, изучаемым в токсикологических исследованиях (масса тела, оценка потребления корма и воды, клиническое наблюдение, клинический осмотр, клинический и биохимический анализ крови, массовые коэффициенты внутренних органов и др.), могут потребоваться специфические для ИНВ показатели. Для некоторых ТО является оценка влияния на обоняние, включая определение развития у животного аносмии. Существуют модели на животных для оценки обонятельной функции, например, тест «скрытого печенья», определение восприятия запаха, его распознавания и привыкания [38, 39].
Болевые рецепторы в носу не покрыты плоскоклеточным эпителием, что дает химическим стимулам почти прямой доступ к свободным нервным окончаниям, что может привести к раздражению верхних дыхательных путей и изменению характера дыхания у животного [40]. Оценка раздражения важна, поскольку наблюдается корреляция между снижением частоты дыхания у мышей и раздражением у людей, подвергшихся воздействию химических и загрязняющих веществ [41].
Особое значение в токсикологических исследованиях при ИНВ имеет гистопатологическая оценка полости носа. Для микроскопического изучения достаточно сделать 4–6 целых срезов носа животного [19, 42]. Если ТО обладает способностью воздействовать на ЦНС, следует провести дополнительную оценку обонятельной области мозга [43]. Кроме того, интраназальное введение ТО может оказать воздействие на ротоглотку, гортань, трахею и легкое, а также на пищевод и желудок, поэтому макро- и микроскопическим исследованиям данных тканей необходимо уделять особое внимание. Следует оценивать и гистопатологическое строение лимфатических узлов, региональных к месту введения (подчелюстные, трахеобронхиальные и средостения).
К микроскопическим характеристикам слизистой оболочки носа относят: резорбцию или потерю ресничек мерцательного эпителия, дедифференцировку эпителиальных клеток, гиперплазию/метаплазию бокаловидных клеток, эозинофилию, воспаление, отек, дегенерацию, атрофию, некроз и изъязвление слизистой оболочки и гиперостоз носовых раковин [42, 44]. Следует отметить, что гиперплазия бокаловидных клеток и эозинофилия, обнаруженные при токсикологических исследованиях у грызунов, имеют мало отношения к патологии у человека [9].
Заключение
Преимущества интраназального способа доставки лекарственных средств открывают новые возможности для достижения не только местного, но главным образом системного эффекта Для достижения необходимой мишени действующего вещества ТО можно манипулировать такими переменными, как устройство для введения, объем и форма лекарства (жидкость, газ, пар, порошок), размер частиц, химические свойства и состав. Межвидовые различия в строении носа, площади поверхности и физиологии важны для понимания и интерпретации результатов фармакодинамических и токсикологических исследований, поскольку токсичность может проявляться локально и/или системно, изменяя как структуру, так и функцию. При разработке протокола исследования на лабораторных животных с интраназальным способом введения необходимо учитывать 2 важных фактора, которые влияют на эффективность доставки – объем введения и использование анестезии при проведении манипуляции.
Список источников
- Fortuna A., Alves G., Serralheiro A., Sousa J., Falcao A. Intranasal delivery of systemic-acting drugs: small-molecules and biomacromolecules. Eur. J. Pharm. Biopharm. 2014. Vol. 88 (1): 8–27. doi: 10.1016/j.ejpb.2014.03.004.
- Grassin-Delyle S., Buenestado A., Naline E., Faisy C., Blouquit-Laye S., Couderc L., Le Guen M., Fischler M., Devillier P. Intranasal drug delivery: an efficient and non-invasive route for systemic administration: focus on opioids. Pharmacol. Ther. 2012. Vol. 134 (3): 366–79. doi: 10.1016/j.pharmthera.2012.03.003.
- Jadhav K., Gambhire M., Shaikh I., Kadam V.J., Pisal S.S., Nasal Drug Delivery System-Factors Affecting and Applications. Curr. Drug Ther. 2007. Vol. 2 (1): 27–38. doi: https://doi.org/10.2174/157488507779422374.
- Pires A., Fortuna A., Alves G., Falcão A. Intranasal drug delivery: how, why and what for? J. Pharm. Pharm. Sci. 2009. Vol. 12 (3): 288–311.
- Привалова А.М., Гуляева Н.В., Букреева Т.В. Интраназальное введение перспективный способ доставки лекарственных веществ в мозг. Нейрохимия. 2012; 29 (2): 93.
- Bitter C., Suter-Zimmermann K., Surber C. Nasal drug delivery in humans. Curr. Probl. Dermatol. 2011. Vol. 40: 20–35. doi: 10.1159/000321044.
- Illum L. Nasal drug delivery – recent developments and future prospects. J. Control. Release. 2012. Vol. 161(2): 254–63. doi: 10.1016/j.jconrel.2012.01.024.
- Bhise S.B., Yadav A.V., Avachat A.M., Malayandi R. Bioavailability of intranasal drug delivery system. Asian J. Pharm. 2008. Vol. 2 (4): 201–15. doi: http://dx.doi.org/10.22377/ajp.v2i4.203.
- Emami A., Tepper J., Short B., Yaksh T. L., Bendele A.M., Ramani T., Mellon R.D. Toxicology evaluation of drugs administered via uncommon routes: intranasal, intraocular, intrathecal/intraspinal, and intra-articular. Int. J. Toxicol. 2018. Vol. 37 (1): 4–27. doi: 10.1177/1091581817741840.
- Dallaire F., Ouellet N., Bergeron Y., Turmel V., Gauthier M.C., Simard M., Bergeron M.G. Microbiological and inflammatory factors associated with the development of pneumococcal pneumonia. J. Infect. Dis. 2001. Vol. 184 (3): 292–300. doi:10.1086/322021.
- Munster V.J., de Wit E., Feldmann H. Pneumonia from human coronavirus in a macaque model. N. Engl. J. Med. 2013. Vol. 368 (16): 1560–2. doi: 10.1056/NEJMc1215691.
- Miller M.A., Stabenow J.M., Parvathareddy J., Wodowski A.J., Fabrizio T.P., Bina X.R., Zalduondo L., Bina J.E. Visualization of murine intranasal dosing efficiency using luminescent Francisella tularensis: effect of instillation volume and form of anesthesia. PloS one. 2012. Vol. 7(2): e31359. doi: 10.1371/journal.pone.0031359.
- Bao Y., Gao Y., Koch E., Pan X., Jin Y., Cui X. Evaluation of pharmacodynamic activities of EPs® 7630, a special extract from roots of Pelargonium sidoides, in animals models of cough, secretolytic activity and acute bronchitis. Phytomedicine. 2015. Vol. 22 (4): 504–9. doi: 10.1016/j.phymed.2015.03.004.
- Beigelman A., Mikols C.L., Gunsten S.P., Cannon C.L., Brody S.L., Walter M.J. Azithromycin attenuates airway inflammation in a mouse model of viral bronchiolitis. Respir. Res. 2010. Vol. 11(1): 90. doi: 10.1186/1465-9921-11-90.
- Harkema J.R. Comparative anatomy and epithelial cell biology of the nose. In: Parent RA, ed. Comparative Biology of the Normal Lung. 2nd ed. San Francisco, CA: Elsevier; 2015:7-18. Chapter 2.
- Gizurarson S. Animal models for intranasal drug delivery studies. A review article. Acta. Pharm. Nord. 1990. Vol. 2 (2): 105–22.
- M´enache M.G., Hanna L.M., Gross E.A., Lou S.R. Zinreich S.J., Leopold D.A., Jarabek A.M., Miller F.J. Upper respiratory tract surface areas and volumes of laboratory animals and humans: considerations for dosimetry models. J. Toxicol. Environ. Health. 1997. Vol. 50(5): 475–506. doi:10.1080/00984109708984003.
- Gross E., Morgan K. Architecture of the nasal passages and larynx. In: Parent RA. Comparative Biology of the Normal Lung: A Treatise on Pulmonary oxicology. 1992. Vol. 1: 7–25.
- Morgan K.T. Approaches to the identification and recording of nasal lesions in toxicology studies. Toxicol. Pathol. 1991. Vol. 19(4): 337–51.
- Witschi H., Espiritu I., Pinkerton K.E. Pulmonary cell kinetics and morphometry after ozone exposure: day versus night and dose response in rats. Am. J. Physiol. 1997. Vol. 272(6): L1152-L1160. doi:10.1152/ajplung.1997.272.6.L1152.
- Gizurarson S., Bechgaard E., Hjortkjær R.K. Two intranasal administration techniques give two different pharmacokinetic results. Scand. J. Lab. Anim. Sci. 2006. Vol. 33 (1): 35–8. doi: https://doi.org/10.23675/sjlas.v33i1.96.
- Morton D.B., Jennings M., Buckwell A., Ewbank R., Godfrey C., Holgate B., Inglis I., James R., Page C., Sharman I., Verschoyle R., Westall L., Wilson A.B. Refining procedures for the administration of substances. Lab. Anim. 2001. Vol. 35 (1): 1–41. doi:10.1258/0023677011911345.
- Wolff R.K. Toxicology studies for inhaled and nasal delivery. Mol. Pharm. 2015. Vol. 12 (8): 2688–96. doi: 10.1021/acs.molpharmaceut.5b00146.
- Southam D.S., Dolovich M., O'Byrne P.M., Inman M. D. Distribution of intranasal instillations in mice: effects of volume, time, body position, and anesthesia. Am. J. Physiol. Lung Cell Mol. Physiol. 2002. Vol. 282(4): L833-L839 doi: 10.1152/ajplung.00173.2001.
- IACUC Routes of Administration Guidelines. URL: https://drive.google.com/file/d/0B4clNGOYSdMYOHA3MlZiREk3OGs/view.
- Макаренко И.Е., Авдеева О.И., Ванатиев Г.В., Рыбакова А.В., Ходько С.В., Макарова М.Н., Макаров В.Г. Возможные пути и объемы введения лекарственных средств лабораторным животным. Международный вестник ветеринарии. 2013; 3: 78–84.
- Turner P.V., Brabb T., Pekow C., Vasbinder M.A. Administration of substances to laboratory animals: routes of administration and factors to consider. J. Am. Assoc. Lab. Anim. Sci. 2011. Vol. 50 (5): 600–13.
- Tebbey P.W., Unczar C.A., LaPierre N.A., Hancock G.E. A novel and effective intranasal immunization strategy for respiratory syncytial virus. Viral. Immunol. 1999. Vol. 12 (1): 41–5. doi:10.1089/vim.1999.12.41.
- Charpoval S., Nabozny G., Marietta E.V., Raymond E.L., Krco C.J., Andrivet P. Short ragweed allergen induces eosinophilic lung disease in HLA-DQ transgenic mice. J. Clin. Invest. 1999. Vol. 103 (12): 1707–17. doi:10.1172/JCI6175.
- Tsuyuki S., Tsuyuki J., Einsle K., Kopf M., Coyle A.J. Costimulation through B7–2 (CD86) is required for the induction of a lung mucosal T helper cell 2 (Th2) immune response and altered airway responsiveness. J. Exp. Med. 1997. Vol. 185 (9): 1671–9. doi:10.1084/jem.185.9.1671.
- Eyles J.E., Williamson E.D., Alpar H.O. Immunological responses to nasal delivery of free and encapsulated tetanus toxoid: studies on the effect of vehicle volume. Int. J. Pharmaceut. 2000. Vol. 189 (1): 75–9.
- Takafuji S., Suzuki S., Koizumi K., Tadokoro K., Miyamoto T., Ikemori R., Muranka M. Diesel exhaust particulates inoculated by the intranasal route have an adjuvant activity for IgE production in mice. J. Allergy. Clin. Immunol. 1987. Vol. 79 (4): 639–45.
- Visweswaraiah A., Novotny L.A., Hjemdahl-Monsen E.J., Bakaletz L.O., Thanavala Y. Tracking the tissue distribution of marker dye following intranasal delivery in mice and chinchillas: a multifactorial analysis of parameters affecting nasal retention. Vaccine. 2002. Vol. 20 (25–26): 3209–20.
- Ebino K., Lemus R., Karol M.H. The importance of the diluent for airway transport of toluene diisocyanate following intranasal dosing of mice. Inhal. Toxicol. 1999. Vol. 11 (3): 171–85. doi:10.1080/089583799197131.
- Guideline I. C. H. H. T. Guidance on nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals M3 (R2). International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use. 2009. URL: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M3_R2/Step4/M3_R2__Guideline.pdf.
- Guideline I. C. H. H. T. Preclinical safety evaluation of biotechnology-derived pharmaceuticals S6 (R1). Proceedings of the International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. 2011. URL: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S6_R1/Step4/S6_R1_Guideline.pdf.
- US Food and Drug Administration. Guidance for Industry and Review Staff: Nonclinical Safety Evaluation of Reformulated Drug Products and Products Intended for Administration by an Alternate Route. 2015. URL: https://www.govinfo.gov/content/pkg/FR-2015-10-28/pdf/2015-27418.pdf.
- Rattazzi L., Cariboni A., Poojara R., Shoenfeld Y., D’Acquisto F. Impaired sense of smell and altered olfactory system in RAG-1(-/-) immunodeficient mice. Front Neurosci. 2015. Vol. 9: 318. doi: 10.3389/fnins.2015.00318.
- Yang M., Crawley J.N. Simple behavioral assessment of mouse olfaction. Curr. Protoc. Neurosci. 2009. Chapter 8: Unit 8.24. doi:10.1002/0471142301.ns0824s48.
- American Society for Testing and Materials. Standard Test Method for Estimating Sensory Irritancy of Airborne Chemicals. ASTM E 981: 2019.
- Kuwabara Y., Alexeeff G.V., Broadwin R., Salmon A.G. Evaluation and application of the RD50 for determining acceptable exposure levels of airborne sensory irritants for the general public. Environ Health Perspect. 2007. Vol. 115(11):1609-1616. doi:10.1289/ehp.9848.
- Harkema J.R., Carey S.A., Wagner J.G. The nose revisited: a brief review of the comparative structure, function, and toxicologic pathology of the nasal epithelium. Toxicol. Pathol. 2006. Vol. 34 (3): 252–69. doi:10.1080/01926230600713475.
- Rao D.B., Little P.B., Malarkey D.E., Herbert R.A., Sills R.C. Histopathological evaluation of the nervous system in National Toxicology Program rodent studies: a modified approach. Toxicol. Pathol. 2011. Vol. 39 (3): 463–70. doi: 10.1177/0192623311401044.
- Tepper J.S., Kuehl P.J., Cracknell S., Nikula K.J., Pei L., Blanchard J.D. Symposium summary: “breathe in, breathe out, its easy: what you need to know about developing inhaled drugs”. Int. J. Toxicol. 2016. Vol. 36 (4): 376–92. doi: 10.1177/1091581815624080.



