Аппаратный способ определения стадий эстрального цикла у мелких лабораторных грызунов
Белозерцева И.В., Меркулов Д.Д., Вилитис О.Е., Скрябин Б.В. Аппаратный способ определения стадий эстрального цикла у мелких лабораторных грызунов. Лабораторные животные для научных исследований. 2018; 4. https://doi.org/10.29296/2618723X-2018-04-10
Резюме
Резюме. На самках мышей и крыс выполнена апробация нового инструментального метода/устройства для определения стадий эстрального цикла у мелких грызунов. Циклические изменения активного сопротивления (RS) слоя эпителиальных клеток слизистой оболочки влагалища измеряли с помощью нового детектора MED-PRO 100 (Elmi Ltd., Latvia). Активное сопротивление измеряли на частоте 1 кГц, вставляя зонд детектора (l = 14 мм, d = 1,82 мм; диапазон измерения – 0–50 кОм) во влагалище животного на 1–2 с. Результаты измерений соотносили с цитологической картиной влагалищных мазков, классического способа определения стадий эстрального цикла. Было установлено, что новый метод дает точное определение стадии в «пиковых» значениях и его целесообразно использовать, поскольку он нетравматичен для животного и не так трудоемок, как классический цитологический метод. Построенные кривые активного сопротивления для нескольких эстральных циклов были схожи (особенно у крыс), а изменения активного сопротивления соответствовали стадиям, определяемым по цитологической картине мазков. Однако максимальные значения активного сопротивления соответствовали разным стадиям цикла у мышей и крыс. У крыс активное сопротивление было значимо больше в проэструсе (>5 кОм) по сравнению с другими стадиями цикла и в метэструсе по сравнению с эструсом и диэструсом. У мышей максимальному значению активного сопротивления соответствовала стадия эструса. Мы пришли к выводу, что использование устройства MED-PRO 100 обеспечивает точный подход к оценке эстрального цикла у крыс и мышей. Это может быть использовано для определения оптимального времени скрещивания животных; гормональной суперовуляции или технологий искусственного оплодотворения, а также для оптимизации поведенческих, фармакологических и токсикологических исследований, выполняемых на самках лабораторных грызунов.
Введение
Проведение фармакологических [1, 2] и токсикологических [3] исследований на самках лабораторных грызунов; выбор оптимального времени скрещивания для получения беременных (или псевдобеременных) самок при создании трансгенных животных или искусственном оплодотворении [3, 5, 6, 7], поддержания колоний лабораторных животных, особенно линий с низкой фертильностью [8], а также вскрытие для морфологических исследований [3], требуют определения стадии эстрального цикла. Учет данного фактора может оптимизировать выполнение «профильных» экспериментов и повысить результативность воспроизводства лабораторных животных. Начиная с 20-х годов ХХ века [9, 10] используется метод оценки цитологической картины смыва или мазка из влагалища самки («золотой стандарт») для определения стадии эстрального цикла, в котором она находится. Данная процедура выполняется в несколько этапов, требующих определенных временных затрат, а также наличие микроскопа и ряда расходных материалов – пипеток, предметных стекол, красителей и пр. При этом способы окрашивания мазков и субъективность анализа готовых препаратов предварительно обученным персоналом также могут влиять на конечные результаты. Кроме прочего было показано, что многократные ежедневные смывы и взятие мазков с помощью тампонов могут нарушать протекание циклов [11] и даже вызывать ороговение клеток эпителия влагалища у овариэктомированных самок крыс [12]. В связи с этим, поиск быстрого и надежного аппаратного способа определения стадий полового цикла у самок лабораторных животных представляется весьма актуальной задачей.
Разработки детекторов для определения времени овуляции по электрическому сопротивлению стенок влагалища у сельскохозяйственных видов животных начались довольно давно. Еще в 1961 г. в СССР было оформлено авторское свидетельство «Способ определения оптимального времени осеменения коров» [13], а чуть позже был получен патент №178602 на прибор для измерения электрического сопротивления стенок влагалища у коров [14]. Упоминание о детекторах стадий полового цикла у лабораторных грызунов – крыс [15, 16, 17] и морских свинок [18] начали появляться с конца 1970-х гг. Однако до настоящего времени среди доступных коммерческих детекторов не существует надежного аппарата для мышей, о чем некоторые производители данного оборудования открыто предупреждают на своем сайте (например, для Model МК-12 (Muromachi Kikai Co., Ltd., Япония) – https://muromachi.com/en/archives/english/2108/).
В 2015 г. в компании Elmi (Латвия) была начата разработка детектора MED-PRO (рис. 1), ориентированного в первую очередь на определение стадий эстраль-ного цикла у мышей. В настоящее время эта разработка защищена патентом LV15278 [19].

В существующих детекторах эстрального цикла грызунов электрическое сопротивление слизистой влагалища определяется измерением электрического импеданса (Z), который представляет собой геометрическую сумму активного сопротивления (АС) электрической цепи RS и реактивного сопротивления XС :
Z2 = RS2 + XС2.
RS является величиной, обратной величине электропроводности ткани, которая мало зависит от частоты переменного тока, в то время как реактивная составляющая XС импеданса зависит от частоты электрического тока.
При измерениях на переменном токе Z зависит от наличия границ раздела в системе, на которых может происходить накопление зарядов – поляризация. Свойства границ раздела (в биологическом объекте это главным образом различные мембраны клеток) могут быть описаны, если учесть емкость С, сопротивление которой XС зависит от частоты, на которой производится измерение:
XС = -1/(ωC),
где ω = 2π f – круговая частота, f – частота в Гц.
Измерение электропроводимости биологических систем на постоянном токе крайне затруднено из-за высокой степени поляризации на поверхностях мембран клеток и электродов зонда, поэтому для измерений применяют переменный ток.
Для существенного повышения точности измерений в новом детекторе эстрального цикла MED-PRO 100 применен метод синхронного детектирования [19], который обеспечивает селективное измерение только компоненты активной части сопротивления RS, устраняя, таким образом, влияние C на результат измерения.
В отличие от массивных зондов у ныне существующих детекторов эстрального цикла, требующих времени на температурную
стабилизацию показателя, созданный в Elmi детектор MED-PRO 100 имеет зонд миниатюрных размеров (рис. 1, справа). Он
имеет два электрода (∅ = 1,82 мм, шириной по 1,2 мм,
материал – AISI316, зазор между
электродами – 1,2 мм) с малой теплоемкостью способствует быстрому (<1 с) выравниванию температуры между
датчиком и тканями. Кроме этого, введение во влагалище зонда минимального размера оказывает менее стрессовое и
травмирующее воздействие на самок мышей, способствуя тем самым точности выполняемого измерения. Основные технические
характеристики детектора MED-PRO 100 приведены в табл. 1.

В 2016 году опытные образцы MED-PRO 100 были переданы в исследовательские лаборатории для апробации у животных.
Замеры активного сопротивления (АС) стенок влагалища выполняли у мышей и крыс, предварительно прирученных к рукам
экспериментатора. Зонд вводили во влагалище на полную длину (рис. 2), при этом у крыс его смещали в одну из сторон,
прижимая
к стенке влагалища на 1–2 с. После каждого измерения зонд обтирали спиртосодержащей
салфеткой.

При правильной фиксации самок мышей стабилизация показателя АС происходила в течение первой секунды. Из-за миниатюрности зонда при выполнении измерений у крыс было cложно обеспечить постоянную площадь соприкосновения датчика со стенкой влагалища, в связи с чем при пиковых значениях показателя, колебания могли достигать ±1 кОм (до 10%). В этом случае регистрировали расчетную величину – среднее арифметическое.
Для верификации инструментального метода определения стадии эстрального цикла использовали традиционный метод влагалищных мазков, оценивая соотношение эпителиальных клеток с ядрами, лейкоцитов и ороговевших клеток эпителия («чешуек»). Смывы влагалища делали сразу после измерения АС. Использовали стерильный 0,9% изотонический раствор (автоматические пипетки со сменными наконечниками, 25 мкл) для мышей и дистиллированную воду (глазные пипетки, около 70 мкл) для крыс.
У мышей наблюдали высокую индивидуальную вариабельность показателей АС, при этом пиковые значения соответствовали стадии эструса (рис. 3). Это согласуется с недавно опубликованными данными [19], полученными с использованием разработанного для крыс детектора Model MK-11 (Muromachi Kikai Co., Токио, Япония) и сенсора для мышей MP-35 (∅ = 3,5 мм, покрытые золотом электроды шириной 3 и 1 мм размещены с зазором 3 мм). В данном исследовании измерения импеданса выполняли у мышей, находящихся под анестезией, что обеспечивало стабильную локализацию закрепленного в стереотаксической установке зонда и сопоставимость оказываемого им давления на стенки влагалища, поскольку ранее авторами было выявлена высокая вариабельность биоэлектрического импеданса влагалища при выполнении измерений далее 7 мм от устья матки [19]. Приводимые в работе показатели также свидетельствуют о высокой индивидуальной вариабельности измеряемого показателя: в проэструсе – 1,69±1,63 кОм (n=18); в эструсе – 3,78±2,24 кОм (n=20); в метэструсе – 1,11±0,68 кОм (n=12); в диэструсе – 0,97±0,32 кОм (n=13). В более ранней работе [21], где использовался тот же детектор, было показано, что у самок мышей CD-1 уровень импеданса всегда выше в переходный период от проэструса к эструсу и в эструсе, при этом колебания импеданса более выражены у молодых самок (3 мес > 15 мес) и полностью сглаживаются к 20 месячному возрасту.
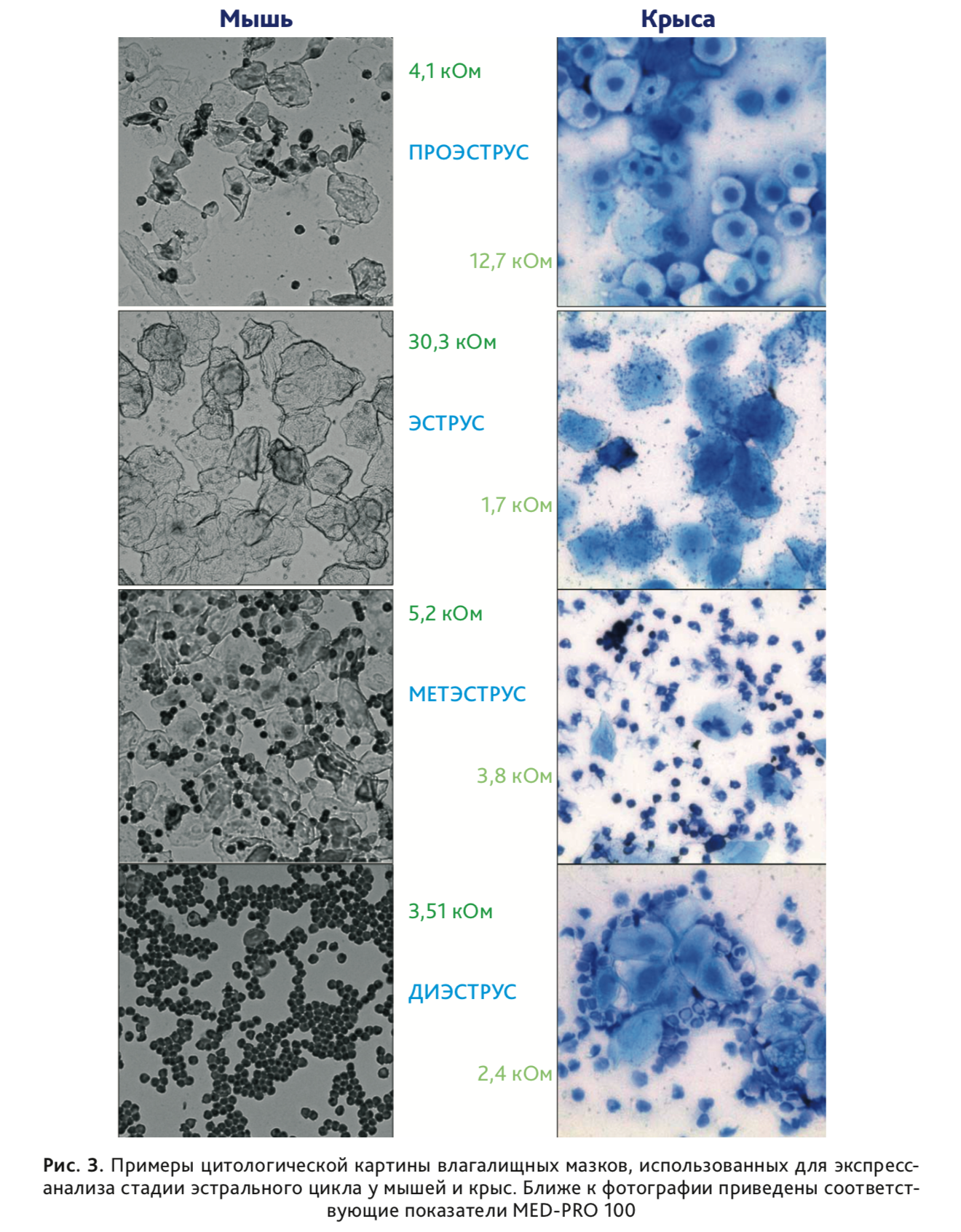
В отличие от самок мышей, у крыс стока Wistar в возрасте 3 мес, содержащихся в группах однопометников, наблюдали
регулярные циклы колебания АС стенок влагалища. Замеры производили ежедневно за 1-2 часа до наступления темной фазы
суточного цикла (12 ч свет /12 ч темнота). У 72% самок (n=61) длительность цикла составляла 4 дня (рис. 4).
Усредненные по 5 циклам показатели АС стенки влагалища (n=44) представлены на рис. 5. Однофакторный дисперсионный
анализ (на рангах) с повторными измерениями показал значимые различия АС стенки влагалища у крыс, находящихся в
разных фазах эстрального цикла (Fr=476,7, df=3, p<0,001). Максимальное значение АС наблюдали в
фазу проэструса (рис. 3 и 5). Кроме «основного пика» АС в стадии проэструса наблюдали значимое
увеличение данного показателя на третий день эстрального цикла (стадия метэструса) по сравнению как с предшествующим
(эструс), так и с последующим (диэструс) днями (рис. 4 и 5). Сходный диапазон изменения АС стенки влагалища
(0,9–17 кОм, данные не представлены) регистрировали у самок НП (линия с низким порогом возбудимости –
высоковозбудимая) и ВП (линия с высоким порогом возбудимос-
ти – низковозбудимая) крыс [22]. Полученные
результаты о пиковых значениях АС стенок влагалища самок крыс в стадии проэструса согласуются с результатами более
ранних работ, в которых оценивали импеданс [18, 23].
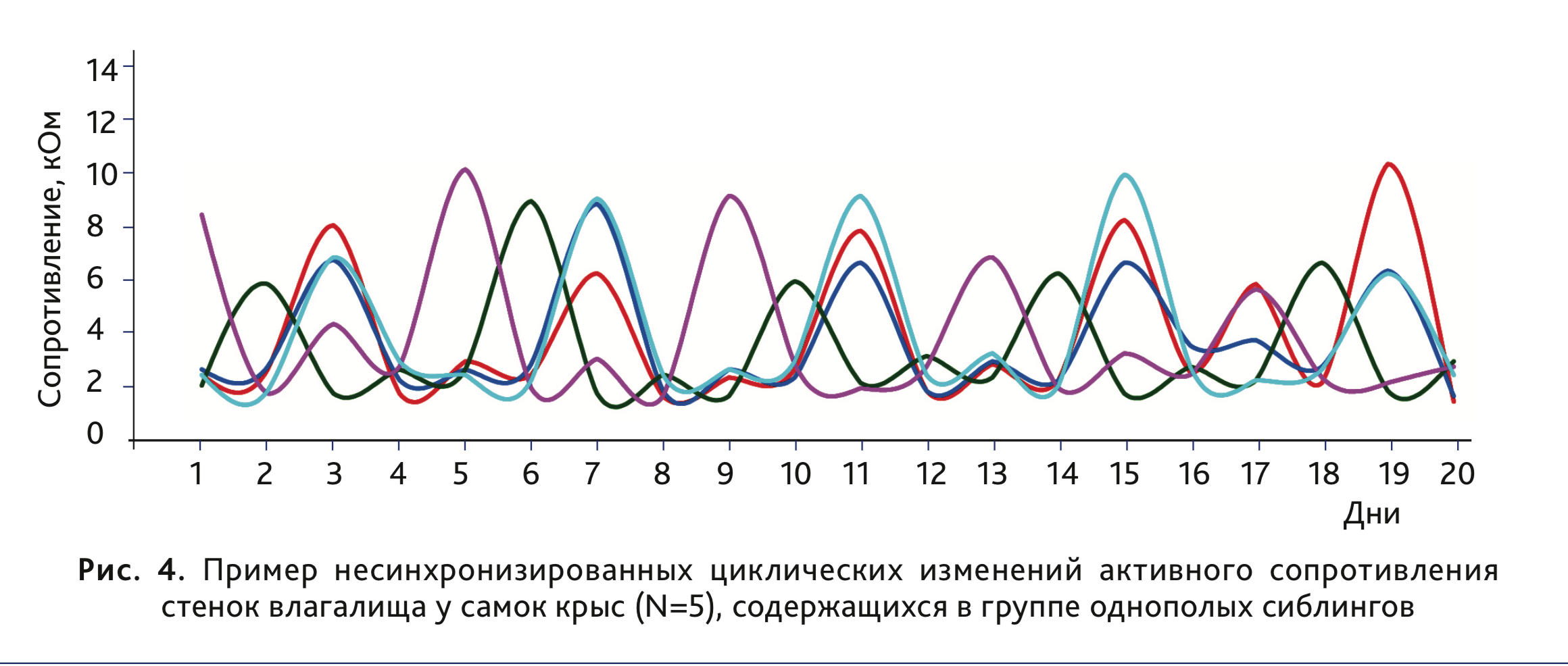
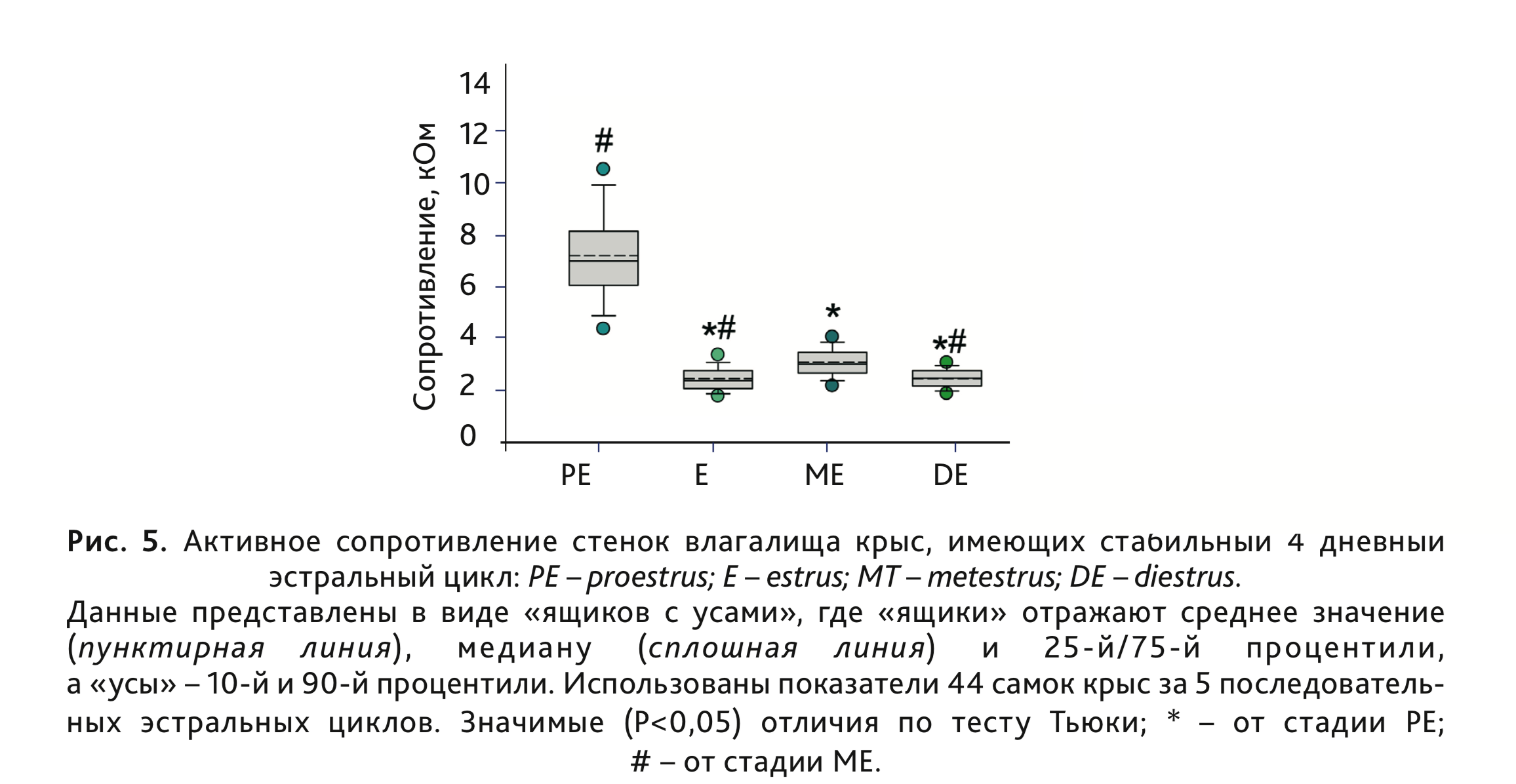
В целом из-за индивидуальной вариабельности показателей точное определение стадий эстрального цикла (кроме проэструса у крыс и эструса – у мышей) по данным измерения АС стенки влагалища возможно только при выполнении ежедневной оценки в течение нескольких половых циклов. Такая ситуация соотносится с результатами классического способа определения стадии эстрального цикла по цитологической картине влагалищного мазка, когда знание клеточного состава предшествующих мазков существенно увеличивает точность определения текущей стадии [3].
Заключение
На основании полученных результатов можно заключить, что детектор MED-PRO 100 является перспективным средством для
определения стадий эстрального цикла и у крыс, и у мышей и может быть использован не только для целей
воспроизводства лабораторных грызунов и/или получения их «датированной беременности», но и в длительных
поведенческих, фармакологических и токсикологических исследованиях. Для валидации данного устройства требуются
дальнейшие исследования на различных линиях/стоках лабораторных мышей и крыс, а также других видах мелких
лабораторных грызунов. При проведении исследований, однако, следует определять наличие влагалищных инфекций и
воспаления, поскольку детектор может давать ложнонегативные результаты, не выявляя пики активного сопротивления у
циклирующих са-
мок [24].
Благодарности
Авторы выражают признательность М.Г. Семиной за оказанную техническую помощь при проведении данного исследования.
Список источников
- Bradshaw H.B., Temple J.L., Wood E., & Berkley K.J. Estrous variations in behavioral responses to vaginal and uterine distention in the rat. Pain. 1999; 82(2): 187–97. https://doi.org/10.1016/S0304-3959(99)00049-4
- Shekunova E.V. Bespalov A.Y. Estrous cycle stage-dependent expression of acute tolerance to morphine analgesia in rats. Eur. J. Pharmacol. 2004; 486(3): 259-64.
- Goldman J.M., Murr A.S. and Cooper R.L. The Rodent Estrous Cycle: Characterization of Vaginal Cytology and Its Utility in Toxicological Studies. Birth. Defects Res. (Part B). 2007; 80:84–97.
- Byers S.L., Wiles M.V., Dunn S.L., Taft R.A. Mouse estrous cycle identification tool and images. PLoS One. 2012:e35538. doi: 10.1371/journal.pone.0035538.
- Nagy A., Gertsenstein M., Vintersten K, Behringer R. Manipulating the Mouse Embryo: A Laboratory Manual. 3rd Ed. (2003) Cold Spring Harbor Press. New York.
- Tarin J.J., Perez-Albala S., Gomez-Piquer V., Hermenegildo C., Cano A. Stage of the estrous cycle at the time of pregnant mare’s serum gonadotropin injection affects pre-implantation embryo development in vitro in the mouse. Mol. Reprod. Dev. 2002; 62(3): 312-9.
- Кораблев А.Н., Серова И.А., Скрябин Б.В. Манипуляции с ранними эмбрионами мыши для создания генетически модифицированных животных. Вавиловский журнал генетики и селекции. 2017; 21(7):758-63. DOI 10.18699/VJ17.291
- Jaramillo L.M., Balcazar I.B., Duran C. Using vaginal wall impedance to determine estrous cycle phase in Lewis rats. Lab. Anim. (NY). 2012; 41(5):122-8. doi: 10.1038/laban0512-122.
- Stockard C.R., Papanicolau G. N. The existence of a typical oestrous cycle in the guinea pig-with a study of its histological and physiological changes. Am. J. Anat. 1917; 22: 225.
- Long J.A., Evans H.M. The oestrous cycle in the rat and it associated phenomena. Mem. Univ. Calif. 1922; 6:1–143.
- Emery F.E., Bchwabe E.L. The vaginal smears of rats as influenced by frequent examinations. The Anatomical Record. 1936; 64 (2): 147-54.
- Wade N.J., Doisy E.A. Cornifination of vaginal epithelium of ovariectomized rat produced by smearing. Proc. Soc. Exp. Biol. and Med. 1935. 32: 707.
- Айзинбудас Л.Б. и Довильтис П.П. Способ определения оптимального времени осеменения коров. Авторское свидетельство СССР №145708 (заявлено 30 июня 1961 г. за №736350/30-15 в Комитет по делам изобретений и открытий при Совете Министров СССР). Бюллетень изобретений. 1962; 6.
- Лашас А.В., Бакшис Л.С., Кукис И.И., Бакшис, Айзинбудас Л.Б. и Довильтис П.П. Прибор для определения оптимального времени осеменения животных, например коров. МПК: A 01k. Номер патента: 178603 (опубликовано: 22.01.1966). Бюллетень №3.
- Bartos L. Vaginal impedance measurement used for mating in the rat. Lab. Anim. 1977; 11: 53–5.
- Taradach C. Monitoring of the Oestrus Cycle in the Rat by Measurement of Vaginal Impedance. In: Chambers C.M., Chambers P.L. (eds) New Toxicology for Old. Archives of Toxicology (Supplement). 1982; 5: 184-6.
- Ramos S.D., Lee J.M., Peuler J.D. An inexpensive meter to measure differences in electrical resistance in the rat vagina during the ovarian cycle. J. Appl. Physiol. 2001; 91: 667–70.
- Bartos L. and Sedlacek J. Vaginal impedance measurement used for mating in the guinea pig. Lab. Animals.1977; 11:57–8.
- Vilitis O., Merkulovs D., Mironovs I., Mironovs A., Merkulova V. Estrous Cycle Detector, Patent LV15278, International Publication Date 20.05.2018.
- Nakamura H., Hosono Т., Kumasawa K., Jones C.J.P., Aplin J.D., Kimura T. Vaginal bioelectrical impedance determines uterine receptivity in mice. Human Reproduction. 2018; p. 1 – 8. doi:10.1093/humrep/dey313
- Weixelbaumer K.M., Drechsler S., Wehrenpfennig P., Khadem A., Bahrami S., Tichy A., Palme R., Osuchowski M.F. Estrus Cycle Status Defined by Vaginal Cytology Does Not Correspond to Fluctuations of Circulating Estrogens in Female Mice. SHOCK, Vol. 41, No. 2, pp. 145-153, 2014. doi: 10.1097/SHK.0000000000000070
- Вайдо А.И., Ширяева Н.В., Павлова М.Б., Левина А.С., Хлебаева Д.А.-А., Любашина О.А., Дюжикова Н.А. Селектированные линии крыс с высоким и низким порогом возбудимости: модель для изучения дезадаптивных состояний, зависимых от уровня возбудимости нервной системы. Лабораторные животные для научных исследований. 2018; 3. https://doi.org/10/29926/2618723X-2018-03-02
- Koto M., Miwa M., Tsuji K., Okamoto M, and Adachi J. Change in the electrical impedance caused by cornification of the epithelial cell layer of the vaginal mucosa in the rat. Exp. Anim. 1987; 36: 151–6.
- Agrawal V., Jaiswal M.K., Chaturvedi M.M., Tiwari D.C., Jaiswal Y.K. Lipopolysaccharide alters the vaginal electrical resistance in cycling and pregnant mice. Am. J. Reprod. Immunol. 2009. 61: 158–66. doi:10.1111/j.1600-0897.2008.00677.x



