Диет-индуцированные модели метаболических нарушений. Сообщение 3: экспериментальный сахарный диабет
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 3: экспериментальный сахарный диабет. Лабораторные животные для научных исследований. 2018; 3. https://doi.org/10.29296/2618723X-2018-03-08
Резюме
Рост заболеваемости сахарным диабетом (СД), преимущественно 2-го типа (СД2), опасного хроническими осложнениями, обусловленными гипергликемией (диабетическая нефропатия, диабетическая ретинопатия, диабетическая стопа, диабетическая нейропатия, атеросклероз и др.), диктует необходимость проведения широких доклинических исследований для поиска эффективных мер профилактики и лечения. Для этого требуются экспериментальные модели на животных, наиболее чувствительных к развитию СД, адекватные методы индуцирования СД и выбор критериев оценки. Как показал анализ современной литературы, для моделирования СД2 лучше всего подходят грызуны (преимущественно мыши, в том числе диких пород), а также мини-свиньи. Наиболее близкими по этиологии и механизмам развития к СД2 у человека являются диет-индуцированные модели, среди которых наиболее эффективны высокоуглеводные рационы, дополнительно обогащенные сахарозой или фруктозой. Для ускорения развития диет-индуцированного СД2 рекомендуется использовать небольшие, индивидуально подобранные дозы стрептозотоцина, позволяющие не разрушать полностью β-клетки поджелудочной железы, как это имеет место при СД типа 1. Основными критериями развития СД и эффективности исследуемых лечебно-профилактических мероприятий являются содержание глюкозы, инсулина и гликозилированного гемоглобина плазмы крови, количество β-клеток в островках поджелудочной железы, площадь распределения сахарной кривой, индекс инсулинорезистентности, а также результаты гистологии и гистохимии поджелудочной железы и других органов.
Введение
Несмотря на значительный прогресс в лечении сахарного диабета (СД), в последние 2 десятилетия отмечается непрекращающийся рост заболеваемости СД как во всем мире, так и в Российской Федерации, причем рост происходит в основном за счет больных, страдающих СД типа 2 (СД2). Так, например, если общее число больных СД в РФ на конец 2016 г. составляло 4,348 млн человек (2,97% населения РФ), то больных СД2 среди них было чуть больше 4 млн (92%), СД типа 1 (СД1) – 255 тыс. (6%), и на другие типы СД приходилось всего 75 тыс. (около 2%) [1]. Основные причины ухудшения качества жизни, инвалидизации и смертности больных СД: хронические осложнения, обусловленные гипергликемией (диабетическая нефропатия, диабетическая ретинопатия, диабетическая стопа, диабетическая нейропатия, атеросклероз и др.) [2].
В целях совершенствования профилактики и лечения осложнений СД постоянно изучаются различные аспекты патофизиологии СД, механизмы антидиабетического действия новых лекарственных средств. Для этого необходимы широкие доклинические исследования с использованием экспериментальных моделей на животных: подбор наиболее чувствительных к развитию СД видов животных, эффективных методов индуцирования СД, адекватных показателей характеристики СД. В настоящее время создано много моделей экспериментального СД, однако для моделирования СД2 подходят далеко не все из них.
Характеристика сахарного диабета
СД – хроническое неинфекционное заболевание, темпы распространения которого за последние 2 десятилетия приобрели масштаб эпидемии [1]. СД характеризуется абсолютным или относительным дефицитом гормона инсулина и последующим нарушением обмена веществ, прежде всего – углеводного. Под абсолютным дефицитом инсулина понимают недостаточное образование этого гормона в поджелудочной железе (преимущественно СД1), под относительным дефицитом – нарушение действия инсулина на клетки организма при количественно достаточном его образовании в поджелудочной железе (инсулинорезистентность, характерная для СД2) [2]. В патогенезе инсулинорезистентности важное значение придается ожирению, которым страдают большинство больных СД2.
Для СД характерны острые и хронические осложнения. Острые осложнения – гипогликемические и гипергликемические состояния (кетоацидоз) – хорошо поддаются коррекции современными противодиабетическими средствами, хотя при этом необходим постоянный контроль за содержанием глюкозы крови. В настоящее время наиболее серьезной проблемой являются хронические (поздние) осложнения СД, которые служат основными причинами ухудшения качества жизни, инвалидизации и смертности больных. В основе поздних осложнений лежит хроническая гипергликемия, сопровождающаяся поражением мелких кровеносных сосудов – микроангиопатии (нефропатия, ретинопатия, диабетическая стопа и др.) и крупных кровеносных сосудов – макроангиопатии, а также поражением периферической нервной системы – нейропатии.
В основе диабетических поражений крупных сосудов (макроангиопатий) лежит атеросклероз, риск развития которого при СД2 возрастает в несколько раз. В свою очередь, диабетические поражения мелких сосудов, а также характерные для СД2нарушения липидного обмена, тоже играют важную роль в механизмах развития макроангиопатий. У больных СД значительно чаще и тяжелее протекает артериальная гипертензия, в том числе вторичная артериальная гипертензия, обусловленная поражением почек (диабетической нефропатией).
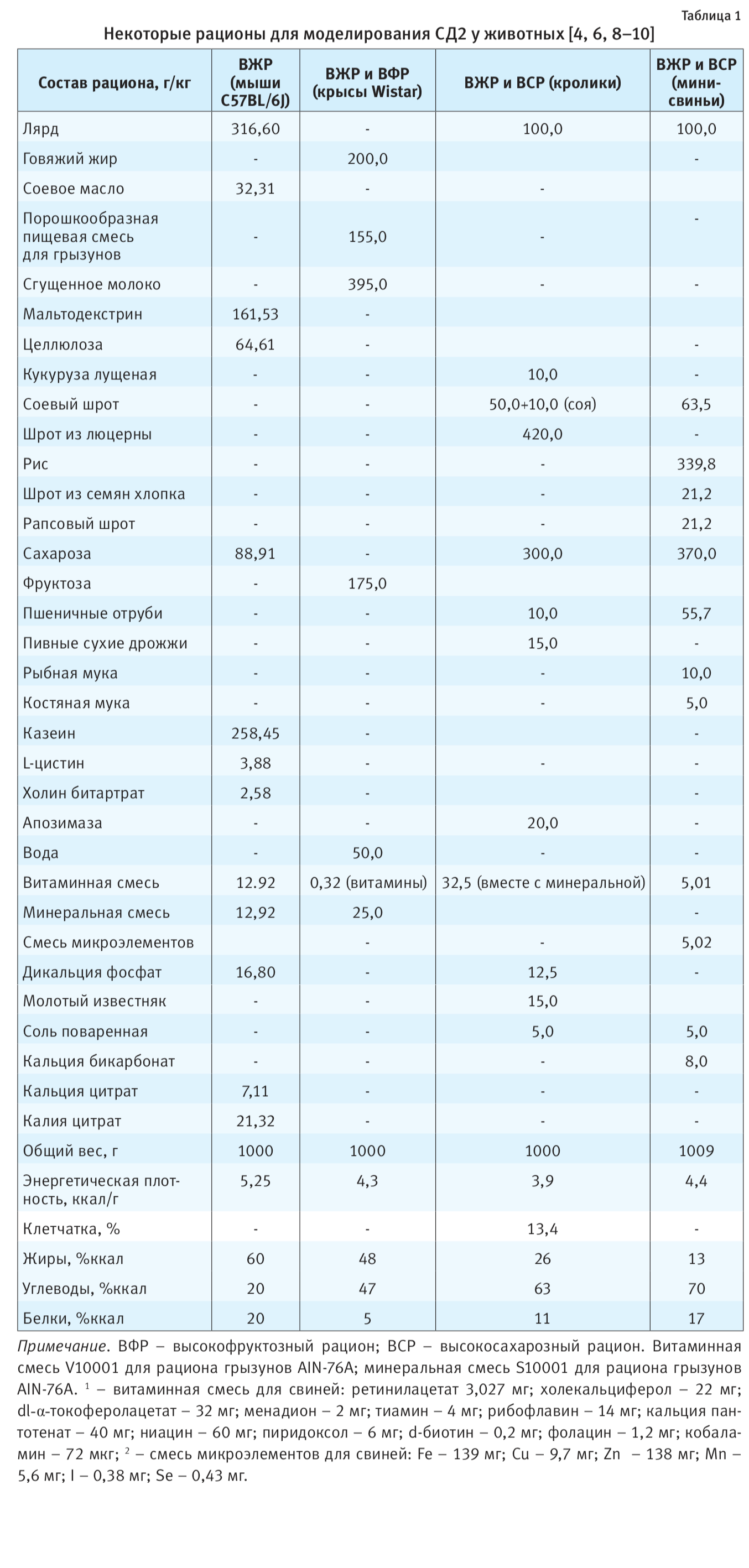
Рационы питания, используемые для индукции СД
Большинство существующих в настоящее время экспериментальных моделей СД (хирургическая, химическая, эндокринная,
иммунная, генетическая) не подходят для изучения СД2. Так как в этиологии СД2 (так же, как и ожирения)
у человека основное значение имеет избыточное по калорийности питание, наиболее адекватными представляются
диет-индуцированные модели на различных видах животных. Рацион питания оказывает существенное влияние на развитие
СД2. Так, например, у мышей C57BL/6 для развития ожирения и СД2 требуется высокожировой рацион (ВЖР) (60%
жира) питания
(табл. 1), причем более быстрый и выраженный эффект достигается при добавлении в него
большого количества сахарозы или фруктозы [3]. У крыс линии Wistar для индукции инсулинорезистентности
использовали высокофруктозный рацион (35–60% ккал за счет фруктозы) [4, 5]. Для индукции СД2
у мини-свиней также рекомендуется ВЖР с добавлением большего количества сахарозы (см. табл. 1) [6].
В свою очередь, у предрасположенных к ожирению мышей ли-
нии NZO ожирение и СД развиваются
как при 40%, так и при 15% жира в рационе питания, в то время как рацион с высоким содержанием
клетчатки значительно тормозит у них развитие ожирения и СД [7]. Однако у таких генетически
модифицированных линий мышей, как ApoE-/-, LDLr-/-, LDLr-/-ApoB100/100, СД вообще не развивается даже на
высококалорийных рационах [3].
Виды животных, используемые для индукции сахарного диабета
Для моделирования СД2 в основном применяются грызуны (мыши и крысы, реже – морские свинки, песчанки и дегу) и нечеловекообразные обезьяны [11, 12]. В настоящее время все шире начинают использоваться мини-свиньи [13].
Модели сахарного диабета на грызунах
В экспериментальных моделях СД2 используются как генетически модифицированные (инбредные) животные [(мыши db/db, мыши NZO (New Zealand Obese), мыши TH (TALLYHO/Jng), крысы Zucker Diabetic Fatty (ZDF) и др.)], так и аутбредные (мыши линий C57BL/6 и BALB/c, крысы линии Wistar и др.) [4, 11, 14–16].
По мнению R. Kluge et al. [7], инбредные мыши имеют сходный с человеком патогенез развития, связанный с ожирением. Поэтому они идеально подходят для исследования проявлений СД2 у человека. Однако генетическая однородность инбредных линий является не только преимуществом, но и ограничивает потенциал их применения. Так как особи конкретной инбредной линии мышей генетически идентичны, то маловероятно, что у одной линии представлены все патогенетические механизмы такого комплексного заболевания, как СД2. Поэтому для всесторонней оценки механизмов как самого СД2, так и изучаемых препаратов, требуются исследования на нескольких линиях инбредных мышей для получения полной картины [7].
Разные линии инбредных мышей, используемых для моделирования СД2, существенно различаются между собой. Так, если самой яркой характеристикой мышей NZO является выраженное ожирение (масса тела у них к 3 мес достигает 45 г, а в дальнейшем может достигать 100 г и более), то мыши линии TH к 3 мес весят 35 г, в то время как контрольные линии диких мышей C57BL/6 – 27 г [7, 16]. Практически все исследователи отмечают, что молодые мыши возрастом до 4 нед, независимо от пола, толерантны к введению глюкозы, однако после полового созревания (раньше – у самцов и чуть позже – у самок) у них развивается нарушение толерантности к нагрузке глюкозой [16]. Нарушение толерантности к глюкозе у животных сопровождается гиперсекрецией инсулина (гиперинсулинемией) с последующим развитием инсулинорезистентности: средний уровень инсулина в плазме крови (не натощак) достигает 6±1 нг/мл – у самок и 8±1 нг/мл – у самцов мышей линии TH, в то время как у мышей линии C57BL/6 он составляет всего 0,4±0,1 нг/мл – у самок и 0,6±0,2 нг/мл – у 6-недельных самцов [16].
Модели сахарного диабета на кроликах
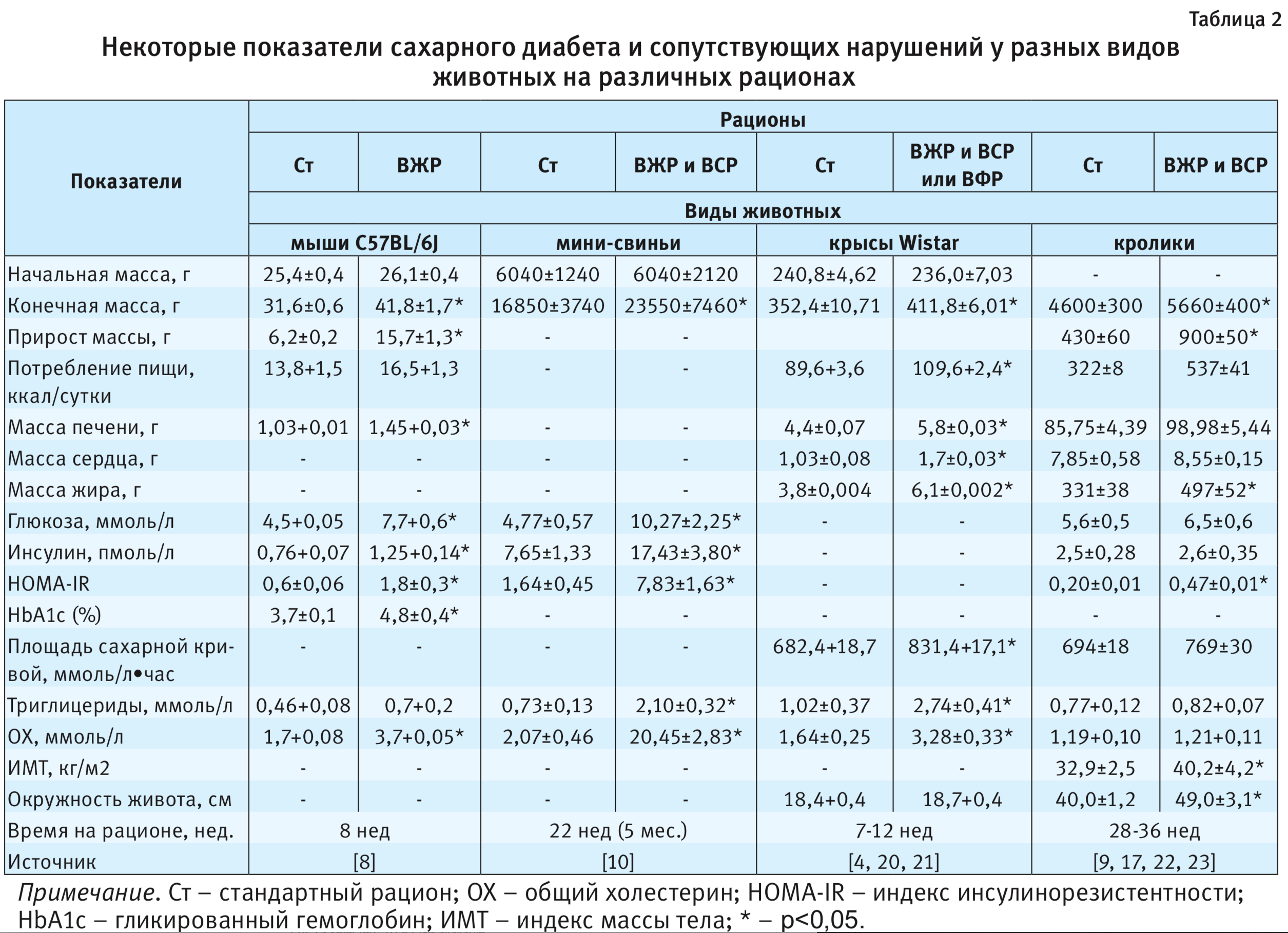
У кроликов сложно вызвать СД, так как в их рацион питания, наряду с высоким содержанием жира и сахарозы, должно входить довольно много клетчатки (см. табл. 1), которая предупреждает развитие инсулинорезистентности и гипергликемии. Это подтверждается многими исследователями, показавшими незначительные изменения содержания глюкозы и инсулина в сыворотке крови, даже при длительном применении (28 нед) рационов с высоким содержанием жира и углеводов (табл. 2) [9, 17]. Однако через 36 нед индекс инсулинорезистентности начинает существенно превышать таковой у контрольных животных (см. табл. 2) [9].
Модели сахарного диабета на крупных животных
В настоящее время, по мнению большинства ученых, наиболее подходящие модели для изучения СД2 – мини-свиньи, которые гораздо ближе к человеку, чем грызуны [13]. У мини-свиней с диет-индуцированным ожирением большинство симптомов, ассоциированных с метаболическим синдромом, в том числе и инсулинорезистентность и нарушение толерантности к глюкозе, развиваются в течение 5–6 мес после начала кормления рационом с высоким содержанием сахара и жира. Однако для развития явной гипергликемии, характерной для СД2, требуется несколько лет. Поэтому для ускорения индукции СД2, мини-свиньям с уже развившимся ожирением подбирают небольшие индивидуальные дозы стрептозотоцина, который выборочно повреждает часть инсулинсинтезирующих β-клеток поджелудочной железы, способствуя более раннему развитию гипергликемии. При этом доза стрептозотоцина должна быть такой, чтобы вырабатывалось достаточно инсулина для поддержания избыточной массы тела. При правильном подборе дозы стрептозотоцина секреция инсулина может быть ограничена на таком уровне, чтобы на фоне развития гипергликемии оставалось ингибирование липолиза без дополнительного введения инсулина [13].
Показатели для оценки развития сахарного диабета у разных видов животных
О развитии СД2 в условиях эксперимента судят в первую очередь по содержанию в плазме крови глюкозы натощак, инсулина и гликозилированного гемоглобина, по результатам теста на толерантность к глюкозе после ее введения через рот или внутриперитонеально, а также гистологии и гистохимии поджелудочной железы [6, 8, 10, 17, 18]. Кроме того, оценивают количество β-клеток в островках поджелудочной железы, определяют площадь распределения сахарной кривой и рассчитывают различные индексы (индекс инсулинорезистентности, индекс массы тела и др.). Косвенные показатели: масса тела и другие антропометрические данные, содержание триглицеридов, холестерина и его фракций, маркеры воспаления (интерлейкин-6, фактор некроза опухоли и т.п.) и др. [8, 10, 11, 17, 19]. Некоторые из указанных показателей, характерные для различных животных, используются в диет-индуцированных моделях СД2 (см. табл. 2).
Исходя из данных табл. 2, можно проследить быстрое развитие гипергликемии, инсулинорезистентности и рост гликозилированного гемоглобина у мышей на фоне только ВЖР. Однако у кроликов проявления СД2 выражены слабо и развиваются очень медленно (см. табл. 2). Вместе с тем у мини-свиней признаки возникновения СД2 развиваются гораздо лучше и быстрее, чем у кроликов: рост уровня глюкозы – до 10,27±2,25 ммоль/л в сравнении с 4,77±0,57 ммоль/л у контрольных животных, инсулина – 17,43±3,80 пмоль/л в сравнении с 7,65±1,33 пмоль/л, а инсулинорезистентность возрастает почти в 5 раз (см. табл. 2).
Заключение
Таким образом, для моделирования СД2 лучше всего подходят грызуны (преимущественно – мыши, в том числе и аутбредных линий), а также мини-свиньи, которых стали шире применять в последнее время. Как для моделей метаболического синдрома и ожирения, наиболее близкими по этиологии и механизмам развития к СД2 у человека также являются диет-индуцированные модели, среди которых наиболее эффективны высокожировые рационы, обогащенные сахарозой или фруктозой. Для моделирования СД следует использовать половозрелых животных, так как молодые животные, в частности мыши возрастом до 4 нед устойчивы к введению больших доз глюкозы и только после полового созревания у них развивается нарушение толерантности к нагрузке глюкозой. Для ускорения индукции СД2, в том числе у мини-свиней, рекомендуется использовать небольшие, подбираемые индивидуально, дозы стрептозотоцина, чтобы полностью не разрушать β-клетки поджелудочной железы аналогично ситуации при СД2.
Эффективность исследуемых лечебно-профилактических мероприятий у животных с СД2 оценивают на основании определения показателей глюкозы, инсулина и гликозилированного гемоглобина плазмы крови, гистологии и гистохимии поджелудочной железы и др. органов. Рассчитывают также количество β-клеток в островках поджелудочной железы, площадь распределения сахарной кривой, индекс инсулинорезистентности и др. Косвенно об эффективности исследуемых лечебно-профилактических мер судят на основании показателей липидного обмена (триглицеридов, холестерина и его фракций), маркеров воспаления (интерлейкин-6, фактор некроза опухоли и т.п.) и др.
Список источников
- Дедов И.И., Шестакова М.В., Викулова О.К. Эпидемиология сахарного диабета в Российской Федерации: клинико-статистический анализ, по данным Федерального регистра сахарного диабета. Сахарный диабет. 2017; 20 (1): 13–41. doi: 10.14341/DM8664.
- Смолянский Б.Л., Лифляндский В.Г. Сахарный диабет. М.: ОЛМА Медиа Групп, 2009. 640 с.
- Kohen Avramoglu R., Laplante M.A., Le Quang K., Deshaies Y., Després J.P., Larose E., Mathieu P., Poirier P., Perusse L., Vohl M.C., Sweeney G., Ylä-Herttuala S., Laakso M., Uusitupa M., Marette A. The Genetic and Metabolic Determinants of Cardiovascular Complications in Type 2 Diabetes: Recent Insights from Animal Models and Clinical Investigations. Can. J. Diabetes. 2013 Oct;37(5):351–8. doi: 10.1016/j.jcjd.2013.08.262.
- Poudyal H., Panchal S., Brown L. Comparison of purple carrot juice and β-carotene in a high-carbohydrate, high-fat diet-fed rat model of the metabolic syndrome. British Journal of Nutrition, 2010, Vol. 104, 9: 1322–32.
- Tominaga A., Ishizaki N., Naruse Y., Kitakoji H., Yamamura Y. Repeated application of low-frequency electroacupuncture improves high-fructose diet-induced insulin resistance in rats. Acupunct. Med. 2011 Dec; 29 (4): 276–83. doi: 10.1136/acupmed-2011-010006.
- Xi S., Yin W., Wang Z., Kusunoki M., Lian X., Koike T., Fan J., Zhang Q. A minipig model of high-fat/high-sucrose diet-induced diabetes and atherosclerosis Int. J. Exp. Path. (2004), 85, 223–31.
- Kluge R., Scherneck S., Schormann A., Joost H.-G. Pathophysiology and Genetics of Obesity and Diabetes in the New Zealand Obese Mouse: A Model of the Human Metabolic Syndrome. In: Animal Models in Diabetes Research. Edited by Hans-Georg Joost, Hadi Al-Hasani, Annette Schürmann. Springer Science+Business Media, LLC 2012: 59–73.
- Kim H.J., Kim S., Lee A.Y., Jang Y., Davaadamdin O., Hong S.-H., Kim J.S., Cho M.-H. The Effects of Gymnema sylvestre in High-Fat Diet-Induced Metabolic Disorders. Amer. J. Chin. Med., 2017. Vol. 45, 4: 1–20. doi: 10.1142/S0192415X17500434.
- Zhao S., Chu Y., Zhang C.,Lin Y., Xu K., Yang P., Fan J., Liu E. Diet-induced central obesity and insulin resistance in rabbits. J Anim Physiol Anim Nutr (Berl). 2008 Feb; 92 (1): 105–11. doi: 10.1111/j.1439-0396.2007.00723.x.
- Liu Y., Wang Z.B., Yin W.D., Li Q.K., Cai M.B., Yu J., Li H.G., Zhang C., Zu X.H. Preventive effect of Ibrolipim on suppressing lipid accumulation and increasing lipoprotein lipase in the kidneys of diet-induced diabetic minipigs. Lipids in Health and Disease 2011, 10:117.
- Joost H.-G. Al-Hasani H., Schurmann A. (eds.). Animal Models in Diabetes Research, Methods in Molecular Biology, vol. 933, DOI 10.1007/978-1-62703-068-7_6, © Springer Science+Business Media, LLC. 2012: 325.
- Suckow M.A., Stevens K.A., Wilson R.P. (eds.). The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Academic Press, Elsevier. 2012: 1268.
- Koopmans S.J., Schurmann T. Considerations on pig models for appetite, metabolic syndrome and obese type 2 diabetes: From food intake to metabolic disease. Eur J Pharmacol. 2015 Jul 15; 759: 231–9. doi: 10.1016/j.ejphar.2015.03.044.
- Wu K.K., Huan Y. Diabetic atherosclerosis mouse models. Atherosclerosis. 2007; 191: 241–9.
- Molnar J., Yu S., Mzhavia N., Pau C., Chereshnev I., Dansky H.M. Diabetes induces endothelial dysfunction but does not increase neointimal formation in high-fat diet fed C57BL/6J mice. Circ. Res., 2005;96 (11): 1178–84. doi: 10.1161/01.RES.0000168634.74330.ed.
- Konda V.R., Desai A., Darland G., Grayson N., Bland J.S. KDT501, a derivative from hops, normalizes glucose metabolism and body weight in rodent models of diabetes. PLoS One. 2014 Jan 30;9 (1): e87848. 11 р. doi: 10.1371/journal.pone.0087848.
- Kim J.H., Saxton A.M. The TALLYHO Mouse as a Model of Human Type 2 Diabetes In: H.-G. Joost et al. (eds.), Animal Models in Diabetes Research, Methods in Molecular Biology, vol. 933, DOI 10.1007/978-1-62703-068-7_6, © Springer Science+Business Media, LLC. 2012: 74–87.
- Arias-Mutis O.J., Marrachelli V.G., Ruiz-Saurí A., Alberola A., Morales J.M., Such-Miquel L., Monleon D., Chorro F.J., Such L., Zarzoso M. Development and characterization of an experimental model of diet-induced metabolic syndrome in rabbit. PLOS ONE, |May 23, 2017: 18. doi: 10.1371/journal.pone.0178315. eCollection 2017.
- Beguinot F., Nigro C. Measurement of Glucose Homeostasis In Vivo: Glucose and Insulin Tolerance Tests In: H.-G. Joost et al. (eds.), Animal Models in Diabetes Research, Methods in Molecular Biology, vol. 933, DOI 10.1007/978-1-62703-068-7_6, © Springer Science+Business Media, LLC. 2012: 219–26.
- Preedy V.R. (editor). Diabetes. Oxidative Stress and Dietary Antioxidants. Elsevier Inc., 2014: 269.
- Samout N., Ettaya A., Bouzenna H., Ncib S., Elfeki A., Hfaiedh N. Beneficial effects of Plantago albicans on high-fat diet-induced obesity in rats. Biomed. Pharmacother., 2016 Dec;84:1768–75. doi: 10.1016/j.biopha.2016.10.105.
- Amri Z., Ghorbel A., Turki M., Akrout F.M., Ayadi F., Elfeki A., Hammami M. Effect of pomegranate extracts on brain antioxidant markers and cholinesterase activity in high fat-high fructose diet induced obesity in rat model. BMC Complement. Altern. Med., 2017. Jun 27; 17 (1): 339. 9 p. doi: 10.1186/s12906-017-1842-9.
- Eppel G.A., Armitage J.A., Eikelis N., Head G.A., Evans R.G. Progression of cardiovascular and endocrine dysfunction in a rabbit model of obesity. Hypertens. Res., 2013 Jul; 36 (7): 588–95. doi: 10.1038/hr.2013.2.
- Zheng H., Zhang C., Yang W., Wang Y., Lin Y., Yang P., Yu Q., Fan J., Liu E. Fat and Cholesterol Diet Induced Lipid Metabolic Disorders and Insulin Resistance in Rabbit. Exp Clin Endocrinol Diabetes, 2009; 117: 400–05. DOI: 10.1055/s-0028-1102918.



