Активация эндокринной системы семенников мышей линии C57BL/6J в ответ на сексуальный стимул
Амстиславская Т.Г., Новиков С.Н. Активация эндокринной системы семенников мышей линии C57BL/6J в ответ на сексуальный стимул. Лабораторные животные для научных исследований. 2018; 3. https://doi.org/10.29296/2618723X-2018-03-01
Резюме
Мыши линии C57BL/6J широко используются в различных медицинских и биологических исследованиях. Однако в фундаментальных исследованиях, касающихся репродуктивных особенностей этих мышей, характерного повышения половых гормонов в крови самцов в ответ на сексуальный стимул не было обнаружено. В настоящей работе изучали 60-минутную динамику поведения самцов C57BL/6J и уровня тестостерона в крови на предъявление им рецептивной самки в условиях, позволяющих видеть ее и обонять, но не допускающих непосредственного контакта. Исследование выявило значимое повышение уровня тестостерона в крови самца C57BL/6J к 30-й минуте в сравнении с его исходными значениями с последующим его снижением. В течение первых 30 мин с момента предъявления рецептивной самки зафиксировано наличие выраженного полового мотивационного поведения самцов, которое предшествовало повышению уровня тестостерона в крови, а после 30-й минуты отмечено его быстрое снижение. Половое мотивационное поведение самцов оценивали по времени пребывания самца у отделяющей самку перегородки. Таким образом, в работе впервые зафиксирован активирующий эффект самки на уровень тестостерона в периферической крови самцов мышей линии C57BL/6J, сопровождающийся выраженной половой мотивацией. Работа четко продемонстрировала, что при половом возбуждении у самцов C57BL/6J происходит активация гипоталамо-гипофизарно-семенникового комплекса, а сам подъем уровня тестостерона, обусловленный присутствием рецептивной самки, можно считать надежным параметром, характеризующим половое возбуждение самца.
Введение
Успех проведения экспериментальной работы на млекопитающих во многом зависит от выбора экспериментальной модели и ее адекватности поставленным в исследовании задачам. Лабораторная мышь представляет собой признанную модель для проведения широкого круга экспериментальных исследований различной направленности, а работа на линейном материале является необходимым условием для получения достоверных и воспроизводимых результатов. Между тем большое количество линий мышей, прошедших к настоящему времени сотни поколений близкородственных скрещиваний в ходе отбора по тому или иному признаку, существенно затрудняют задачу исследователя по выбору адекватной для решения модели.
В настоящее время выделены 3 группы линий лабораторных мышей, существенно различающихся по происхождению и селекционным программам получения животных [10]. Первую обширную группу составляют высоко инбредные линии CBA, C3H, BALB/c, AKR, SWR, DBA/1 и DBA/2, вторую – линии семейства С57. Показано, что геном лабораторных мышей линий С57BL/6 и C57BL/10 соответствует геному домовой мыши Mus musculus domesticus [18]. На этом основании можно полагать, что предки лабораторных мышей первой группы представляют собой другой подвид рода Mus – Mus musculus musculus. Два этих подвида домовой мыши Mus musculus L. значительно различаются по популяционной биологии, структуре иерархических отношений и территориальному поведению самцов.
Ранее при изучении особенностей половой активации и механизмов нейроэндокринных сдвигов у самцов лабораторных мышей и крыс показано резкое повышение уровня тестостерона в плазме крови как при прямом сексуальном контакте, так и в условиях, исключающих непосредственное взаимодействие между партнерами [1, 5]. Основным индуктором такого повышения являются хемосигналы (смесь летучих и нелетучих соединений), выделяемые самкой [2, 12]. Данная активация гипоталамо-гипофизарно-семенникового комплекса (ГГСК) имеет важное физиологическое значение при копуляции [6, 8, 20]. Отмечается и способность тестостерона снижать болевую чувствительность и тревожность организма, что, в конечном итоге, оптимизирует половой процесс [17]. Данные эффекты тестостерона у самцов мышей могут быть связаны с его быстрой ароматизацией в эстрадиол, поскольку ароматазная активность в мозге меняется в течение нескольких минут, изменяя при этом уровень эстрадиола [12].
Между тем в ряде исследований при сексуальном предъявлении самцам самки активацию ГГСК комплекса обнаружить не
удалось [1, 5, 17]. Показано, что даже у животных одного вида можно выделить генотипы с четким повышением
тестостерона в крови после 30–40-минутного предъявления рецептивной самки и генотипы, у которых
в тех же экспериментальных условиях не было изменений эндокринной функции семенников [1, 5]. В связи
с этим возникает закономерный вопрос: является ли повышение тестостерона в крови самца при половом
возбуждении универсальным или это особенность мышей определенного генотипа. Особое внимание привлекают самцы линии
C57BL/6J,
для которых, с одной стороны, не было показано активации эндокринной функции семенников
в условиях сексуального взаимодействия [1, 5, 17], с другой – экспериментально
продемонстрирована специфическая аносмия к изовалериановой кислоте – важнейшего компонента
вагинальных выделений [4, 13, 22].
Цель настоящего исследования – детальное изучение динамики уровня тестостерона в крови самцов линии C57BL/6J при предъявлении сексуального стимула и его сопоставление с изменяющимся при этом половым мотивационным поведением.
Материал и методы
Опыты проведены на половозрелых, сексуально неопытных самцах лабораторных мышей линии C57BL/6J, полученных в центре коллективного пользования «Генофонды лабораторных животных» Института цитологии и генетики СО РАН. Тестирование мышей проводили в зимний период в клетках (28×14×10 см), разделенных на 2 половины пластиковой перегородкой с небольшими отверстиями диаметром 7 мм. За 3 сут до опыта в 1 из отсеков помещали испытуемого самца для адаптации к новым условиям содержания и снятия социального эффекта группового содержания. В день эксперимента в пустой отсек клетки с самцом на 10-й, 20-й, 30-й, 40-й, 50-й или 60-й минутах помещали рецептивную самку линии BALB/c [6, 7]. Концентрацию тестостерона в плазме крови определяли иммуноферментным методом с использованием наборов «Стероид ИФА-тестостерон-01» отечественного производства фирмы «Алкор-Био» (Санкт-Петербург). Самки мышей линии BALB/c были использованы как универсальный стандартный индуктор половой мотивации, ранее использованный в наших экспериментах при тестировании мышей разных генотипов. Эструс вызывали введением за 24 ч до опыта 10 ЕД хорионического гонадотропина (профази, «Сероно», Италия). Наличие эструса у самок контролировали по вагинальному мазку. Мотивационное поведение изучали только у самцов группы, самка которым предъявлялась на 60 мин, регистрируя каждые 10 мин число подходов к разделяющей животных перегородке и время пребывания самца у перегородки [7]. В данном случае в день эксперимента клетку с животными переносили в соседнюю экспериментальную комнату, где после 5-минутной адаптации к условиям теста в течение 1 ч каждые 10 мин регистрировали время активного исследования самцом перегородки и количество подходов к ней. Тестирование поведения проводили с 16 до 18 ч. Число животных в группах составляло 9–10 особей.
Соблюдались все условия работы с животными в соответствии с международными нормами (Council of the European Communities Directive 86/609/EES).
Статистический анализ результатов проводили с помощью дисперсионного анализа с использованием пакета компьютерных программ Statistica (версия 6.0) с post-hoc сравнением групповых средних (Newman–Keul test). Различия считали достоверными при р<0,05. Значения поведенческих и гормональных параметров представлены как средняя арифметическая и ее ошибка (M±SEM).
Результаты и обсуждение
В настоящей работе установлено, что появление самки мыши в условиях, не допускающих непосредственного тактильного контакта, вызывает характерное поведение самца линии C57BL/6J, проявляющееся в желании находиться у разделяющей перегородки в попытках проникнуть через нее. Это согласуется с ранее полученными на других линиях лабораторных мышей данными [1, 7]. В результате 60-минутного теста выявлен эффект длительности пребывания рецептивной самки за перегородкой на время, проводимое самцом C57BL/6J у разделяющей животных перегородки (F5,54=3,79; p<0,01), а также на количество подходов к ней (F5,54=2,79; p<0,05; рис. 1). Проведенное post-hoc сравнение групповых средних значений показало достоверное снижение времени пребывания у перегородки у самцов к концу исследования (p<0,05 – после 50-й минуты; p<0,01 – после 60-й минуты экспозиции самки; табл. 1, 2; см. рис. 1). Эти результаты отличаются от подобного ранее проведенного исследования поведения самцов других линий – СВА/Lac и A/He, где показано наличие характерного поведения самца на протяжении всего периода тестирования, когда даже на 60-й минуте, несколько снижаясь, достоверно не отличалось от любой другой временнóй точки [6, 7].
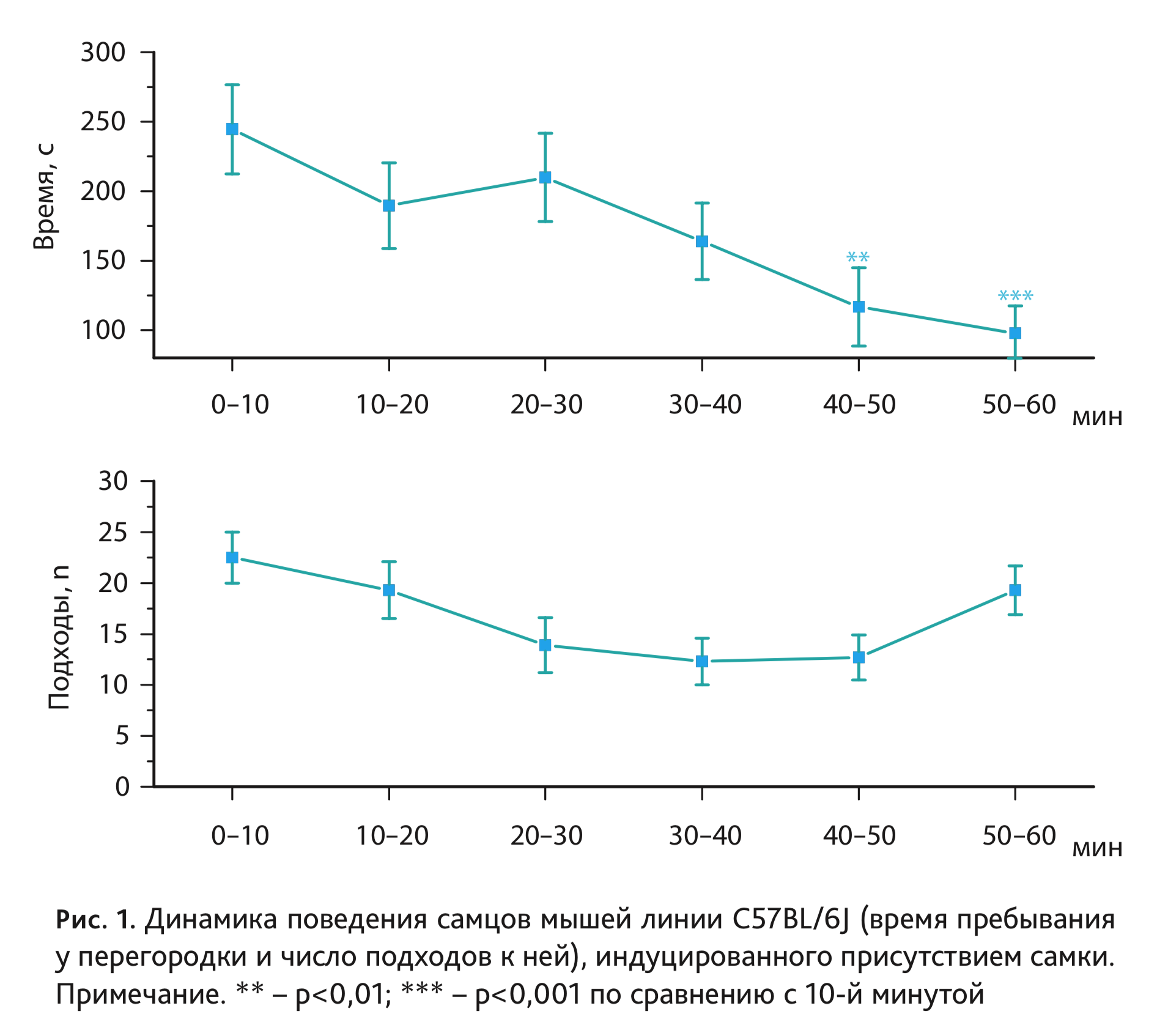
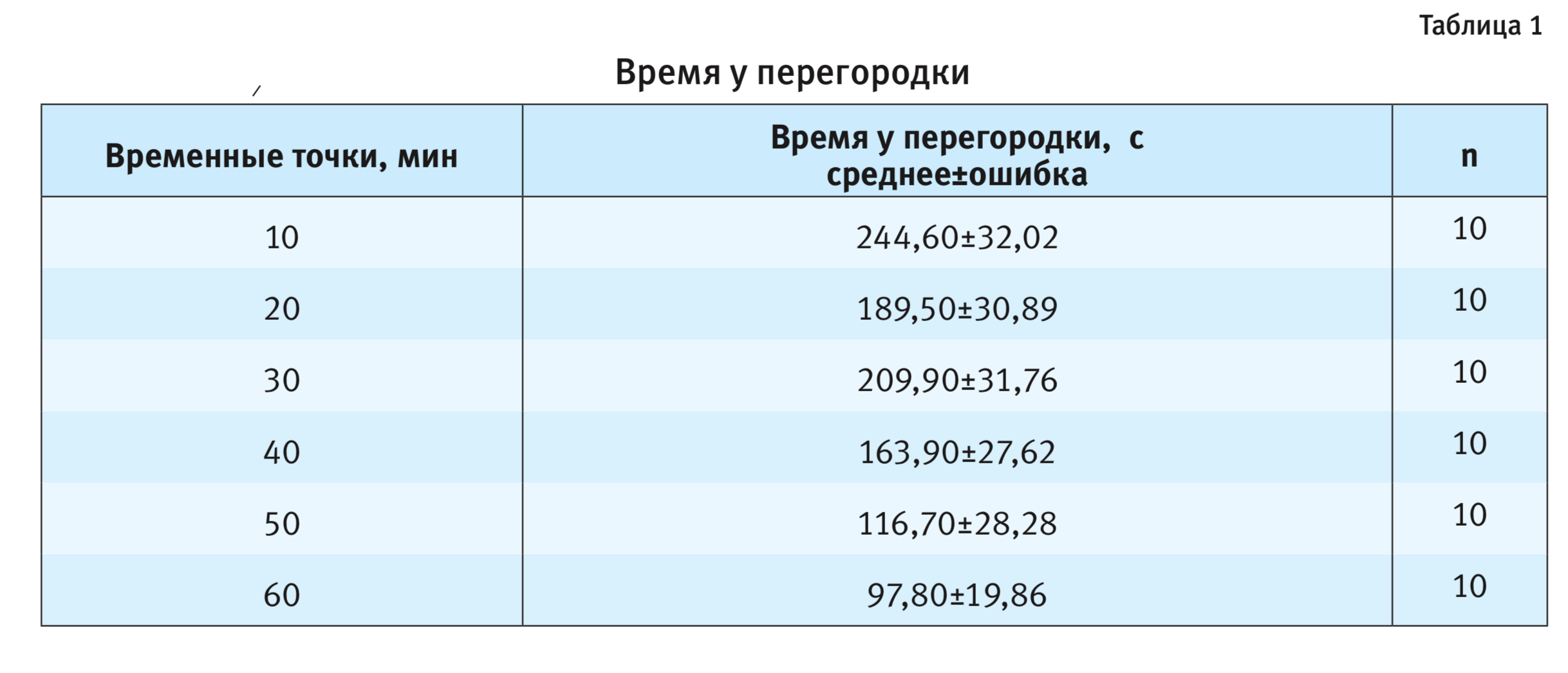
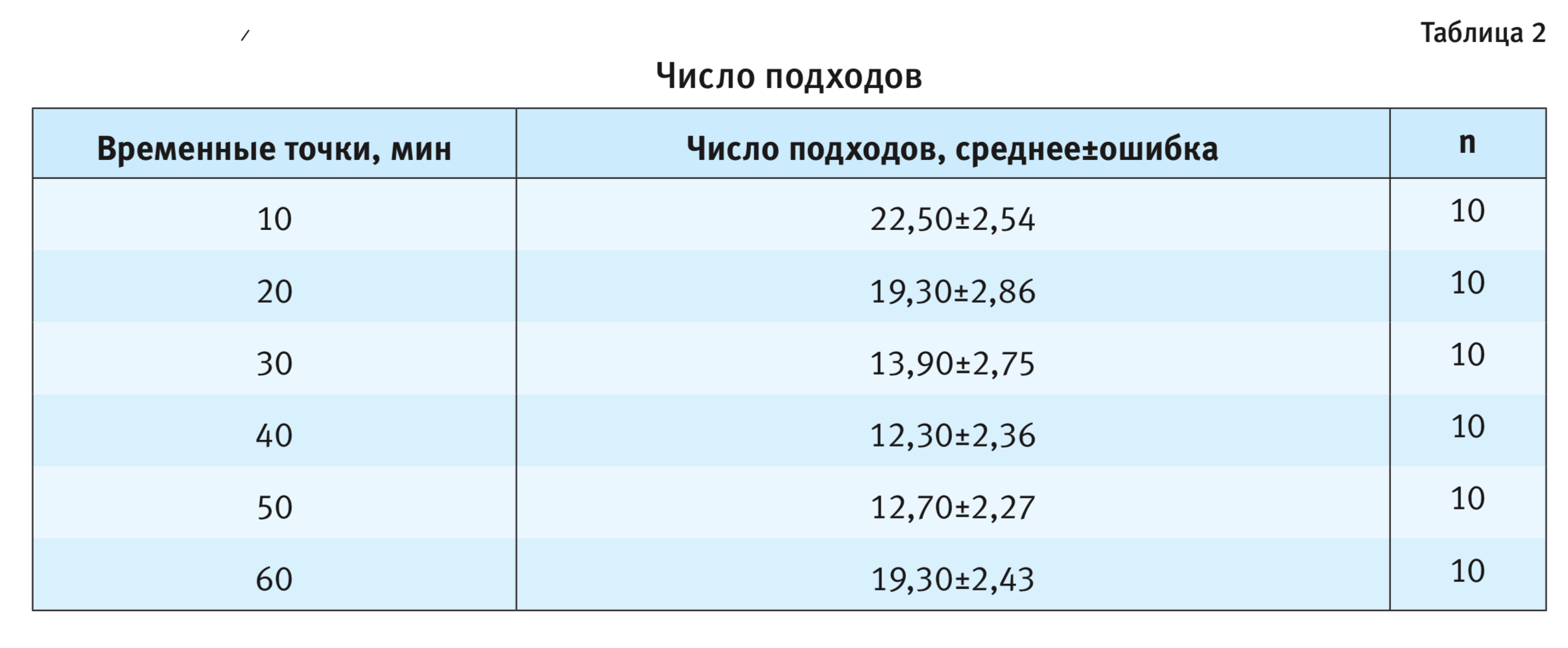
Таким образом, настоящее исследование продемонстрировало отличающийся паттерн поведения самцов мышей линии C57BL/6J у перегородки по сравнению с самцами мышей линий СВА/Lac и А/Не. Что касается другого, в большей степени связанного с двигательной активностью показателя поведения самца у перегородки – числа подходов к ней, то у мышей C57BL/6J он зависел от времени пребывания самки за перегородкой (F5,54=2,79; p<0,05). На 30-й, 40-й и 50-й минутах тестирования значения этого параметра были ниже, чем в начальных и конечной точках, однако достоверных различий по выраженности данного показателя в отдельные временные точки post-hoc-анализ не показал (см. рис. 1).
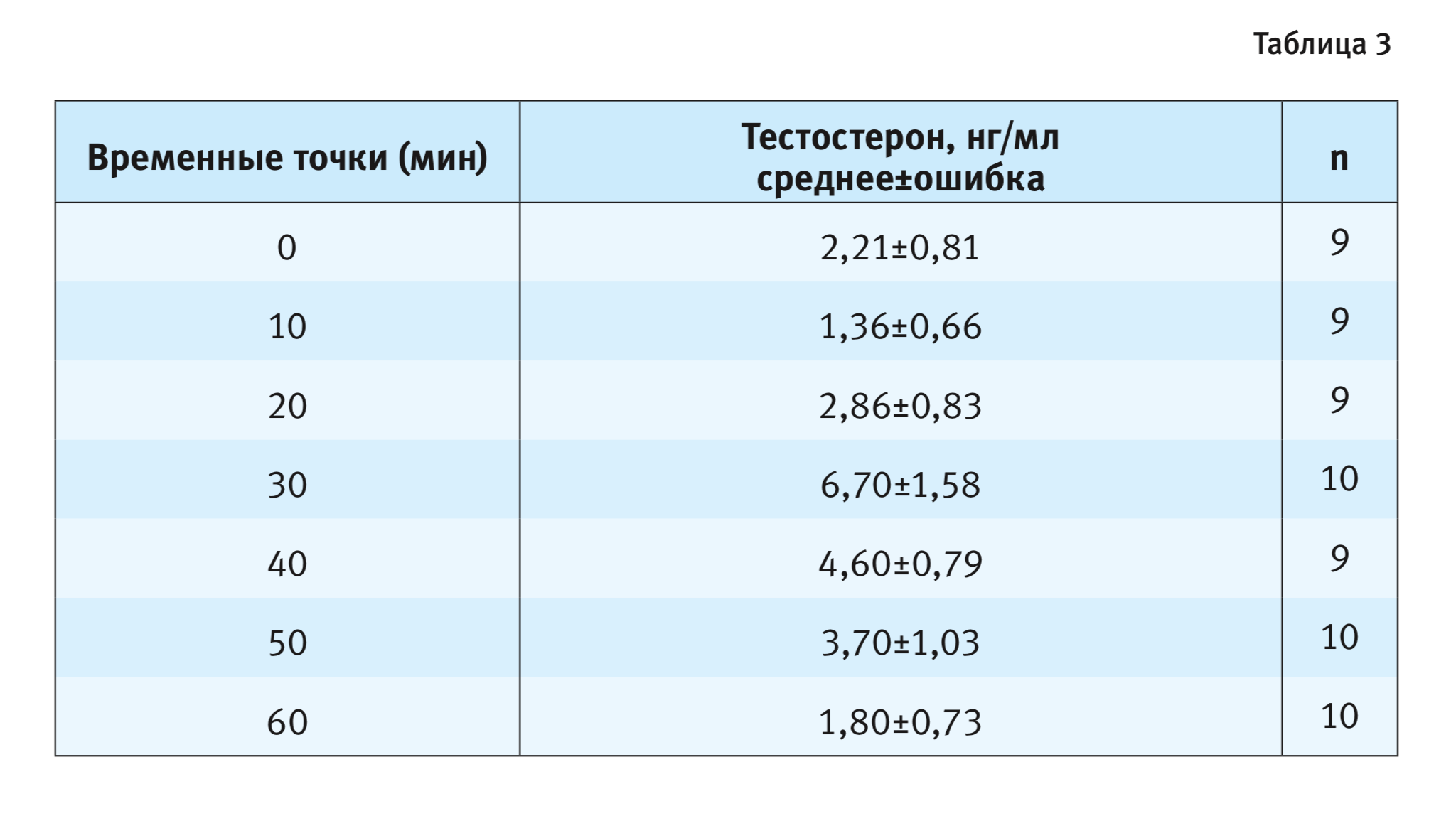
Определение содержания тестостерона в периферической крови самцов C57BL/6J выявило отчетливое его повышение, вызванное появлением за перегородкой самки (рис. 2). Дисперсионный анализ показал влияние фактора длительности пребывания рецептивной самки за перегородкой на уровень гормона у самцов C57BL/6J (F6,59=3,69; p<0,01). Через 30 мин после помещения самки концентрация тестостерона в крови самцов выросла в 3 раза по сравнению с базальным уровнем, после чего отмечено постепенное снижение содержания гормона до исходных значений.
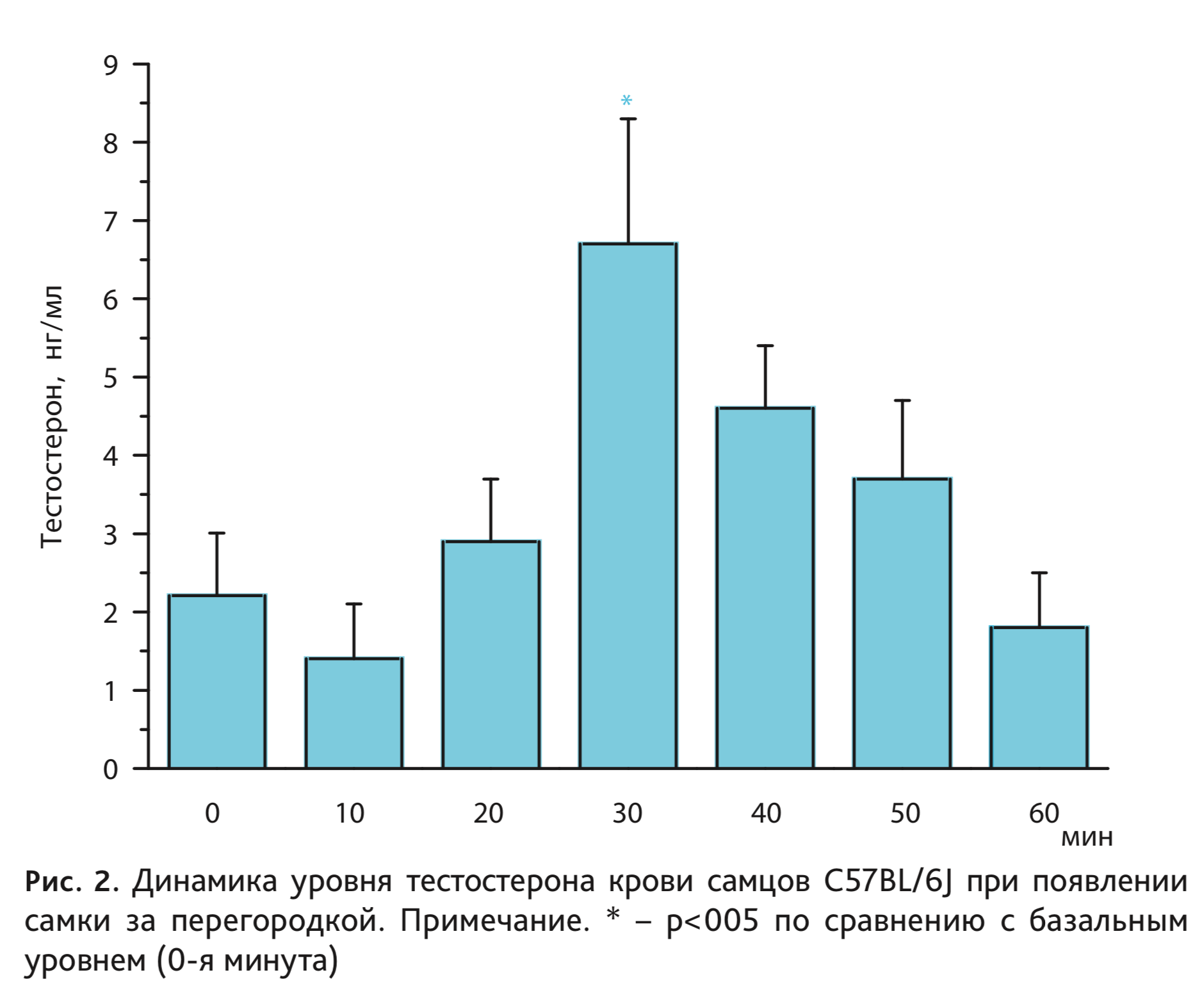
Среди причин, которые могли бы объяснить отсутствие повышения уровня тестостерона у мышей исследуемой линии в предыдущих работах, можно выделить следующие:
- межлинейные различия в несоответствии по времени наступления выраженного гормонального ответа у самцов разных генотипов;
- влияние самой процедуры тестирования;
- влияние сезонных факторов.
Так, в работе [5] уровень тестостерона в крови самцов различных линий определяли через 40 мин, однако согласно результатам настоящего исследования, в это время у самцов C57BL/6J уже нет достоверной разницы в уровне гормона по сравнению с его значениями на 10-й или 20-й минутах. В работе [1] содержание тестостерона определяли, как и в данном исследовании, после 30-минутного пребывания с самкой, однако схема эксперимента была иной. В этой работе каждую клетку с самцом снимали со стеллажа, переносили в комнату для тестирования, открывали крышку, накрывали прозрачным оргстеклом и после 5-минутной адаптации самца к новым условиям в последующие 30 мин регистрировали его поведение у перегородки, за которую помещали рецептивную самку и уже после этого забиралась кровь для определения в ней тестостерона [1]. Вероятно, что в этих условиях тестирования помимо активации ГГСК происходила активация и гипоталамо-гипофизарно-адреналовой системы самцов, которая, в зависимости от генотипа, по-разному модифицировала у животных возникающий при этом эндокринный ответ семенников.
В природных условиях процесс размножения у мышевидных грызунов носит ярковыраженный сезонный характер. В проведенном нами ранее исследовании на мышах линии СВА/Lac показано, что для каждого сезона свойственна своя динамика уровня тестостерона в ответ на половую стимуляцию [7]. Так, в зимний период активация ГГСК у самцов СВА/Lac отмечена после 20-минутного пребывания их с самкой, тогда как летом подъем происходил после 40 мин.
Полученные данные позволяют поставить ряд актуальных вопросов по конкретным механизмам половой активации самцов линии С57BL/6J при условии отсутствия тактильного контакта с самкой.
Хорошо известно, что для самцов данной линии характерен относительно низкий уровень базального тестостерона [2] на фоне резкого снижения чувствительности к изовалериановой кислоте – ключевого компонента вагинальных выделений мыши [4, 13, 22]. Неясно и относительное значение феромональной стимуляции в данных экспериментальных условиях мультисенсорной стимуляции ГГСК у животных данной линии. В настоящее время общепринято, что кодирование обонятельного образа у мышей и крыс тесно связано с феноменом физиологической протеинурии – резко повышенным выделением с мочой низкомолекулярных белков – липокалинов, кодируемых у мышей комплексом генов Mup (Chr. 4) [3, 9–11, 15]. Строго определенная комбинация этих белков наряду с рядом высоколетучих соединений (лигандов) составляют так называемый обонятельный код, позволяющий реципиенту судить о возрасте, генотипе и половой принадлежности донора. В расшифровке данной комбинации летучих компонентов мочи участвует как основная, так и дополнительная (вомероназальная) обонятельные системы реципиента [14, 21].
В свете полученных в настоящей работе результатов особый интерес представляют данные по роли хемокоммуникационных механизмов в формировании и поддержании так называемой Европейской гибридной зоны между ареалами обитания M.m. musculus и M.m. domesticus [16,19].
В целом конкретные нейрофизиологические половой активации у самцов линии С57BL/6, продемонстрированные в настоящей работе, нуждаются в дальнейшем изучении.
Заключение
Таким образом, в настоящей работе было показано, что при половом возбуждении у самцов C57BL/6J происходит активация ГГСК, а сам подъем уровня тестостерона, обусловленный присутствием рецептивной самки, – достаточно надежный параметр, характеризующий половое возбуждение самца. Тем не менее в эксперименте необходимо учитывать возможность различающегося времени наступления рефлекторного гормонального ответа семенников мышей в ответ на сексуальный стимул, который зависит от генотипа самца, дизайна эксперимента, а также от сезона, в который проводится исследование.
В работе использована генетическая линия мышей, входящая в состав уникальной̆ научной̆ установки (УНУ) «Биологическая коллекция – генетические биомодели нейропсихических заболеваний» (№493387) НИИФФМ.
Список источников
- Амстиславская Т.Г., Храпова М.В. Влияние генотипа на поведенческую и гормональную компоненты половой активации самцов мышей. Бюлл. экспер. биол. мед. 2002. Т. 133, 5: 548–51.
- Новиков С.Н. Феромоны и размножение млекопитающих. М.: Наука (ЛО). – 1988; 168 с.
- Новиков С.Н., Чураков Г.А., Филимоненко А.А., Ермакова И.И., Федорова Е.М., Буркот И.А. Влияние генотипа и пола на экспрессию белков мочи комплекса MUP в постнатальном онтогенезе мыши. Онтогенез. 2009; 40 (4): 261–9.
- Новиков С.Н., Троицкая В.Т., Гладышева О.С., Чураков Г.А. Специфическая аносмия к изовалериановой кислоте у лабораторных мышей линии C57BL/6. Докл. РАН. 2002; 387 (4): 562–4.
- Осадчук А.В., Науменко Е.В. Роль генотипа и некоторых видов зоосоциального поведения в регуляции эндокринной функции семенников у мышей. Докл. АН СССР. 1981; 258 (3): 746–9.
- Попова Н.К., Амстиславская Т.Г., Кучерявый С.А. Половая мотивация самцов мышей, индуцированная присутствием самки. Журн. высш. нервн. деят. 1998; 46 (1): 84–90.
- Amstislavskaya T.G., Popova N.K. Female-induced sexual arousal in male mice and rats: behavioral and testosterone response. Horm. Behav., 2004; 46 (5): 544–50.
- Amstislavsky S.Ya., Amstislavskaya T.G., Amstislavsky V.S., Tibeikina M.A., Osipov K.V., Eroschenko V.P. Reproductive abnormalities in adult male mice following preimplantation exposures to estradiol or pesticide methoxychlor. Reprod. Toxicol. 2006; 21 (2): 154–9.
- Bacchini A., Gaetani E., Cavaggioni A. Pheromone binding proteins of the mouse, Mus musculus. Experientia. 1992. 48 (4): 419–921.
- Cheetham S.A., Smith A.L., Armstrong S.D., Beynon R.J., Hurst J.L. Limited variation of the major urinary proteins of laboratory mice. Physiol. Behav. 2009; 96 (2): 253–61. DOI: 10.1016/j.physbeh. 2008.10,005
- Churakov G., Philimonenko A.A., Novikov S. Genetic control and expression of the major urinary proteins (MUPs) in laboratory mice: MUPs as potential pheromone messengers? Chem. Senses. 1992; 17: 604.
- Johnston R.E. Pheromones, the vomeronasal system, and communication. From hormonal responses to individual recognition. Ann. NY Acad. Sci. 1998; 855: 333–48.
- Griff I.C., Reed R.R. The genetic basis for specific anosmia to isovaleric acid in the mouse. Cell. 1995; 83 (3): 407–14.
- Kelliher K.R. The combined role of the main olfactory and vomeronasal systems in social communication in mammals. Horm. Behav. 2007; 52 (5): 561–70. DOI: 10.1016/j.yhbeh.2007.08.012.
- Kwak J., Grigsby C.C., Rizki M.M., Preti G., Köksal M., Josue J., Yamazaki K., Beauchamp G.K. 2012. Differential binding between volatile ligands and major urinary proteins due to genetic variation in mice. Physiol. Behav., 2012, Vol. 107 (1): 112–20. DOI: 10.1016/j.physbeh.2012.06.008.
- Mucignat-Caretta C., Redaelli M., Orsetti A., Perriat-Sanguinet M., Zagotto G., Ganem G. Urinary volatile molecules vary in males of the 2 European subspecies of the house mouse and their hybrids. Chem. Senses. 2010; 35 (8): 647–54. DOI: 10.1093/chem.se/bjq049.
- Nyby J.G. Reflexive testosterone release: a model system for studying the nongenomic effects of testosterone upon male behavior. Front Neuroendocrinol. 2008; 29 (2): 199–210. DOI: 10.1016/j.yfrne.2007.09.001.
- Pialek J., Vyskocilova M., Bamova B., Havelkova D., Pialkova J., Dufkova P., Bencova V., Dureje K., Albrecht T., Hauffe H.C., Macholan M., Munclinger P., Storchova R., Zajacova A., Hola V., Gregorova S., Forejt J. Development of unique house mouse resources suitable for evolutionary studies of speciation. J. Heredity. 2008; 99 (1): 34–44. DOI: 10.1093/jhered/esm083
- Stopkova R., Stopka P., Janotova K., Jedelska P.L. 2007. Species-specific expression of major urinary proteins in the house mice (Mus musculus musculus and Mus musculus domesticus). J. Chem. Ecol. 2007; 33 (4): 861–9. DOI: 10.1007/s10886-007-9262-9
- Tikhonova M.A., Amstislavskaya T.G. Phenotyping the males of mo.use and rat strains with genetically defined behavioral disturbances in a model of sexual activation. Russian Journal of Genetics: Applied Research. 2016; 6 (4): 410–6. DOI: 10.1134/S2079059716040201.
- Wysocki C.J., Katz Y., Bernhard R. Male vomeronasal organ mediates female-induced testosterone surges in mice. Biol. Reprod. 1993; 28 (4): 917–22.
- Wysocki C.J., Whitney G., Tucker D. Specific anosmia in the laboratory mouse. Behav. Genetics. 1977; 7 (2): 171–88.



