Опыт моделирования неалкогольного стеатогепатита с применением метионин-холин-дефицитной диеты на мышах линии C57BL/6
Макарова М.Н., Гущин Я.И., Фаустова Н.М., Калатанова А.В., Селезнева А.И., Глембоцкий С.В. Опыт моделирования неалкогольного стеатогепатита с применением метионин-холин-дефицитной диеты на мышах линии C57BL/6. Лабораторные животные для научных исследований. 2018; 2. https://doi.org/10.29296/2618723X-2018-02-06
Резюме
Поиск и разработка новых лекарственных средств для лечения и профилактики неалкогольного стеатогепатита (НАСГ) является одной из актуальных задач современной фармакологии. НАСГ – существенная угроза для здоровья населения, так как развитие его происходит постепенно, без выраженных проявлений. Патогенез НАСГ сегодня рассматривается в виде теории «двух ударов»: увеличение поступления в печень свободных жирных кислот (СЖК) и развитие стеатоза гепатоцитов – «первичный удар»; реакции окисления СЖК и образование продуктов перекисного окисления липидов и реактивных форм кислорода – оксидативный стресс – «второй удар». Для оценки эффективности кандидатов в лекарственные средства для лечения и профилактики НАСГ используются различные методы моделирования этой патологии у животных, каждый из которых имеет свои плюсы и минусы, которые рассмотрены в данной статье. На основании анализа основных методов моделирования представлены результаты апробации применения метионин-холин-дефицитной диеты у мышей с целью развития НАСГ. В результате длительного (28 дней) применения этой диеты у мышей линии C57bl/6 было отмечено изменение значений ключевых параметров, характеризующих развитие НАСГ у человека. На 29-й день исследования на фоне экспериментальной модели у животных наблюдалось увеличение активности аспартатаминотрансферазы и концентрации провоспалительных цитокинов (интерлейкин-6 и фактор некроза опухоли-α), развитие оксидативного стресса (увеличение концентрации малонового диальдегида в печени и крови животных), жировая и баллонная дистрофия гепатоцитов, а также воспалительная инфильтрация печени, зарегистрированная по результатам гистологии. Все отмеченные патологические изменения у экспериментальных животных являются проявлениями основных компонентов патогенеза НАСГ и наблюдаются в клинике. Это позволяет сделать вывод об эффективности моделирования НАСГ с помощью включения в рацион мышей линии C57bl/6 метионин-холин дефицитной диеты для оценки новых лекарственных средств для лечения и профилактики этого заболевания. В статье рассмотрены методологии и условия моделирования НАСГ.
Введение
Термин «стеатогепатит» употребляется для описания группы патологических изменений печени, характеризующихся воспалительной инфильтрацией на фоне жировой дистрофии гепатоцитов [1]. Стеатогепатит подразделяется на алкогольную болезнь печени, метаболический стеатогепатит и лекарственный стеатогепатит [2], которые нередко сочетаются между собой. Лекарственный стеатогепатит возникает при длительном применении лекарственных средств – антибиотиков тетрациклинового ряда, синтетических гормональных препаратов, антагонистов кальция, противогрибковых препаратов др. Алкогольный стеатогепатит возникает на фоне хронического применения этилового спирта в гепатотоксичных дозах (> 40 г чистого этанола в сутки) [1].
Неалкогольный стеатогепатит (НАСГ) – одна из ключевых проблем современной гепатологии, отражающая поражение печени у лиц, не злоупотребляющих алкоголем [3]; это самостоятельная нозологическая единица, для которой характерны повышение активности ферментов печени в крови, жировая дистрофия и воспалительная реакция в ткани печени. Термин «неалкогольный» подчеркивает обособленность этой нозологической единицы от алкогольной болезни [4].
Патогенез НАСГ изучен недостаточно. Принято считать, что жировой гепатоз предшествует НАСГ. Развитие жирового гепатоза – собственно накопление липидов (триглицеридов – ТГ) – может быть следствием увеличения поступления свободных жирных кислот (СЖК) в печень [5], снижения скорости b-окисления СЖК в митохондриях печени [6] и повышения синтеза жирных кислот в митохондриях печени. Важную роль в патогенезе НАСГ играет также воспалительный компонент и развитие инсулинорезистентности [7].
Патогенез НАСГ сегодня рассматривается в виде теории «двух ударов» и объединяет известные факторы риска стеатогепатита. При нарастании ожирения увеличивается поступление в печень СЖК и развивается стеатоз гепатоцитов – «первичный удар». Во время развития этого процесса происходят реакции окисления СЖК и образуются продукты перекисного окисления липидов и реактивные формы кислорода – оксидативный стресс – «второй удар» [8].
Кандидаты в лекарственные средства требуют тщательного изучения их эффективности и механизма действия. Доклинические исследования с использованием животных позволяют изучить механизм и степень выраженности стеатогепатита у животных, а также оценить фармакологическую активность лекарственных средств, применяемых для его коррекции.
В доклинических исследованиях моделирование НАСГ осуществляется преимущественно на мышах с различными экспериментальными моделями, сопровождающимися глубокими структурными изменениями ткани органа, сходными с таковыми нарушениями у человека, но формирующимися за более короткий период. Наиболее распространенные методы моделирования НАСГ представлены в табл. 1.
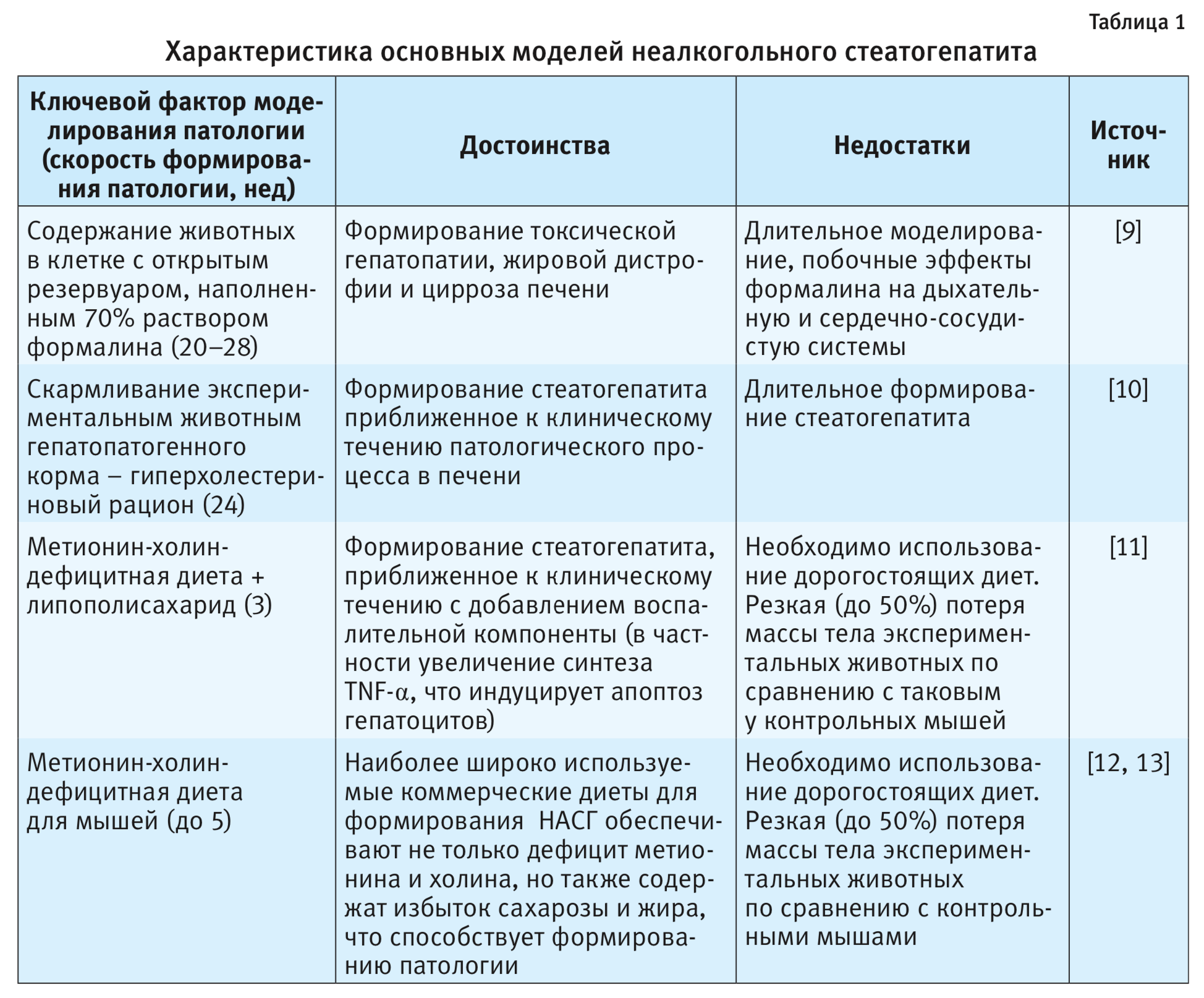
Наиболее интересны на сегодняшний день модели НАСГ, индуцированного путем метионин-холин-дефицитной диеты. Применение данной диеты вызывает повышение уровня трансаминаз и гистологические изменения печени, характеризующие стеатоз, фокусное воспаление и некроз гепатоцитов [14–16]. Эти гистологические изменения происходят быстро и морфологически сходны с проявлениями НАСГ у человека.
Механизм развития НАСГ у мышей при метионин- и холин-дефицитной диете связан в основном с нарушением образования фосфатидилхолина, участвующего как в построении мембран гепатоцитов, так и в транспорте липопротеинов. При постоянном дефиците в диете метионина и холина количество активных клеток печени критически уменьшается. По этой причине, как правило, происходит и блокирование процессов β-окисления. Оставшийся фосфатидилхолин расходуется печенью «экономно» в небольших количествах, в результате возможно уменьшение образования липопротеинов и снижение транспорта ТГ, холестерина и других стероидов в кровь. Процессы увеличения проницаемости и последующей гибели гепатоцитов сопровождаются выходом в кровь таких индикаторных ферментов, как аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ). В комплексе эти признаки составляют целостную картину, сначала – воспалительного, а потом – и цитолитического синдрома [17], которые являются первыми и патогномоничными в развитии поражения печени. Дальнейшее развитие печеночной патологии характеризуется возникновением других 3 синдромов – мезенхимально-воспалительного, холестатического и синдрома печеночно-клеточной недостаточности. Эти три синдрома могут не иметь четкой последовательности, но, как правило, их развитию предшествует мощный цитолитический синдром, клинически проявляющийся выраженной ферментемией. Таким образом, повышенная активность трансаминаз является не столько симптомом выраженности поражения печени, сколько маркером 1-й стадии повреждения гепатоцитов, за которой следуют более тяжелые стадии развития НАСГ – жировая дистрофия печени, воспаление, дисфункция печени и цирроз.
Роль оксидативного стресса в патогенезе НАСГ достаточно изучена и отражена в литературе [18]. Накопление липидов в гепатоцитах уменьшает работу электрон-транспортной цепи митохондрий и стимулирует пероксисомальный и микросомальный пути оксидации при ожирении. Оксидативный стресс – еще один провокатор выделения воспалительных цитокинов, вследствие чего развиваются воспаление и процессы фиброза [19].
Цель данного исследования – апробация метода метионин- и холин-дефицитной диеты для моделирования НАСГ на мышах линии C57bl/6 и определение динамики ключевых показателей, характеризующих развитие НАСГ у экспериментальных животных.
Материал и методы
При проведении данного экспериментального исследования в качестве биологической тест-системы использовали мышей линии C57bl/6.
План экспериментального исследования был рассмотрен и одобрен биоэтической комиссией (протокол от 03.06.2015 №1.21/15). Для эксперимента получено 30 мышей из филиала «Андреевка» НЦБМТ ФМБА России. Масса тела животных не различалась между группами более чем на 10%. Во время адаптации и эксперимента мышей содержали в стандартных условиях вивария в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза от 22.09.2010. по охране животных, используемых в научных целях. Животные содержались в клетках по 5 особей одного пола. Подстилом для мышей служили древесные гранулы.
Моделирование НАСГ осуществлялось путем получения животными коммерческой метионин- и холин-дефицитной диеты (MP
Biomedicals, LLC. Lot. P112, каталожный номер 960439) ad libitum (не менее 5 г на 1 голову). Пища
помещалась в кормовое углубление клетки в течение 28 дней. Животные были разделены на
2 группы по 15
мышей, из них 1-я (интактная) группа получала стандартный рацион «Корм для содержания лабораторных
животных» ПК-120-1, 2-я группа находилась в условиях метионин-холин-дефицитной диеты. Эвтаназия
животных производилась на 29-й день эксперимента с использованием СО2-камеры. Животные находились
там до полной потери сознания, затем мышей поочередно извлекали, вскрывали грудную полость и осуществляли
полное стерильное обескровливание шприцем из полостей сердца, после чего проводился забор образцов печени.
Для оценки развития патологии на 29-й день эксперимента (посмертно) определяли следующие параметры: активность аминотрансфераз (АЛТ, АСТ); концентрацию холестерина, ТГ, холестерина липопротеидов высокой (ЛПВП) и низкой (ЛПНП) плотности. Уровень провоспалительных цитокинов IL6, TNFα в крови оценивали спектрофотометрически с помощью наборов TNFα (mouse) ELISA kit, interleukin-6 (mouse) ELISA kit; концентрацию инсулина – набора insulin (mouse) ELISA kit. Кроме того, в рамках данного исследования оценивали уровень перекисного окисления липидов (ПОЛ) в печени и крови мышей, по концентрации малонового диальдегида (МДА) [20].
Для гистологического исследования печень животных, извлеченную после эвтаназии, фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего заливали в парафин. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Морфологическое исследование гистологических препаратов проводили при помощи светооптического микроскопа Carl Zeiss (Германия). Микрофотографирование осуществляли при помощи цифровой фотокамеры Axio Scope A1 Carl Zeiss (Германия). Выраженность повреждения печени оценивали по критерию гистологической активности неалкогольного стеатогепатита [21]. Каждый морфологический признак поражения печени оценивался в баллах. Наиболее значимым гистологическим критерием развития НАСГ является стеатоз – система оценки в баллах (2; 4; 6). Следующий по значимости – развитие воспалительной инфильтрации – оценка в баллах (1,5; 3; 4,5; 6). Наименее специфично для формирования НАСГ формирование баллонной дистрофии – оценка в баллах от 1 до 3.
Статистический анализ первичных данных выполнялся с помощью программного обеспечения Statistica 10.0 (StatSoft, США).
Результаты и обсуждение
В ходе эксперимента значительное число животных погибало на фоне моделируемой патологии (25%); к 29-му дню исследования в группе, где применялась специальная диета, осталось 8 мышей. Высокий уровень смертности животных в модели НАСГ, индуцированной метионин- и холин-дефицитной диетой, предположительно, был обусловлен зоосоциальной напряженностью, вызванной сменой корма, либо развитием сильно выраженной печеночной патологии на фоне ее моделирования.
Известно, что моделируемая патология НАСГ характеризуется хроническим течением и имеет несколько компонентов:
- 1-й (ведущий) – жировая дистрофия печени в сочетании с наличием или отсутствием изменений липидного спектра крови;
- 2-й – наличие воспалительной реакции, выражающейся в повышении активности трансаминаз, увеличении концентрации провоспалительных цитокинов и развитии воспалительной инфильтрации ткани печени наряду с баллонной дистрофией гепатоцитов. Отдельно рассматривалось возможное увеличение концентрации инсулина;
- 3-й – оксидативный стресс и изменение активности антиоксидантной системы. Остановимся подробнее на каждом из составляющих компонентов моделируемой патологии.
Жировая дистрофия печени и липидный спектр крови. По результатам гистологического анализа печени мышей через 28 дней применения метионин- и холин-дефицитной диеты было установлено развитие выраженной жировой дистрофии печени у животных с моделируемой патологией. Критерии гистологической оценки НАСГ и результаты в баллах отражены в табл. 2–5.




Таким образом, в контрольной группе животных было отмечено достоверное изменение структуры ткани печени – жировая и баллонная дистрофия гепатоцитов.
В табл. 6 представлены данные о влиянии применения метионин- и холин-дефицитной диеты на липидный спектр периферической крови мышей.
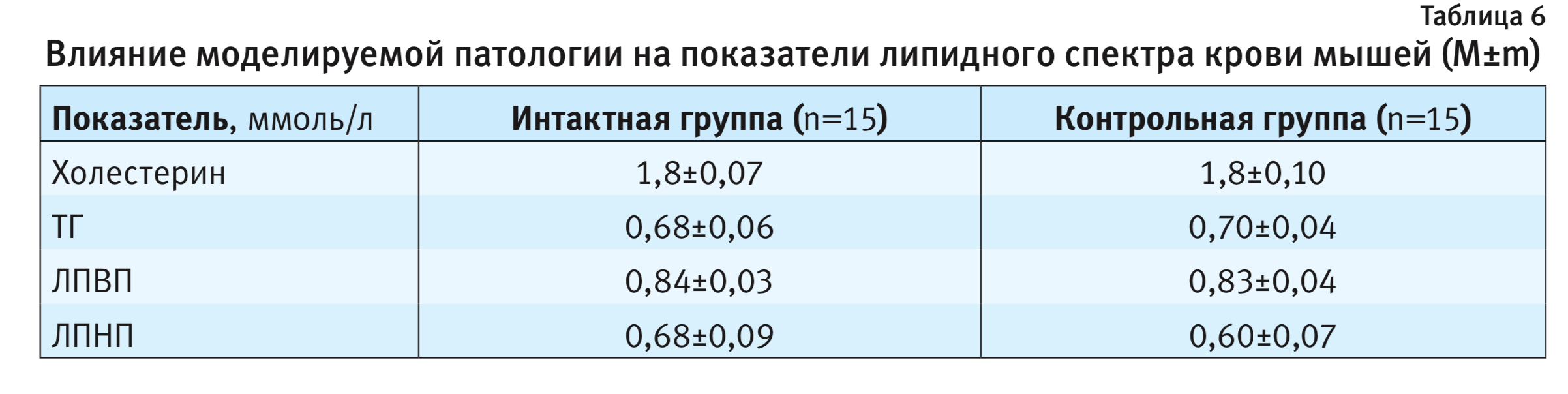
Гистологическая картина поражения печени у животных с моделируемой патологией полностью соответствовала таковой НАСГ в клинике. Отсутствие изменений липидного спектра крови на фоне патологии может объясняться особенностью патогенеза НАСГ: в процессе развития жировой дистрофии происходит накопление ТГ в ткани печени, а удаление липидов из печени вследствие снижения синтеза или секреции липопротеинов очень низкой плотности (в их составе из печени удаляются ТГ) может быть затруднено. В результате этого концентрация липидов в крови животных не изменяется [22]. Таким образом, оценивать липидный спектр у экспериментальных животных на этой модели нецелесообразно.
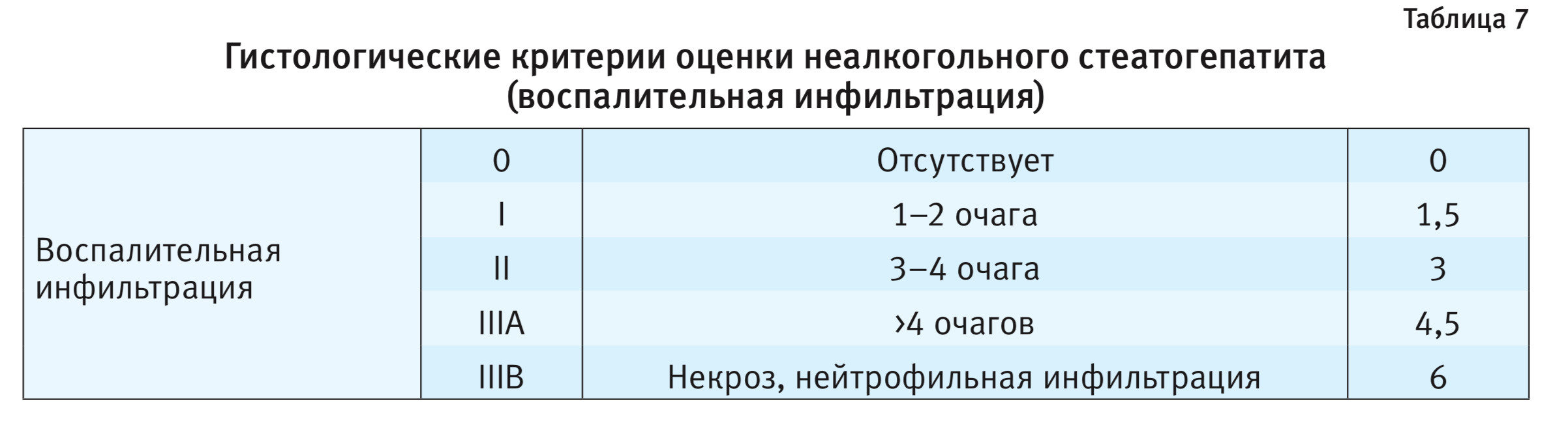
Воспалительная инфильтрация гепатоцитов. Воспалительная инфильтрация гепатоцитов на фоне моделируемой патологии выражалась перипортальной воспалительной и очаговой лимфоцитарной инфильтрацией, а также очагами некроза. Гистологические критерии воспалительной инфильтрации как компонента НАСГ представлены в табл. 7.
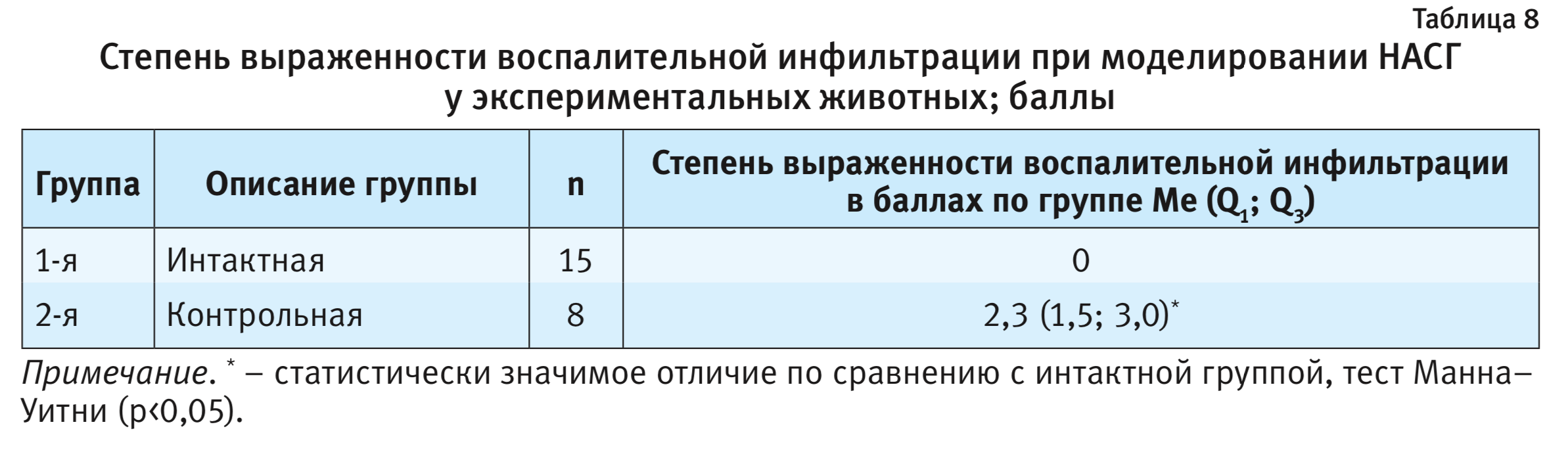
Полученные в ходе исследования данные приводятся в табл. 8.
Согласно данным, представленным в табл. 8, на фоне моделирования патологии в печени экспериментальных животных наблюдался процесс воспалительной инфильтрации.
Результаты определения активности трансаминаз и провоспалительных цитокинов у животных экспериментальных групп представлены в табл. 9.
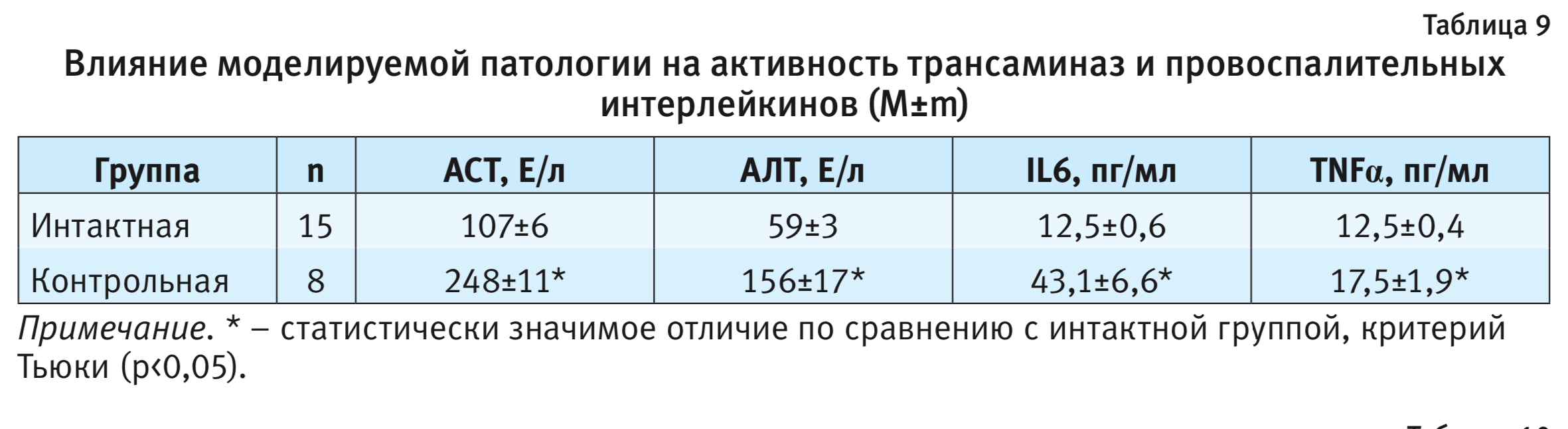
В группах мышей при метионин-холин-дефицитной диете гистологически отмечалось развитие воспалительной реакции в гепатоцитах, что соответствует данным анализа активности трансаминаз в крови экспериментальных животных: активность АЛТ и АСТ у мышей при диете была статистически выше таковой у интактных животных.
Согласно результатам определения уровня провоспалительных цитокинов в плазме крови, на фоне моделируемой патологии также происходило статистически значимое увеличение концентрации IL6 и TNFα.
Оксидативный стресс. Большинство патологических процессов в печени сопровождается окислительным стрессом. Ведущим критерием окислительного стресса при развитии НАСГ служит концентрация МДА в тканях и плазме крови. В табл. 10 представлены результаты исследования концентрации МДА в крови и печени экспериментальных животных.
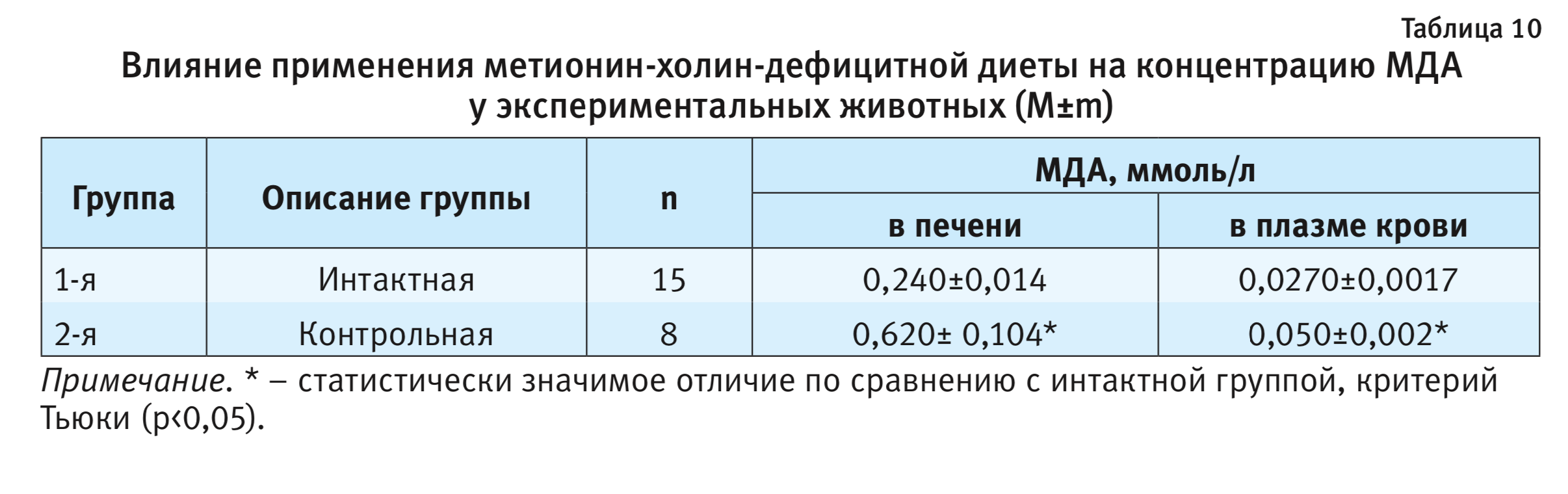
Концентрация МДА в печени животных контрольной группы в 2,6 раза, а в плазме крови – в 1,9 раз превышала таковую у животных интактной группы, что свидетельствует о развитии оксидативного стресса, сформированного за счет метионин-холин-дефицитной диеты.
Заключение
Для моделирования НАСГ в течение 28 дней мыши получали метионин-холин-дефицитную диету. Применение метионин-холин-дефицитной диеты у мышей в эксперименте позволило смоделировать развитие у них НАСГ с вовлечением всех 3 патогенетических компонентов, наблюдаемых при развитии НАСГ у человека:
- применение метионин-холин-дефицитной диеты способствовало формированию стеатоза, баллонной дистрофии и воспалительной инфильтрации гепатоцитов;
- использование предложенного способа моделирования приводило к достоверному увеличению активности АСТ и концентрации провоспалительных цитокинов (IL6 и TNFα);
- вклад окислительного стресса в развитие экспериментального НАСГ подтверждался достоверным повышением концентрации МДА в печени и крови животных, получавших метионин-холин-дефицитную диету.
Таким образом, совокупность полученных результатов позволяет рекомендовать апробированную методику моделирования НАСГ на мышах линии C57bl/6 для оценки эффективности препаратов релевантного фармакологического действия.
Список источников
- Буеверов А.О. Алкогольный и неалкогольный стеатогепатит: общность и различия. Диффузные заболевания печени: диагностика и лечение: Методическое пособие. Под ред. В.Т. Ивашкина. М.: ИД «М Вести». 2004; 32–43.
- Шульпекова Ю. О. Лекарственные поражения печени // Врач. – 2010; 7: 13–8.
- Павлов Ч., Бакулин И. Г. Неалкогольный стеатогепатит: клинические особенности и принципы лечения // Врач. – 2007; 10: 24–8.
- Подымова С.Д. Жировой гепатоз, неалкогольный стеатогепатит. Клинико-морфологические особенности. Прогноз. Лечение. // РМЖ. – 2005; 2: 61–5.
- Mylonas C., Kouretas D. Lipid peroxidation and tissue damage. In vivo (Athens, Greece). 1998; 13 (3): 295–309.
- Sanyal A. J. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001; 120 (5): 1183–92.
- Robertson G., Leclercq I., Farrell G. C. II. Cytochrome P-450 enzymes and oxidative stress //American Journal of Physiology-Gastrointestinal and Liver Physiology. 2001; 281 (5): G1135–39.
- Hardwick R.N., Fisher C.D., Canet M.J., Lake A.D. et al. Diversity in antioxidant response enzymes in progressive stages of human nonalcoholic fatty liver disease. Drug Metab. Dispos. 2010; 38 (12): 301–2293.
- Кауров Я.В. Способ создания модели гепатита и цирроза печени млекопитающих. Пат. РФ №94026117; 1996; G 09В23128.
- Мышкин В.А., Ибатуллина Р.Б., Волкова Е.С. Способ моделирования токсической гепатопатии. Пат. №2188457; 2002.
- Kudo H. Lipopolysaccharide triggered TNF--induced hepatocyte apoptosis in a murine non-alcoholic steatohepatitis model. Journal of hepatology. 2009; 51 (1): 168–75.
- Anstee Q.M., Goldin R.D. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research. Int. J. Exp. Pathol. 2006; 87 (1): 1–16.
- Pickens M. K. et al. Dietary sucrose is essential to the development of liver injury in the methionine-choline-deficient model of steatohepatitis // Journal of lipid research. 2009; 50 (10): 2072–82.
- Rinella M. E., Green R. M. The methionine-choline deficient dietary model of steatohepatitis does not exhibit insulin resistance. Journal of hepatology. 2004;40 (1): 47–51.
- Ip E. Administration of the potent PPARα agonist, Wy 14,643, reverses nutritional fibrosis and steatohepatitis in mice. Hepatology. 2004; 39 (5): 1286–96.
- Yamaguchi K. et al. Inhibiting triglyceride synthesis improves hepatic steatosis but exacerbates liver damage and fibrosis in obese mice with nonalcoholic steatohepatitis. Hepatology. 2007; 45 (6): 1366–74.
- Ивашкин В.Т., Лапина Т.Л. Гастроэнтерология: национальное руководство. ГЭОТАР-Медиа, 2013.
- Хазанов А.И. Возможности прогрессирования алкогольного и неалкогольного стеатогепатита в цирроз печени. Рос. журн. гастроэнтерол., гепатол. и колопроктологии. 2005; 15 (2): 26–32.
- Rolo A.P., Teodoro J.S., Palmeria C.M. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis. Free Radic. Biol. Med. 2012; 1 (1): 59–69.
- Pozharitskaya O.N., Shikov A.N., Laakso I., Seppänen-Laakso T., Makarenko I.E., Faustova N.M., Makarov V.G. Bioactivity and chemical characterization of gonads of green sea urchin Strongylocentrotus droebachiensis from Barents Sea // Journal of Functional Foods. 2015; 17: 227–23.
- Shahin Merat et al. A Modification of the Brunt System for Scoring Liver Histology of Patients with Non-Alcoholic Fatty Liver Disease. Arch. Iran Med. 2010; 13 (1): 38–44.
- Machado M.V., Michelotti G.A., Xie G., de Almeida T.P., Boursier J., Bohnic B., Guy C.D., Diehl A.M. Mouse model of diet-induced nonalcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS ONE. 2015; 10 (6): e0132315. DOI: 10.1371.



