Диет-индуцированные модели метаболических нарушений. Сообщение 2: экспериментальное ожирение
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 2: экспериментальное ожирение. Лабораторные животные для научных исследований. 2018; 2. https://doi.org/10.29296/2618723X-2018-02-05
Резюме
Ожирение – причина роста заболеваемости, который отмечается в последнее время и является фактором риска сердечно-сосудистых заболеваний, сахарного диабета типа 2 и других. Это обусловливает необходимость поиска средств профилактики и лечения ожирения. В основе ожирения как у человека, так и у животных лежат избыточное питание и недостаточная физическая активность. Поэтому экспериментальные модели на животных (грызунах, мини-свиньях и др.) позволяют довольно точно смоделировать картину заболевания. С учетом этиологии ожирения наиболее близкими к человеку являются диет-индуцированные модели ожирения, среди которых особенно эффективны высокожировые, менее эффективны комбинированные модели с высоким содержанием и жира, и углеводов; модели с высокой долей углеводов и низкой долей жиров малоэффективны. Оценивать эффективность исследуемых лечебно-профилактических мероприятий у животных с ожирением следует с помощью антропометрических показателей (длина и масса тела, окружность живота, длина голени и др.), массы органов и жира в них, а также физиологических (артериальное давление и др.) и биохимических показателей (лептин, грелин, инсулинорезистентность, адипонектин и др.).
Введение
В настоящее время повсеместно увеличивается число людей с ожирением, что опасно не только само по себе, но и как фактор риска развития сердечно-сосудистых заболеваний, сахарного диабета типа 2, артериальной гипертензии, некоторых видов рака, неалкогольной жировой болезни печени. Существующие в настоящее время лекарства для лечения ожирения недостаточно эффективны и имеют множество серьезных побочных эффектов [1]. В связи с этим поиск средств профилактики и лечения ожирения – чрезвычайно актуальная задача, диктующая необходимость создания и использования адекватных экспериментальных моделей на животных. При этом важную роль приобретает подбор как наиболее подходящих видов животных, так и методов индуцирования ожирения. Существенно также применение адекватных показателей для оценки эффективности исследуемых лечебно-профилактических мероприятий у животных с ожирением.
Характеристика ожирения
Ожирение называют пандемией XXI века – уже более 2 млрд людей на планете имеют избыточную массу тела и ожирение [2]. Как указывалось ранее, ожирение наряду с инсулинорезистентностью приводит к патогенетическим изменениям в организме при метаболическом синдроме [3], а также является одной из основных причин смерти населения. Известна тесная связь ожирения с неалкогольной жировой болезнью печени [4, 5]. При этом основными этиологическими факторами самого ожирения являются избыточное питание и недостаточная физическая активность как у людей, так и у животных в том числе у домашних питомцев (кошек, собак и др.) [6]. Замечено, что с возрастом число животных с ожирением так же, как и людей, увеличивается [7]. Возрастное ожирение, связанное со снижением интенсивности метаболических процессов на фоне прежнего объема потребления пищи, близко по механизмам развития к диет-индуцированному ожирению [8].
Рационы питания и виды животных, используемые для индукции ожирения
Имеется множество экспериментальных моделей ожирения: генетические, нейроэндокринные, хирургические, диет-индуцированные и др. При этом именно диет-индуцированные модели наиболее сопоставимы по своей этиологии и механизмам развития с ожирением у человека. Среди диет-индуцированных моделей выделяют высокожировые, высокоуглеводные и комбинированные с высоким содержанием и жиров, и углеводов, а также такие разновидности последних, как «диета кафетерия» и «западная диета» [8, 9].
Для индукции ожирения чаще всего часто используются высокожировые рационы, в которых содержание жира составляет от 30–40 до 60% от общей энергоценности рациона питания [10, 11] (табл. 1). При этом в качестве источника жира используются в основном животные жиры – говяжий, свиной (лярд) и сливочное масло, богатые насыщенными жирными кислотами. Насыщенные жирные кислоты вызывают более выраженную прибавку массы тела, чем полиненасыщенные при их одинаковом количестве [12, 13]. Контрольных животных обычно содержат на рационах питания с содержанием жира (в основном соевого масла) в пределах 5–14% от общей калорийности рациона. В качестве источника углеводов обычно используют кукурузный крахмал, белка – казеин [11]. Существующие в настоящее время корма промышленного производства (в основном для грызунов) содержат 30, 45 или 60% жировых калорий, а для контрольных животных выпускаются изокалорийные рационы, содержащие около 10% жира от общей энергоценности корма [14].
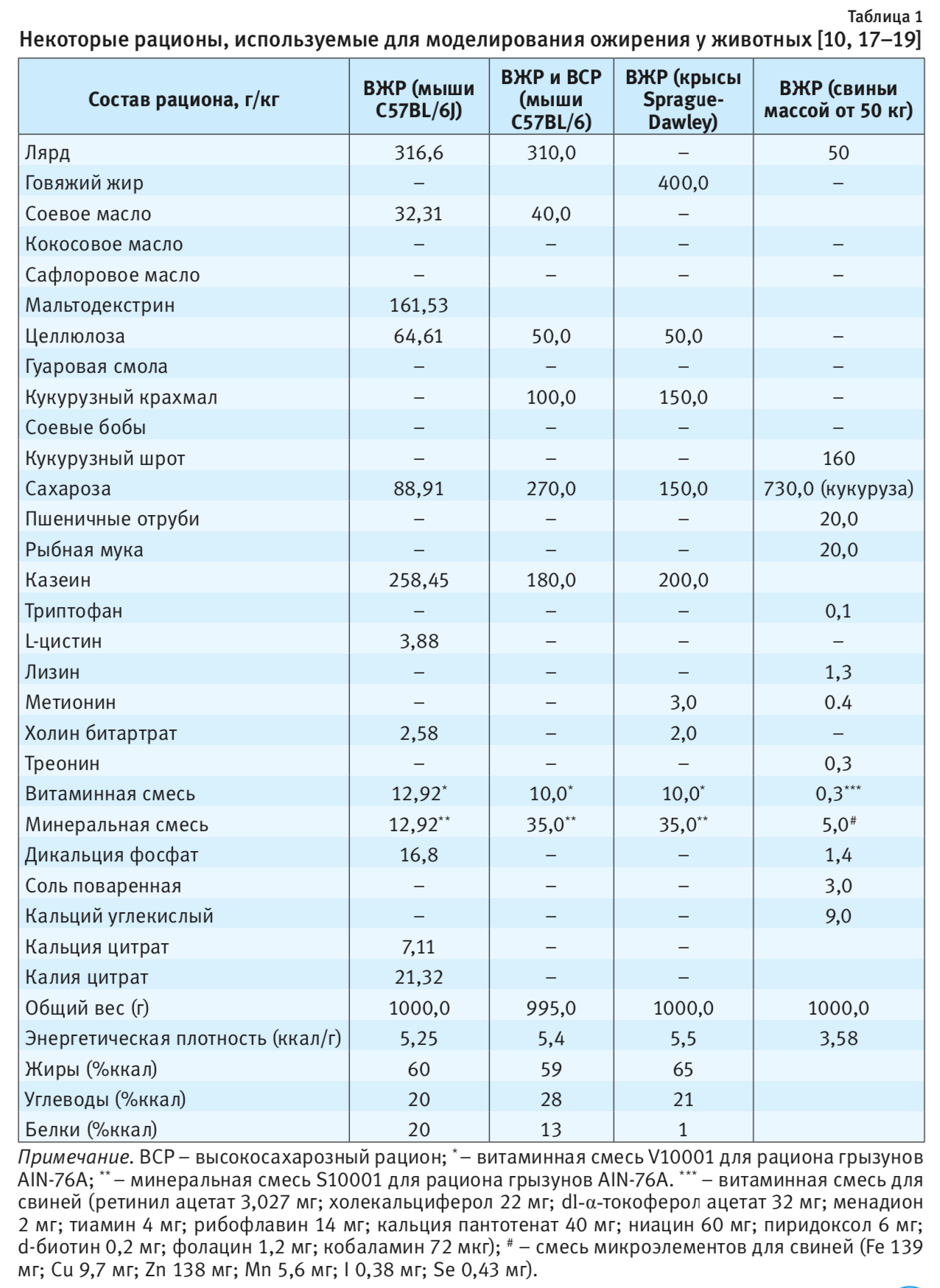
Несколько менее эффективны модели с высоким содержанием жиров и углеводов (см. табл. 1), а на высокоуглеводных моделях с малым количеством жира ожирение развивается медленно [12]. При этом исследователи отмечают более быстрое развитие ожирения при избытке фруктозы по сравнению с таким же количеством глюкозы [13], хотя на конечные значения показателей обмена веществ и антропометрии характер углеводов существенного влияния не оказывает [15].
Применяемая иногда «диета кафетерия», в которой избыточная калорийность рациона питания достигается за счет широкого разнообразия вкусных блюд и продуктов питания человеческой пищи (жареного мяса, макарон, сала, пирожных, сиропов и т.п.), также позволяет обеспечить развитие ожирения. Однако она может существенно отличаться от рациона питания контрольных животных, получающих корм с заранее заданным количеством нутриентов, особенно в отношении витаминов и минеральных веществ. Это не позволяет четко дифференцировать нарушения в организме животных с ожирением, которые могут быть связаны не только с высококалорийным питанием, но и с дефицитом витаминов и минералов [11]. «Западная диета», включающая около 45% жировых килокалорий, а также смесь фруктозы и сахарозы (55/45%) в питьевой воде (в частности для мышей), также относится к комбинированному типу рационов питания со всеми их недостатками в отношении сравнения с контролем [4].
Большинство исследователей считают важным такой показатель, как энергетическая плотность рациона питания, то есть количество килокалорий на 1 г корма [16]. Доказано, что, чем выше энергетическая плотность пищи, зависящая от количества жировых калорий, тем больше энергии потребляют с ней животные [16]. Подробная характеристика некоторых рационов, в том числе и их энергетическая плотность, представлена в табл. 1.
Для индуцирования ожирения, кроме полусинтетических рационов, которые готовят сами исследователи, широко используются готовые стандартные рационы промышленного производства: высокожировые рационы (ВЖР), содержащие около 60% ккал за счет жира и по 20% – углеводов и белка; высокоуглеводные рационы, в которых углеводы составляют 70% от энергоценности корма, жиры – 10%, белки – 20%, а также комбинированные рационы с 40% ккал за счет жира, 40% ккал – углеводов, 20% ккал – за счет белков.
Модели ожирения на грызунах
Наиболее часто для моделирования ожирения используются грызуны (обычно мыши и крысы), которые подобно человеку всеядны и имеют сходные вкусовые рецепторы и системы идентификации и переваривания пищи, а также близки нейроанатомически в отношении областей мозга, контролирующих потребление пищи [20]. Диет-индуцированные модели ожирения используются в основном для быстрой оценки системных и органоспецифических нарушений, вызываемых избыточной массой тела [14] для последующей их коррекции. По мнению большинства исследователей, диет-индуцированные модели на диких линиях ближе к патогенезу ожирения человека, чем модели на генетически модифицированных животных, у которых ожирение может развиваться на обычных рационах [6]. При этом чаще используют мышей линии C57BL/6, особенно для моделирования диет-индуцированного ожирения [10, 17, 21], крыс линий Wistar, Sprague-Dawley и Long Evans [18, 21, 22].
Для ускорения развития ожирения у диких линий грызунов рекомендуется содержать в клетке ≤4 животных при более высокой температуре воздуха в помещении, чем обычно, а также при увеличении темного периода по сравнению со светлым [22], так как повышение температуры окружающей среды способствует снижению энергозатрат на поддержание температуры тела, а увеличение периода темноты способствует более активному потреблению пищи (70–80% рациона), так как грызуны – ночные животные [12, 16]. Кроме того, рекомендуется проводить исследования по использованию высококалорийных рационов на взрослых животных, у которых обмен веществ менее интенсивный, чем у молодых растущих грызунов [22]. Определенное значение имеет и пол животных – самцы мышей более восприимчивы к диет-индуцированному ожирению, оно обширнее и развивается быстрее [13]. У крыс развитие и прогрессирование диет-индуцированного ожирения протекает примерно одинаково у самцов и самок [13].
Модели ожирения на кроликах
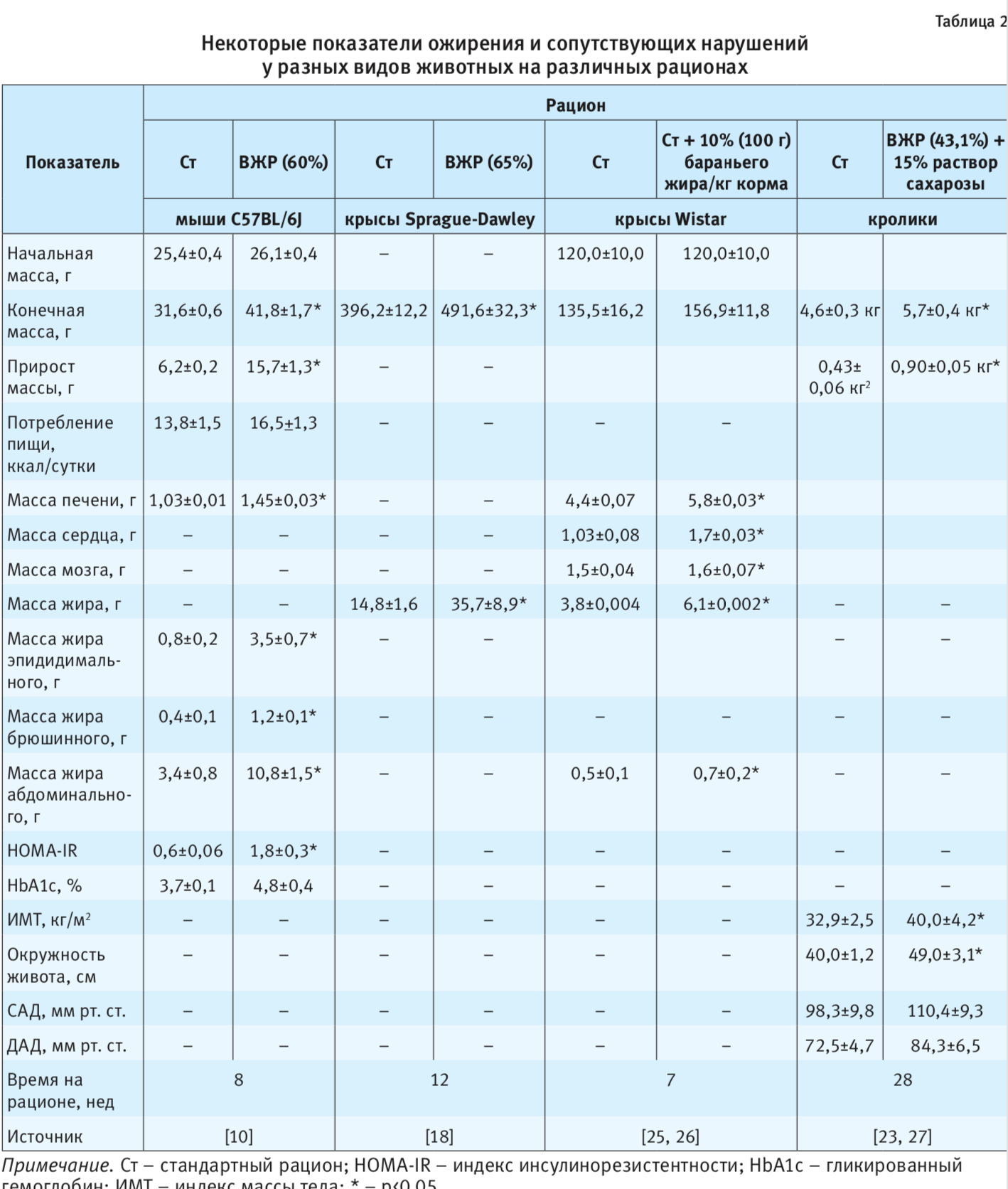
Кролики редко используются для моделирования ожирения; данные по массе тела и другим показателям, характерным для ожирения, чаще можно встретить в работах по изучению метаболического синдрома, сахарного диабета и др. Так, при моделировании диет-индуцированного метаболического синдрома у кроликов на комбинированном рационе (15,7% белка, 43,1% жира и 41,2% углеводов, 3,7 ккал/г энергетическая плотность), по сравнению с контрольными (23,4% белка, 11,1% жира и 65,5% углеводов, 2,7 ккал/г энергетическая плотность) к 28-й неделе развивается достоверное увеличение массы тела, окружности живота и индекса массы тела, а также наблюдается выраженная тенденция к увеличению систолического (САД) и диастолического (ДАД) артериального давления [23] (табл. 2).
Модели ожирения на крупных животных
Кроме грызунов, для моделирования ожирения используют таких крупных животных, как свиньи, в том числе мини-свиньи, собаки, а также нечеловекообразные обезьяны. Модели ожирения на крупных животных позволяют проводить длительные биохимические и физиологические исследования обмена веществ, в том числе с регулярным отбором крови. Многие из крупных животных, особенно свиньи и нечеловекообразные обезьяны, близки человеку как анатомически, физиологически, так и генетически. Свиньи (мини-свиньи) и собаки всеядны, подобно человеку, что позволяет моделировать сходные условия индукции ожирения; немаловажный фактор также высокая плодовитость собак и мини-свиней [21, 13]. Однако крупные животные гораздо более дороги в обслуживании, чем грызуны, поэтому их используют в малом количестве, что недостаточно для оценки статистической достоверности; у них медленнее, чем у грызунов, развивается избыточный вес [13]. Не стоит забывать и об этических проблемах в отношении собак, а также обезьян (из-за их внешнего сходства с человеком).
В настоящее время отмечается рост применения моделей ожирения на мини-свиньях, причем наиболее часто – на мини-свиньях линий Ossabaw, Yucatan и Göttingen; модели на собаках используются несколько реже; еще реже для изучения ожирения применяют обезьян, преимущественно макак-резус (Macaca mulatta), бабуинов (Papio species), африканских зеленых мартышек (Chlorocebus species) и некоторых других [13]. Макак, кстати, часто рассматривают как объект изучения возрастного ожирения, которое развивается у них между 10 и 15 годами. К этому возрасту потребность в энергии у них уменьшается на 30–40%, а привычка поедать определенное количество пищи у макак пожилого возраста приводит к ожирению, что наблюдается и у людей [8].
Показатели для оценки развития ожирения у разных видов животных
Для оценки развития ожирения в условиях эксперимента в первую очередь используются антропометрические показатели (длина и масса тела, окружность живота, длина голени и др.), на основании которых рассчитываются различные коэффициенты (индекс массы тела, соотношение окружности живота к длине тела и др.); исследуются также масса органов (особенно – масса жира в отдельных органах) масса абдоминального и перитонеального жира, гистология и гистохимия органов и тканей [10]. При этом увеличение массы тела на 10–25% оценивается как умеренное ожирение, а на 40% и более – как выраженное (тяжелое) ожирение [12]. Степень ожирения у крыс оценивают также с помощью индекса Ли – корень кубический из массы тела в граммах, деленный на длину тела (расстояние от ануса до носа) и умноженный на 1000; показатель выше 310 указывает на наличие ожирения [12]. Отмечается, что масса жировой ткани является более чувствительным критерием степени ожирения, чем масса тела [12]: так, при увеличении массы тела на 10% общая масса жира может возрастать на 35–40%. Антропометрические, физиологические и биохимические показатели, характерные для различных животных при диет-индуцированных моделях ожирения, представлены в табл. 2.
О причине ожирения у исследуемых животных – избыточном питании – можно судить по энергоценности потребляемого ими рациона питания за 1 сут. Важна именно энергоценность, а не количество съедаемого корма. Поэтому подопытные животные на высокожировом рационе питания могут употреблять меньше корма в граммах, чем контрольные из-за большей энергетической плотности их рациона [14].
Кроме того, для оценки эффективности исследуемых лечебно-профилактических мер рекомендуется определять такие показатели, тесно связанные с ожирением, как лептин, грелин, инсулинорезистентность, адипонектин и др. [5, 10, 12, 14, 24]. Так, на ВЖР у мышей отмечается существенное увеличение содержания адипонектина (32,06+0,85), по сравнению с животными на стандартном рационе (16,82+2,79) [24]. Аналогичные изменения происходят и в отношении инсулинорезистентности (см. табл. 2) [10].
Различные породы мини-свиней по-разному реагируют на высококалорийные рационы. Так, например, у мини-свиней породы Göttingen рацион с 40% жировых килокалорий уже в течение 3 мес вызывал существенное увеличение массы тела (32,6±2,4 кг) по сравнению с таковым у контрольных животных (24,9±0,5 кг) [28]. Для породы Ossabaw характерно более медленное развитие ожирения на ВЖР (43% ккал), значительно масса тела у них изменяется лишь через 16 нед – 82,5±15,6 кг по сравнению с 58,1±5,2 кг у контрольных [29]. На высококалорийном рационе у мини-свиней Ossabaw отмечается увеличение окружности грудной клетки до 99,3±1,3 см по сравнению с 85,6±1,3 см у контрольных, а также окружности живота – до 102,9±1,3 см в сравнении с 87,1±1,3 см у животных на обычном рационе питания [30]. Кроме того, существенно различаются и биохимические показатели: рост уровня глюкозы – до 4,37±0,28 по сравнению с 3,28±0,15 ммоль/л у контрольных животных, инсулина – соответственно 163,19±18,05 и 83,33±16,00 пмоль/л; лептина – соответственно 19,8±1,1 и 6,6±1,1 нг/мл [31].
Заключение
Для моделирования ожирения широко используются мыши и крысы, причем лучше всего подходят дикие породы грызунов. Что касается крупных животных, то в настоящее время стали чаще применять мини-свиней, организм которых по многим параметрам схож с организмом человека; однако их обслуживание дорого обходится, что ограничивает их привлечение к экспериментам для получения достоверных статистических результатов.
Наиболее близки по этиологии и механизмам развития к ожирению у человека диет-индуцированные модели ожирения, позволяющие как получать новые данные по патофизиологии ожирения, так и проводить оценку лечебных и профилактических мероприятий. Среди диет-индуцированных моделей наиболее эффективны высокожировые, менее эффективны комбинированные модели с высоким содержанием и жира и углеводов; модели с высокой долей углеводов и низкой долей жиров малоэффективны. Рационы питания для исследования диет-индуцированного ожирения на животных должны содержать достаточное количество белка, минеральных веществ и витаминов, чтобы исключить возможность чрезмерного переедания для удовлетворения потребностей в этих питательных веществах. Для ускорения развития ожирения наряду с высококалорийными рационами необходимо использовать и другие этиологические факторы: гипокинезию, увеличение темного периода в виварии, поддержание особого теплового режима, применение половозрелых животных и др.
Оценивать эффективность исследуемых лечебно-профилактических мероприятий у животных с ожирением рекомендуется по антропометрическим показателям (длина и масса тела, окружность живота, длина голени и др.), массе органов и жира в них, а также по ряду физиологических (артериальное давление и др.) и биохимических показателей (лептин, грелин, инсулинорезистентность, адипонектин и др.).
Список источников
- Agahi A., Murphy K.G. Models and Strategies in the Development of Antiobesity Drugs. Vet. Pathol., 2014 May; 51 (3): 695–706. doi: 10.1177/0300985813492801.
- Cordero P., Li J., Oben J.A. Epigenetics of obesity: beyond the genome sequence. Curr. Opin. Clin. Nutr. Metab. Care. 2015, 18: 361–6. doi:10.1097/MCO.0000000000000179.
- Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 1: Экспериментальный метаболический синдром. Лабораторные животные для научных исследований. 2018; 1.
- Woodie L.N., Luo Y., Wayne M.J., Graff E.C., Ahmed B., O’Neill A.M., Greene M.W., Restricted feeding for 9h in the active period partially abrogates the detrimental metabolic effects of a Western diet with liquid sugar consumption in mice. Metabolism. 2017. Dec 15. pii: S0026-0495(17)30341-4. doi: 10.1016/j.metabol.2017.12.004.
- Segal-Lieberman G., Rosenthal T. Animal Models in Obesity and Hypertension. Curr. Hypertens. Rep. 2013; 15:190–195. doi: 10.1007/s11906-013-0338-3.
- Osto M., Lutz T.A. Translational value of animal models of obesity – Focus on dogs and cats. Eur. J. Pharmacol. 2015 Jul 15;759:240-52. doi: 10.1016/j.ejphar.2015.03.036.
- Hansen B.C. Causes of Obesity and Consequences of Obesity Prevention in Non-human Primates and Other Animal Models. In: International Textbook of Obesity. Edited by Per Bjorntorp. – John Wiley & Sons Ltd, 2001: 181–201.
- Lutz T.A., Woods S.C. Overview of Animal Models of Obesity. In: Animal Models of Disease. Current Protocols in Pharmacology, John Wiley & Sons, Inc. 2012; 5.61.1–5.61.18. doi: 10.1002/0471141755.ph0561s58.
- York D.A. Lessons from animal models of obesity. Endocrinol. Metab. Clin. North Am. 1996 Dec; 25 (4):781–800.
- Kim H.J., Kim S., Lee A.Y., Jang Y., Davaadamdin O., Hong S.-H., Kim J.S., Cho M.-H. The Effects of Gymnema sylvestre in High-Fat Diet-Induced Metabolic Disorders. Amer. J. Chin. Med., 2017. Vol. 45; 4: 1–20. doi: 10.1142/S0192415X17500434.
- Stranahan A.M. Models and mechanisms for hippocampal dysfunction in obesity and diabetes. Neurosci. 2015 November 19; 309: 125–39. doi: 10.1016/j.neuroscience.2015.04.045.
- Thibault L. Animal Models of Dietary-Induced Obesity. In: Animal Models for the Study of Human Disease, edited By P. M. Conn. Academic Press, Elsevier Inc. 2013; 277–303. doi: 10.1016/B978-0-12-415894-8.00013-0.
- Kleinert M., Clemmensen C., Hofmann S.M., Moore M.C., Renner S., Woods S.C., Huypens P., Beckers J., de Angelis M.H., Schürmann A., Bakhti M., Klingenspor M., Heiman M., Cherrington A.D., Ristow M., Lickert H., Wolf E., Havel P.J., Müller T.D., Tschöp M.H. Animal models of obesity and diabetes mellitus. Nat. Rev. Endocrinol., 2018; 14 (3): 140–62. doi: 10.1038/nrendo.2017.161.
- Guerre-Millo M. Chapter 18. Animal Models of Obesity. In: J.-P. Bastard and B. Fève (eds.), Physiology and Physiopathology of Adipose Tissue. Springer-Verlag, France, 2013; 255–66. doi: 10.1007/978-2-8178-0343-2_18.
- Ochoa M., Val-Laillet D., Lallès J.P., Meurice P., Malbert C.H. Obesogenic diets have deleterious effects on fat deposits irrespective of the nature of dietary carbohydrates in a Yucatan minipig model. Nutr Res. 2016; 36 (9): 947–54. doi: 10.1016/j.nutres.2016.07.003.
- Hariri N., Thibault L. High-fat diet induced obesity in animal models. Nutr. Res. Rev., 2010; 23; 2: 270–99. doi:10.1017/S0954422410000168.
- Ojo B., Simenson A.J., O’Hara C., Wu L., Gou X., Peterson S.K., Lin D., Smith B.J., Lucas E.A. Wheat germ supplementation alleviates insulin resistance and cardiac mitochondrial dysfunction in an animal model of diet-induced obesity. Br. J. Nutr. 2017; 118 (4): 241–9. doi: 10.1017/S0007114517002082.
- Karimi G., Jamaluddin R., Mohtarrudin N., Ahmad Z., Khazaai H., Parvaneh M. Single-species versus Dual-species Probiotic Supplementation as an Emerging Therapeutic Strategy for Obesity. Nutr. Metab. Cardiovasc. Dis. 2017; 27 (10): 910–8. doi: 10.1016/j.numecd.2017.06.020.
- Zhao H., Li K., Tang J.Y., Zhou J.C., Wang K.N., Xia X.J., Lei X.G. Expression of Selenoprotein Genes Is Affected by Obesity of Pigs Fed a High-Fat Diet. J. Nutr., 2015; 145 (7): 1394–401. doi: 10.3945/jn.115.211318.
- Vickers S.P., Jackson H.C., Cheetham S.C. The utility of animal models to evaluate novel anti-obesity agents. Br. J. Pharmacol. 2011; 164 (4): 1248–62. doi: 10.1111/j.1476-5381.2011.01245.x.
- Kanasaki K., Koya D. Biology of Obesity: Lessons from Animal Models of Obesity. J. Biomed. Biotechnol., 2011. Vol. 2011, Article ID 197636, 11 pages. doi:10.1155/2011/197636.
- Rosini T.C., da Silva A.S.R., de Moraes C. Diet-induced obesity: rodent model for the study of obesity-related disorders. Rev. Assoc. Med. Bras. 2012; 58 (3): 383–7.
- Arias-Mutis O.J., Marrachelli V.G., Ruiz-Saurí A., Alberola A., Morales J.M., Such-Miquel L., Monleon D., Chorro F.J., Such L., Zarzoso M. Development and characterization of an experimental model of diet-induced metabolic syndrome in rabbit. PLOS ONE, May 23, 2017; 18. DOI: 10.1371/journal.pone.0178315. eCollection 2017.
- Takahashi H., Hosono K., Endo H., Nakajima A. Colon epithelial proliferation and carcinogenesis in diet-induced obesity. Journal of Gastroenterology and Hepatology 2013; 28 (Suppl. 4): 41–7. doi:10.1111/jgh.12240.
- Samout N., Ettaya A., Bouzenna H., Ncib S., Elfeki A., Hfaiedh N. B eneficial effects of Plantago albicans on high-fat diet-induced obesity in rats. Biomed. Pharmacother., 2016 Dec; 84: 1768–1775. doi: 10.1016/j.biopha.2016.10.105.
- 26. Amri Z., Ghorbel A., Turki M., Akrout F.M., Ayadi F., Elfeki A., Hammami M. Effect of pomegranate extracts on brain antioxidant markers and cholinesterase activity in high fat-high fructose diet induced obesity in rat model. BMC Complement. Altern. Med., 2017. Jun 27; 17 (1): 339–9. doi: 10.1186/s12906-017-1842-9.
- Eppel G.A., Armitage J.A., Eikelis N., Head G.A., Evans R.G. Progression of cardiovascular and endocrine dysfunction in a rabbit model of obesity. Hypertens. Res., 2013 Jul; 36 (7): 588–95. doi: 10.1038/hr.2013.2.
- Larsen M.O., Rolin B., Wilken M., Carr R.D., Svendsen O. High-Fat High-Energy Feeding Impairs Fasting Glucose and Increases Fasting Insulin Levels in the Gettingen Minipig: Results from a Pilot Study. Ann. N.Y. Acad. Sci. 2002 Jun; 967: 414–23.
- Liang T., Alloosh M., Bell L.N., Fullenkamp A., Saxena R., Van Alstine W., Bybee P., Werling K., Sturek M., Chalasani N., Masuoka H.C. Liver Injury and Fibrosis Induced by Dietary Challenge in the Ossabaw Miniature Swine. PLoS ONE, 2015. 10(5): e0124173. doi:10.1371/journal.pone.0124173.
- Newell-Fugate A.E., Lenz K., Skenandore C., Nowak R.A., White B.A., Braundmeier-Fleming A. Effects of coconut oil on glycemia, inflammation, and urogenital microbial parameters in female Ossabaw mini-pigs. PLoS One. 2017 Jul 13; 12 (7): 20: e0179542. doi: 10.1371/journal.pone.0179542. eCollection 2017.
- Newell-Fugate A.E., Taibl J.N., Clark S.G., Alloosh M., Sturek M, Krisher R.L. Effects of Diet-Induced Obesity on Metabolic Parameters and Reproductive Function in Female Ossabaw Minipigs. Comp. Med., 2014; 64 (1): 44–9.



